|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGIE |
IMMUNOLOGIE |
MYCOLOGY |
PARASITOLOGY |
VIROLOGIE |
|
VIDEO LECTURE |
IMMUNOLOGIE –
CHAPITRE QUINZE
CMH: GENETIQUE
ET ROLE EN TRANSPLANTATION
Abdul
Ghaffar, Ph.D.
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Denis
Hudrisier, Ph.D.
Centre national de la recherche scientifique (CNRS) · Institute of
Pharmacology and Structural Biology
Université de Toulouse
|
|
EN ANGLAIS |
|
SHQIP-ALBANIAN |
|
EM PORTUGUES - PORTUGUESE |
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
|
|
OBJECTIFS DU COURS
Connaître le locus du CMH et les produits de ses gènes
Comprendre la base génétique de l’hétérogénéité du CMH dans la
population
Connaître la distribution des molécules du CMH sur différentes cellules
Connaître comment les antigènes du CMH sont détectés (typage tissulaire)
Comprendre le rôle du CMH en transplantation, immunité et pathologie
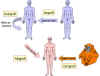 Figure 1 Types de greffes
Figure 1 Types de greffes |
DEFINITIONS
-
Antigène d’histocompatibilité
(transplantation)
Antigènes présents sur les cellules et les tissus qui
déterminent le rejet de ces derniers lorsqu’ils sont greffés
entre deux individus génétiquement différents
-
Antigènes du Complexe Majeur
d’Histocompatibilité (CMH)
Antigènes d’histocompatibilité qui provoquent une très forte
réponse immunitaire et prédominent lors des rejets de greffe
-
Complexe du CMH
Groupe de gènes présents sur un seul chromosome et codant pour
les antigènes du CMH
-
Système HLA (human leukocyte antigens ;
antigènes leucocytaires humains)
Antigènes du CMH de l’homme (initialement trouvés sur les
leucocytes)
-
Antigènes du système H-2
Antigènes du CMH de la souris
Types de greffes (Figure 1)
-
Xénogreffes
Greffes entre individus de différentes espèces (aussi connu sous
les noms de greffes hétérologues, de greffes xenogéniques ou
d’hétérogreffes)
-
Allogreffes
Greffes entre deux individus de la même espèce (aussi connu sous
les noms de greffes allogéniques ou d’homogreffes)
-
Isogreffes
Greffes entre deux individus génétiquement identiques de la même
espèce (vrais jumeaux ou animaux consanguins)
Haplotype
Un groupe de gènes présents sur un seul chromosome
|
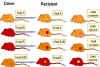 Figure 2 Règles de la transplantation
Figure 2 Règles de la transplantation
|
PRINCIPES DE LA
TRANSPLANTATION (Figure 2)
Un hôte immunocompétent reconnaît les antigènes étrangers sur les tissus
(ou cellules) greffés ce qui va conduire à une réponse immunitaire se
traduisant par le rejet de la greffe. Par ailleurs, si un hôte
immunodéprimé est greffé avec des cellules lymphoïdes immunocompétentes
d’un donneur non compatible, les cellules T réactives présentes dans le
greffon vont reconnaitre les antigènes étrangers sur le tissu de l'hôte
et endommager ce tissu.
Réaction du greffon contre
l’hôte
La durée de survie d’une greffe suit l’ordre suivant : xeno- < allo-
< iso- = auto- greffe. Le moment auquel le rejet est initié dépend
aussi de la disparité antigénique entre le donneur et le receveur de
la greffe. Les antigènes du CMH sont les contributeurs principaux du
rejet mais les antigènes mineurs d’histocompatibilité sont également
impliqués. Le rejet lié à des disparités entre antigènes mineurs
d’histocompatibilité peut être aussi rapide voire même plus rapide
que le rejet dû aux antigènes du CMH. Comme dans le cas des autres
réponses immunitaires, il y a une mémoire immunologique et une
réponse secondaire dans le rejet de greffe. Ainsi, une fois une
greffe rejetée par un receveur, une seconde greffe provenant du même
donneur ou d’un donneur possédant les mêmes antigènes
d’histocompatibilité sera rejetée beaucoup plus rapidement.
|
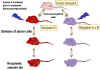 Figure 3 Maladie du greffon contre l’hôte
Figure 3 Maladie du greffon contre l’hôte |
Réaction du
greffon contre l’hôte
Les cellules lymphoïdes histocompatibles sont facilement acceptées
lorsqu'elles sont injectées à un hôte immunodéprimé. Cependant, les
lymphocytes T immunocompétents parmi les cellules greffées
reconnaissent les allo-antigènes et, en réponse, prolifèrent et
causent progressivement des dommages aux tissus et aux cellules
hôtes. Cela est connu sous le nom de maladie du greffon contre
l'hôte (GVH) (Figure 3), une maladie souvent fatale. Les
manifestations communes (Figure 4) de la réaction GVH sont la
diarrhée, l’érythème, la perte de poids, des malaises, de la fièvre,
des douleurs articulaires, etc… et finalement la mort.
|
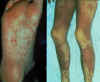 Figure 4 Maladie du greffon contre l’hôte
Figure 4 Maladie du greffon contre l’hôte |
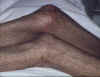 Réaction précoce du greffon contre l’hôte caractérisée par la présence
de
papules
lichénoïdes disséminées,
presque
confluentes et
hyperpigmentées
ainsi que l’apparition d’une nécrose
toxique
épidermique au niveau
genou
©
Bristol Biomedical Image Archive. Reproduit avec permission
Réaction précoce du greffon contre l’hôte caractérisée par la présence
de
papules
lichénoïdes disséminées,
presque
confluentes et
hyperpigmentées
ainsi que l’apparition d’une nécrose
toxique
épidermique au niveau
genou
©
Bristol Biomedical Image Archive. Reproduit avec permission
 Réaction du greffon contre l’hôte tardive, chronique avec plaques
scléreuses hyperpigmentées sur le dos ©
Bristol Biomedical Image Archive. Reproduit avec permission
Réaction du greffon contre l’hôte tardive, chronique avec plaques
scléreuses hyperpigmentées sur le dos ©
Bristol Biomedical Image Archive. Reproduit avec permission
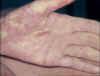 Réaction aigüe du greffon contre l’hôte tardive avec un érythème
palmaire marqué © Bristol Biomedical Image Archive. Reproduit avec
permission
Réaction aigüe du greffon contre l’hôte tardive avec un érythème
palmaire marqué © Bristol Biomedical Image Archive. Reproduit avec
permission
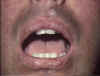 Réaction du greffon contre l’hôte présentant des modifications
lichenoïdes disséminées, précoces et chroniques des lèvres © Bristol
Biomedical Image Archive. Reproduit avec permission
Réaction du greffon contre l’hôte présentant des modifications
lichenoïdes disséminées, précoces et chroniques des lèvres © Bristol
Biomedical Image Archive. Reproduit avec permission
 Réaction aigüe du greffon contre l’hôte présentant une dégénérescence
hydropique des cellules basales avec des kératinocytes nécrotiques
inter-epidermaux
Réaction aigüe du greffon contre l’hôte présentant une dégénérescence
hydropique des cellules basales avec des kératinocytes nécrotiques
inter-epidermaux
© Bristol Biomedical Image Archive. Reproduit avec permission
 Réaction du greffon contre l’hôte; hyperkératose et hypergranulose
précoces, hyperkératose et hypergranulose chroniques précoces, acanthose
irrégulière, dégénérescence du corps cytoïde et basocellulaire
hydropique © Bristol Biomedical Image Archive. Reproduit avec permission
Réaction du greffon contre l’hôte; hyperkératose et hypergranulose
précoces, hyperkératose et hypergranulose chroniques précoces, acanthose
irrégulière, dégénérescence du corps cytoïde et basocellulaire
hydropique © Bristol Biomedical Image Archive. Reproduit avec permission
|
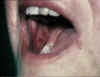 Erosions aigües de la muqueuse buccale dans la
réaction du greffon contre l’hôte. © Bristol Biomedical Image Archive. Reproduit avec permission
Erosions aigües de la muqueuse buccale dans la
réaction du greffon contre l’hôte. © Bristol Biomedical Image Archive. Reproduit avec permission |
 Figure 5 Le complexe génétique du CMH de l’homme
Figure 5 Le complexe génétique du CMH de l’homme |
LE COMPLEXE
GENETIQUE DU CMH
Le complexe du CMH contient un certain nombre de gènes qui codent pour
plusieurs antigènes qui, pour la plupart, influencent le rejet
d'allogreffe. Ces antigènes (et leurs gènes) peuvent être divisées en
trois grandes classes: classe I, classe II et classe III. Les antigènes
de classe II et de classe I sont exprimés sur les cellules et les tissus,
tandis que des antigènes de classe III sont des protéines présentes dans
les liquides biologiques sériques et autres (ex : C4, C2, facteur B, TNF).
Les antigènes issus des gènes de classe III ne jouent pas de rôle dans
le rejet du greffon.
CMH humain
Le complexe CMH humain est localisé sur le
chromosome 6.
CMH de classe I
Le complexe de gènes de classe I contient trois loci, B, C et A
et d'autres loci mineurs non définis (Figure 5). Chaque locus
majeur code pour un polypeptide; la chaîne alpha, qui contient
des déterminants antigéniques, est polymorphe (il y a plusieurs
allèles). Elle s’associe à la bêta-2-microglobuline (chaîne
béta-2-m), codée par un gène extérieur au complexe du CMH, et
exprimé à la surface des cellules. Sans la bêta-2 microglobuline,
les antigènes de classe I ne sont pas exprimés à la surface
cellulaire. Les personnes ayant un gène bêta-2-microglobuline
défectueux n'expriment aucun antigène de classe I et ont donc un
déficit en lymphocytes T cytotoxiques.
CMH de classe II
Le complexe de gènes de classe II contient également au moins
trois loci, DP, DQ et DR, chacun de ces locus codant pour une
chaîne polypeptidique alpha et une chaîne polypeptidique bêta
qui s'associent entre elles pour former les antigènes de classe
II. Comme les antigènes de classe I, les antigènes de classe II
sont aussi polymorphes. Le locus DR peut contenir plus d'un (jusqu’à
quatre) gènes codant pour une chaîne bêta fonctionnelle.
|
 Figure 6A Le complexe génétique du CMH de la souris
Figure 6A Le complexe génétique du CMH de la souris |
CMH de la souris
Le complexe du CMH de souris est localisé sur le chromosome
17.
CMH de classe I
Il consiste en deux loci majeurs, K et D. A la différence du complexe du
CMH humain, les gènes de classe I du CMH de la souris ne sont pas
ensemble mais séparés par les gènes de classe II et de classe III
(Figure 6A).
CMH de classe II
Le complexe des gènes de classe II contient deux loci, A et E, chacun
codant pour une chaîne alpha polypeptidique et une chaîne beta
polypeptidique, qui associées forment le CMH de classe II. Le complexe
des gènes de classe II de la souris est également connu comme la région
I et les gènes de ce complexe sont appelées gènes IR (gènes de réponse
immunitaire), car ils déterminent l'ampleur de la réponse immunitaire de
différentes souches de souris à certains antigènes. Les produits des
loci A et E sont aussi appelés antigènes IA et IE et sont collectivement
connus comme antigènes Ia.
|
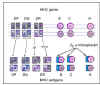 Figure 6B Expression co-dominante des antigènes du CMH
Figure 6B Expression co-dominante des antigènes du CMH |
ANTIGENES DU CMH
Nomenclature
Les spécificités HLA sont identifiées par une lettre de locus et un
nombre (A1, B5,…) et les haplotypes sont identifiés par l’ensemble
des spécificités individuelles (par exemple, A1, B7, Cw4, DP5, DQ10,
DR8). Les spécificités qui sont définies sur la base d’une analyse
génomique (PCR), sont formées de noms composés par une lettre pour
le locus et un numéro à quatre chiffres (par exemple A0101, B0701,
C0401, …)
Les spécificités du CMH de souris (système H-2) sont identifiées par
un numéro. Depuis que l’on dispose de souris de laboratoire
consanguines, chaque souche est homozygote et possède un haplotype
unique. L'haplotype CMH dans ces souches est désigné par une lettre
minuscule (a, b, d, k, q, s,…), par exemple, l'haplotype du CMH de
souris Balb/c est H2d.
Transmission
Les gènes du CMH sont hérités en bloc (haplotype), un de chaque
parent. Ainsi, un homme hétérozygote hérite d'un haplotype paternel
et d'un haplotype maternel, contenant chacune des trois locus de
classe I (B, C et A) et des trois locus de classe II (DP, DQ et DR).
Un individu hétérozygote héritera d'un maximum de 6 spécificités de
classe I (Figure 6). De même, l'individu va également hériter des
gènes DQ et DP et exprimer deux antigènes parentaux.
Comme la molécule du CMH de classe II se compose de
deux chaînes (alpha et bêta), avec des déterminants antigéniques (spécificités)
présents sur chaque chaîne et que les chaînes alpha et bêta de DR
peuvent s'associer en cis (les deux chaînes provenant du même
parent) ou en trans (une chaîne de chaque parent), un individu peut
alors avoir des spécificités DR supplémentaires (Figure 6B). Par
ailleurs, il y a plus d'un gène de chaîne DR bêta fonctionnel (non
représenté sur la figure). Ainsi, de nombreuses spécificités DR
peuvent être trouvées chez n'importe quel individu.
|
| |
Crossing-over
Normalement, les haplotypes sont hérités intacts et, donc, les antigènes
codés par les différents loci sont hérités ensemble (par exemple, A2, B27;
Cw2; DPw6; DQw9; DRw2). Cependant, parfois, il est existe un crossing-over (entrecroisement)
entre deux chromosomes parentaux, ce qui conduit à de nouveaux haplotypes
recombinants. Ainsi, toute spécificité codée par un locus peut se combiner
avec les spécificités des autres loci. Il en résulte une grande
hétérogénéité dans la configuration du CMH dans une population donnée.
Expression des
antigènes du CMH sur les cellules
Les antigènes du CMH sont exprimés à la surface cellulaire de façon co-dominante
: les produits des gènes paternels et maternels sont retrouvés sur la même
cellule. Cependant, toutes les cellules n’expriment pas les molécules du CMH
de classe I et de classe II. Alors que les antigènes de classe I sont
retrouvés sur toutes les cellules nucléées et les plaquettes, l’expression
des antigènes de classe II est plus sélective. Ils sont exprimés sur les
lymphocytes B, une proportion des macrophages et des monocytes, des cellules
associées la peau (cellules de Langerhans), les cellules dendritiques les
cellules épithéliales du thymus et, à l’occasion sur d’autres cellules.
Détection du CMH par
test sérologique
Les antigènes de classe I du CMH sont détectés par des tests sérologiques (Anticorps
et C’). Des sérums pour le typage tissulaire HLA ont été obtenus dans le
passé à partir de femmes multipares qui ont été exposées à des antigènes
paternels de l'enfant pendant l'accouchement et ont, par la suite, développé
des anticorps contre ces antigènes. Plus récemment, ces anticorps ont été
produits par la technologie des anticorps monoclonaux. Avec le passage de la
plupart des laboratoires à la PCR pour le typage tissulaire, l'utilisation
de la sérologie diminue rapidement.
Détection du CMH par
réaction leucocytaire mixte (MLR)
Il a été observé que les lymphocytes d'un donneur, lorsqu'ils sont cultivés
avec des lymphocytes d'un donneur non apparenté, sont stimulés à proliférer.
Il a été établi que cette prolifération est principalement due à une
disparité dans les antigènes du CMH de classe II (DR) et les lymphocytes T
d'un individu interagissent avec des cellules allogéniques portant les
antigènes du CMH classe II (cellules B, cellules dendritiques, cellules de
Langerhans,…). Cette réactivité a été appelé réaction leucocytaire mixte (MLR)
et a été utilisée pour étudier le degré d'histocompatibilité. Dans ce test,
les lymphocytes à tester (cellules répondeuses) sont mélangées avec les
leucocytes du receveur contenant des lymphocytes B et des monocytes
(cellules stimulatrices) irradiés ou traités à la mitomycine C. Les cellules
sont cultivées ensemble pendant 6 jours. Les cellules T répondeuses vont
reconnaître les antigènes de classe II étrangers présents sur le donneur et
subir une activation (synthèse de l'ADN et augmentation de taille:
blastogenèse) et une prolifération (mitogénèse). Les cellules T qui
répondent à des antigènes étrangers de classe II sont généralement des
cellules CD4 + de type Th-1. Ces changements sont mis en évidence par
l'addition de thymidine radioactive (tritiée, 3H) dans la culture et le
suivi de son incorporation dans l'ADN.
|
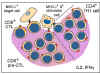 Figure 7 Activation des CTL au cours de la MLR
Figure 7 Activation des CTL au cours de la MLR |
Génération de
lymphocytes T cytotoxiques
Une autre conséquence de l'interaction des antigènes du CMH avec les
cellules T est l'induction de lymphocytes T cytotoxiques. Lorsque les
lymphocytes T sont mis en culture en présence de lymphocytes allogéniques,
en plus de subir la mitose (MLR), ils deviennent également cytotoxiques pour
les cellules stimulatrices utilisées dans la MLR (Figure 7). Ainsi, les
lymphocytes T d’haplotype «x» cultivés plus de 5 - 7 jours avec des
lymphocytes B d’un haplotype «y» vont subir la mitose et les lymphocytes T
survivants deviennent cytotoxiques pour les cellules de l'haplotype 'y'.
L'induction de la mitose dans la MLR nécessite une disparité des seuls
antigènes de classe II alors que l'induction de lymphocytes T cytotoxiques (CTL)
nécessite une disparité des deux antigènes de classe I et de classe II.
Cependant, une fois que les cellules cytotoxiques ont été induites, les
cellules effectrices cytotoxiques n’ont besoin de reconnaître que les
antigènes de classe I pour provoquer la cytotoxicité.
|
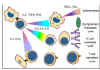 Figure
8 Mécanismes de la destruction des allogreffes Figure
8 Mécanismes de la destruction des allogreffes |
REJET D’ALLOGREFFE
La signification clinique du CMH est évidente lors de
transplantation d'organes. Les cellules et les tissus sont régulièrement
transplantés dans le cadre de traitements pour un certain nombre de
maladies. Cependant, la réaction de l'hôte contre les allo-antigènes du
greffon (HVG) conduit à son rejet et est le principal obstacle à la
transplantation d'organes. Le temps de rejet d'un greffon peut varier
suivant la nature antigénique de la greffe et l'état immunitaire de
l'hôte et il est déterminé par les mécanismes immunitaires impliqués
(Figure 8 et Tableau 1).
Rejet hyper-aigu
Cela se produit dans le cas où le receveur possède des anticorps
préformés à un titre élevé. Une greffe peut montrer des signes de
rejet en quelques minutes à quelques heures en raison de la réaction
immédiate d'anticorps et de complément.
|
| |
Rejet accéléré (réponse
secondaire)
La transplantation d'une seconde greffe, qui partage un grand nombre de
déterminants antigéniques avec la première, entraîne un rejet rapide (2 - 5
jours). Il est dû à la présence de lymphocytes T sensibilisés au cours du
premier rejet de greffe. Le rejet accéléré est médié par la production
immédiate de lymphokines, l'activation des monocytes et des macrophages, et
l'induction de lymphocytes cytotoxiques.
|
Table 1. Différents profils de
rejets de greffes |
|
Type de rejet |
Temps nécessaire |
Cause |
|
Hyper-aigu
Accéléré
Aigu
Chronique |
Minutes-heures
Jours
Jours-semaines
Mois-années |
Anticorps anti-donneur préformés et complément
Réactivation de cellules T sensibilisées
Activation primaire de cellules T
Causes peu claires: anticorps, complexes immuns, réactions
cellulaires lentes, récurrence de la maladie. |
Rejet aigu (réponse
primaire)
La réaction normale qui suit la première greffe d'un transplant étranger
prend 1-3 semaines. Ceci est connu comme le rejet aigu et est médié par les
lymphocytes T sensibilisés aux antigènes de l'allogreffe de classes I et II,
le déclenchement de la production de lymphokines et l'activation des
monocytes et des macrophages.
|
 Figure
9A Figure
9A
Rejet d’une greffe de rein © Bristol Biomedical Image Archive. Reproduit
avec permission
|
Rejet chronique
Certains greffons peuvent survivre pendant des mois, voire des années, mais
présentent soudainement des symptômes de rejet. Ceci est considéré comme un
rejet chronique dont le mécanisme n'est pas entièrement clair. Les
hypothèses sont que cela peut être dû à une infection, les mêmes causes qui
ont conduit au dysfonctionnement de l’organe initial, une rupture de
tolérance induite par le greffe, etc…
Le fœtus comme une
allogreffe
Chez des mammifères non-consanguins, le fœtus porte des antigènes dérivés à
la fois du père et de la mère. Le fœtus est ainsi clairement une allogreffe
et la mère devrait normalement reconnaître le fœtus comme étranger et le
rejeter. Néanmoins, ces rejets se produisent rarement. Les mammifères se
sont adaptés d'une manière qui permet l'implantation de leurs embryons dans
l'utérus de la mère et leur survie. Il y a plusieurs mécanismes qui jouent
un rôle, dont le plus important est la structure unique et la fonction du
placenta.
Les sites et les tissus
immuno-privilégiés
Il y a certains endroits dans le corps dans lequel les allogreffes ne sont
pas facilement rejetées. Il s'agit notamment du cerveau, de la chambre
antérieure de l'œil, des testicules, du tubule rénal, de l'utérus, etc… Cela
provient du fait que ces sites peuvent manquer de bon drainage lymphatique.
En outre, ces tissus peuvent exprimer des molécules telles que le ligand de
Fas qui permet de tuer n'importe quelle cellule immunitaire pouvant entrer
en contact avec ces tissus. En outre, ces tissus, peuvent avoir d'autres
mécanismes suppresseurs de l’immunité. De même, il y a des tissus qui
peuvent être transplantés sans être histocompatibles et sans être rejetés.
Ces tissus sont appelés tissus immunologiquement privilégiés. La greffe de
cornée qui bénéficie du taux de réussite le plus élevé de toute forme de
transplantation d'organes est un excellent exemple. La faible incidence de
rejet du greffon est impressionnante malgré l’absence de correspondance
entre les antigènes HLA du donneur et du receveur. Il y a beaucoup de
raisons pour expliquer pourquoi de telles greffes sont acceptées. L’absence
de vascularisation du lit de la greffe de cornée empêche les alloantigènes
d'atteindre les tissus lymphoïdes régionaux. En outre, les antigènes de
cornée peuvent être masqués. Pris ensemble, ces mécanismes limitent
l’activation du système immunitaire du receveur.
STRATÉGIES POUR AUGMENTER LA SURVIE DE LA
GREFFE
Dans la pratique clinique, les programmes de transplantation les plus réussis
ont été obtenus avec les greffes de rein et de cornée. Cependant, d'autres
organes sont transplantés avec succès avec une fréquence croissante. Le succès
de ces programmes est due à une meilleure compréhension des mécanismes
immunologiques, de la caractérisation des antigènes du CMH et au développement
d'agents immunosuppresseurs plus efficaces.
|
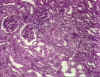 Figure
9B Figure
9B
Rejet chronique d’une greffe de rein © Bristol Biomedical Image Archive. Reproduit avec permission
|
Sélection du donneur
Basé sur les expériences approfondies avec les transplantations rénales,
certaines lignes directrices peuvent être suivies pour la sélection des
donneurs et la préparation de receveur pour la plupart des transplantations
d'organes. Le plus important dans la sélection des donneurs est l'identité
du CMH avec le bénéficiaire; un jumeau identique est le donneur idéal. Les
greffes à partir d'un donneur HLA compatible ont 95-100% de chances de
succès. Un parent ou un frère possédant un haplotype identique doivent
correspondre au niveau de la région HLA D. Un donneur différent sur les deux
haplotype peut également convenir s’il existe une correspondance raisonnable
pour les antigènes de la région D. Les organes provenant d'un cadavre
présentant une ou deux diféfrence sur HLA DR avec le receveur ont également
été utilisés avec un certain succès. Dans tous les cas, une compatibilité
ABO est essentielle.
Préparation du
receveur
Le receveur doit être sans infection et ne doit pas être hypertendu. Une à
cinq transfusions de 100 à 200 ml de sang total du donneur à 1-2 semaines
d'intervalle améliore la survie du greffon et est pratiquée lorsque cela est
possible.
Immunosuppression
Le traitement immunosuppresseur est la partie la plus essentielle de l'allo-transplantation.
La famille la plus récente et efficace des agents immunosuppresseurs
comprend des agents comme la cyclosporine A, le FK-506 (tacrolimus) et la
rapamycine. La cyclosporine A et le FK506 inhibent la synthèse d’IL2 faisant
suite à l’interaction entre l’antigène et le récepteur à l’antigène alors
que la rapamycine interfère avec la transduction du signal suivant
l’interaction entre l’IL2 et son récepteur. Ainsi, ces trois agents vont
bloquer la prolifération des cellules T en réponse à l'antigène. D'autres
agents chimiques utilisés pour prévenir le rejet de greffe et leurs modes
d'action ont été répertoriés dans le Tableau 2. L’irradiation corporelle
totale est utilisée chez les patients atteints de leucémie avant la
transplantation de moelle osseuse. Les antisérums produits contre des
cellules T (immunoglobulines anti-thymocytes: ATG) ou d’antigènes de surface
(CD3, CD4, CD45 sur les lymphocytes T activés, CD25: récepteurs IL-2) sont
également utilisés pour réaliser une immunosuppression (Tableau 2).
|
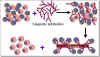 Figure 10 Elimination des cellules T dans un greffe de moelle osseuse
Figure 10 Elimination des cellules T dans un greffe de moelle osseuse |
Stratégies pour la
transplantation de moelle osseuse
Dans la transplantation de moelle osseuse, le facteur le plus crucial dans
la sélection des donneurs est la compatibilité du CMH de classe II. Une fois
de plus, un jumeau identique est le donneur idéal. Les lymphocytes T peuvent
être éliminés des greffons moins compatibles en utilisant des anticorps
monoclonaux (Figure 10). Le receveur doit être immunodéprimé. Les cellules
malignes doivent être éliminés du sang du receveur (dans le cas de tumeurs
malignes du sang). Le méthotrexate, la cyclosporine et la prednisone sont
souvent utilisés pour contrôler la maladie du greffon contre l’hôte.
|
| |
Autres greffes
Les greffes de cornée n’expriment pas d’antigènes de région D et par
conséquent la survie est fréquente. Les petits greffons sont mieux acceptés
et les corticoïdes sont utiles pour limiter le rejet.
Les allogreffes cutanées ont un taux de réussite très faible et le
traitement immunosuppresseur est relativement inefficace. Néanmoins, elles
sont souvent utilisées pour fournir une protection temporaire et favoriser
la guérison de dommages sévères de la peau. Il n'y aura pas de rejet si
l'hôte et le donneur sont parfaitement adaptés (jumeaux identiques) ou si le
receveur est rendu tolérant aux antigènes du CMH du donneur (chimères de
moelle osseuse).
|
Table 2. Exemples d’agents
immunosuppresseurs |
|
Agent |
Mode
d’action possible |
Application(s) |
|
corticostéroïdes, prednisone
cyclosporine, FK-506
rapamycine
azathioprine, 6-MP
methotrexate
cyclophosphamide, melphalan |
anti-inflammatoire, affecte la recirculation des
cellules T et des neutrophiles T
inhibition de la synthèse d’Il-2
blocage du signal IL2-IL2R
métabolisme des purines
métabolisme de l’acide folique
alkylation de l’ADN, de l’ARN, des protéines |
Transplantation d’organe, hypersensibilité, maladies
auto-immunes
Transplantation d’organe
Transplantation d’organe
Transplantation d’organe, auto-immunité
Transplantation d’organe, auto-immunité
Transplantation d’organe, auto-immunité |
Association du CMH
avec les maladies
Un certain nombre de maladies se produisent à une fréquence plus élevée chez
les individus en possession de certains haplotypes du CMH. Les plus
importantes sont la spondylarthrite ankylosante (B27), la maladie coeliaque
(DR3) et le syndrome de Reiter (B27). D'autres maladies associées à des
spécificités différentes du CMH sont répertoriées dans le Tableau 3. Aucune
raison précise n’est connue pour cette association. Toutefois, plusieurs
hypothèses ont été proposées tels que: similitude antigénique entre les
pathogènes et CMH, hypo-et hyper-réactivité antigénique contrôlée par les
gènes de classe II.
|
Table 3. Exemples
d’associations significatives entre HLA et maladies |
|
Maladie |
Allèles associés |
Fréquence chez les |
Risque relatif |
|
Patients |
Contrôles |
|
Spondylarthrite ankylosante
|
B27
|
90
|
9
|
87.4
|
| Maladie de Reiter
(syndrome) |
B27 |
79 |
9 |
37.0 |
| Uvéite antérieure aigüe
(Figure 11) |
B27 |
52 |
9 |
10.4 |
| Psoriasis commun (Figure 11) |
Cw6 |
87
|
33 |
13.3 |
| Dermatite herpétiforme (Figure
11) |
DR3 |
85 |
26
|
15.4 |
| Maladie coeliaque |
DR3 |
79 |
26
|
10.8 |
| Diabète insulino-dépendant |
DR3/4 |
91 |
57 |
7.9 |
|
 Figure 11 Psoriasis de la main © Bristol
Biomedical Image Archive. Reproduit avec permission
Figure 11 Psoriasis de la main © Bristol
Biomedical Image Archive. Reproduit avec permission |
 Psoriasis © Bristol Biomedical Image Archive. Reproduit avec permission
Psoriasis © Bristol Biomedical Image Archive. Reproduit avec permission
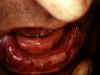 Dermatite Herpétiforme: Mouth Mucosa © Bristol Biomedical Image Archive. Reproduit avec permission
Dermatite Herpétiforme: Mouth Mucosa © Bristol Biomedical Image Archive. Reproduit avec permission
 Uvéite © Bristol Biomedical Image Archive. Reproduit avec permission
Uvéite © Bristol Biomedical Image Archive. Reproduit avec permission
|
| |
Vous avez appris:
Le rôle du CMH dans les maladies de l’hôte contre
le greffon (HVG) et du greffon contre l'hôte (GVH).
La génétique des deux molécules du CMH.
Le rôle du polymorphisme et du crossing-over dans l'hétérogénéité
des antigènes du CMH dans une population.
Les méthodes de détection des antigènes du CMH (typage tissulaire).
Les mécanismes immunitaires du rejet de greffe.
Les stratégies pour une transplantation réussie
|
|
|
 Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
This page last changed on
Saturday, August 09, 2014
Page maintained by
Richard Hunt
Please report any problems to
richard.hunt@uscmed.sc.edu
|

 Figure 2 Règles de la transplantation
Figure 2 Règles de la transplantation
 Figure 3 Maladie du greffon contre l’hôte
Figure 3 Maladie du greffon contre l’hôte Figure 4 Maladie du greffon contre l’hôte
Figure 4 Maladie du greffon contre l’hôte Réaction précoce du greffon contre l’hôte caractérisée par la présence
de
papules
lichénoïdes disséminées,
presque
confluentes et
hyperpigmentées
ainsi que l’apparition d’une nécrose
toxique
épidermique au niveau
genou
©
Bristol Biomedical Image Archive. Reproduit avec permission
Réaction précoce du greffon contre l’hôte caractérisée par la présence
de
papules
lichénoïdes disséminées,
presque
confluentes et
hyperpigmentées
ainsi que l’apparition d’une nécrose
toxique
épidermique au niveau
genou
©
Bristol Biomedical Image Archive. Reproduit avec permission Réaction aigüe du greffon contre l’hôte tardive avec un érythème
palmaire marqué © Bristol Biomedical Image Archive. Reproduit avec
permission
Réaction aigüe du greffon contre l’hôte tardive avec un érythème
palmaire marqué © Bristol Biomedical Image Archive. Reproduit avec
permission Réaction aigüe du greffon contre l’hôte présentant une dégénérescence
hydropique des cellules basales avec des kératinocytes nécrotiques
inter-epidermaux
Réaction aigüe du greffon contre l’hôte présentant une dégénérescence
hydropique des cellules basales avec des kératinocytes nécrotiques
inter-epidermaux Erosions aigües de la muqueuse buccale dans la
réaction du greffon contre l’hôte. © Bristol Biomedical Image Archive. Reproduit avec permission
Erosions aigües de la muqueuse buccale dans la
réaction du greffon contre l’hôte. © Bristol Biomedical Image Archive. Reproduit avec permission Figure 5 Le complexe génétique du CMH de l’homme
Figure 5 Le complexe génétique du CMH de l’homme Figure 6A Le complexe génétique du CMH de la souris
Figure 6A Le complexe génétique du CMH de la souris Figure 6B Expression co-dominante des antigènes du CMH
Figure 6B Expression co-dominante des antigènes du CMH Figure 7 Activation des CTL au cours de la MLR
Figure 7 Activation des CTL au cours de la MLR Figure
8 Mécanismes de la destruction des allogreffes
Figure
8 Mécanismes de la destruction des allogreffes Figure
9A
Figure
9A  Figure
9B
Figure
9B Figure 10 Elimination des cellules T dans un greffe de moelle osseuse
Figure 10 Elimination des cellules T dans un greffe de moelle osseuse Figure 11 Psoriasis de la main © Bristol
Biomedical Image Archive. Reproduit avec permission
Figure 11 Psoriasis de la main © Bristol
Biomedical Image Archive. Reproduit avec permission Psoriasis © Bristol Biomedical Image Archive. Reproduit avec permission
Psoriasis © Bristol Biomedical Image Archive. Reproduit avec permission Uvéite © Bristol Biomedical Image Archive. Reproduit avec permission
Uvéite © Bristol Biomedical Image Archive. Reproduit avec permission




