|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGY |
IMMUNOLOGIE |
MYCOLOGY |
PARASITOLOGY |
VIROLOGIE |
|
VIDEO LECTURE |
IMMUNOLOGIE – CHAPITRE
NEUF
CELLULES IMPLIQUEES DANS LES REPONSES IMMUNES ET LA RECONNAISSANCE DE
L’ANTIGÈNE
Gene Mayer,
Ph.D.
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Jennifer Nyland, Ph.D.
Assistant Professor of Pathology, Microbiology and Immunology
University of South Carolina
Denis
Hudrisier, Ph.D.
Centre national de la recherche scientifique (CNRS) · Institute of
Pharmacology and Structural Biology
Université de Toulouse
|
|

 |
|
EN ANGLAIS |
|
EM PORTUGUES - PORTUGUESE |
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
LECTURE
Male et al.
Immunology
7ème édition
chapîtres 1 et
2 |
|
OBJECTIFS DU COURS
Présenter les interactions cellulaires et les molécules requises pour
l’immunité spécifique
Décrire l’immunité spécifique et les cellules impliquées
 Globule blanc (lymphocyte) dans un vaisseau capillaire (TEM x16,210) ©
Dennis Kunkel
Microscopy, Inc. Used with permission
Globule blanc (lymphocyte) dans un vaisseau capillaire (TEM x16,210) ©
Dennis Kunkel
Microscopy, Inc. Used with permission |
VUE D’ENSEMBLE
Le système immunitaire s’est développé pour protéger l'hôte contre les agents
pathogènes et autres substances étrangères. La discrimination du SOI et du NON-SOI
est l'une des caractéristiques du système immunitaire. Il existe deux sites
principaux dans lesquels les agents pathogènes peuvent résider: les espaces
extracellulaires des tissus ou l’intérieur d’une cellule hôte, et le système
immunitaire utilise différentes façons de combattre des agents pathogènes
présents dans ces deux types de sites. Bien que les réponses immunitaires sont
adaptées à l'agent pathogène et à l'endroit où il réside, la plupart des agents
pathogènes peuvent provoquer à la fois une réponse anticorps et une réponse à
médiation cellulaire, qui peuvent tous deux contribuer à débarrasser l'hôte de
l'agent pathogène. Cependant, une réponse anticorps ou une réponse à médiation
cellulaire peut être plus importante pour la défense contre un agent pathogène
particulier.
Pathogènes extracellulaires
Les anticorps constituent la principale voie de défense contre les
pathogènes extracellulaires et agissent de trois façons principales:
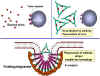
- Neutralisation (Figure 1a)
En se liant aux substances pathogènes ou étrangères, les anticorps
peuvent bloquer la liaison de l'agent pathogène à ses cibles. Par
exemple, des anticorps dirigés contre les toxines bactériennes peuvent
empêcher la liaison de la toxine à des cellules hôtes rendant ainsi la
toxine inefficace. De même, la liaison d'anticorps à un virus ou un
pathogène bactérien peut bloquer la fixation de l'agent pathogène à sa
cellule cible, empêchant ainsi l'infection ou la colonisation.
- L'opsonisation (Figure 1b)
La liaison de l'anticorps à une substance pathogène ou étrangère conduit
à opsoniser cette substance et à faciliter son absorption et sa
destruction par les cellules phagocytaires. La région Fc de l'anticorps
interagit avec les récepteurs Fc présents sur les cellules phagocytaires
rendant plus facile la phagocytose de l'agent pathogène.
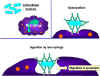
- L'activation du complément (Figure 1c)
L'activation de la cascade du complément par l'anticorps peut entraîner
la lyse de certaines bactéries. En outre, certains éléments de la
cascade du complément C3b (par exemple) peuvent opsoniser les agents
pathogènes et faciliter leur absorption grâce à des récepteurs du
complément présents sur les cellules phagocytaires.
|
|
Figure 1
|
A
 Les anticorps peuvent fixer et neutraliser une toxine bactérienne,
l'empêchant d'interagir avec les cellules hôtes et de provoquer la
pathologie. La toxine non liée peut réagir avec les récepteurs de la
cellule hôte, tandis que le complexe toxine: anticorps ne le peut pas.
Les anticorps peuvent également neutraliser les particules virales ainsi
que des cellules bactériennes en se liant à elles et en les inactivant.
Le complexe antigène: anticorps est finalement récupéré et dégradé par
les macrophages. Le recouvrement d’antigène par les anticorps rend
l’antigène reconnaissable comme étrangère par les phagocytes
(macrophages et leucocytes polynucléaires), qui peuvent alors l’ingérer
et le détruire : c’est l’opsonisation.
Les anticorps peuvent fixer et neutraliser une toxine bactérienne,
l'empêchant d'interagir avec les cellules hôtes et de provoquer la
pathologie. La toxine non liée peut réagir avec les récepteurs de la
cellule hôte, tandis que le complexe toxine: anticorps ne le peut pas.
Les anticorps peuvent également neutraliser les particules virales ainsi
que des cellules bactériennes en se liant à elles et en les inactivant.
Le complexe antigène: anticorps est finalement récupéré et dégradé par
les macrophages. Le recouvrement d’antigène par les anticorps rend
l’antigène reconnaissable comme étrangère par les phagocytes
(macrophages et leucocytes polynucléaires), qui peuvent alors l’ingérer
et le détruire : c’est l’opsonisation.B
 Opsonisation et phagocytose d’une bactérie
Opsonisation et phagocytose d’une bactérie
C
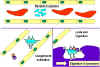 Activation du système du complément par les anticorps recouvrant une
cellule bactérienne. Les anticorps liés forment un récepteur pour la
première protéine du système du complément, ce qui finit par former un
complexe protéique à la surface de la bactérie qui, dans certains cas,
peut tuer la bactérie directement, mais plus généralement favorise son
absorption et la destruction par les phagocytes. Ainsi, les anticorps
peuvent cibler les agents pathogènes et leurs produits pour permettre
leur élimination par les phagocytes
Activation du système du complément par les anticorps recouvrant une
cellule bactérienne. Les anticorps liés forment un récepteur pour la
première protéine du système du complément, ce qui finit par former un
complexe protéique à la surface de la bactérie qui, dans certains cas,
peut tuer la bactérie directement, mais plus généralement favorise son
absorption et la destruction par les phagocytes. Ainsi, les anticorps
peuvent cibler les agents pathogènes et leurs produits pour permettre
leur élimination par les phagocytes
|
 Figure 2
Figure 2
Mécanismes des défenses immunitaires de l’hôte contre les
infections intracellulaires par des virus. Les cellules infectées par
les virus sont reconnues par des cellules T spécialisées appelées
lymphocytes T cytotoxiques (CTLs) qui vont tuer directement les cellules
infectées. Le mécanisme lytique met en jeu l’activation de nucléases à
l’intérieur de la cellule infectée qui vont cliver l’ADN de l’hôte et du
virus.
|
Pathogènes
extracellulaires
Parce que les anticorps ne pénètrent pas dans les
cellules hôtes, ils sont inefficaces contre les pathogènes intracellulaires.
Le système immunitaire utilise une approche différente pour faire face à ce
type de pathogènes. Les réponses à médiation cellulaire sont le principal
moyen de défense contre les pathogènes intracellulaires et l'approche est
différente selon l'endroit où l'agent pathogène réside dans la cellule hôte
(par exemple, dans le cytosol ou dans des vésicules). Par exemple, la
plupart des virus et certaines bactéries se trouvent dans le cytoplasme de
la cellule hôte, cependant, certaines bactéries et parasites vivent dans les
endosomes de la cellule hôte infectée. Le principal moyen de défense contre
les agents pathogènes dans le cytosol est constitué par les lymphocytes T
cytotoxiques (Tc ou CTL). En revanche, le principal moyen de défense contre
un agent pathogène présent dans les vésicules est constitué d’un sous-groupe
de lymphocytes T helper (Th1).
-
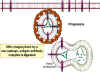
Les lymphocytes T cytotoxiques (Figure 2)
Les CTL sont un sous-groupe de lymphocytes T qui expriment un antigène
unique à leur surface appelé CD8. Ces cellules reconnaissent les
antigènes du pathogène qui sont présentées à la surface de la cellule
infectée et vont alors tuer la cellule, empêchant ainsi la propagation
de l'infection aux cellules voisines. Les CTL tuent en induisant
l'apoptose de la cellule infectée.
|
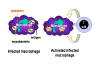 Figure 3
Figure 3
Mécanisme de défense de l’hôte contre les infections
mycobactériennes. Les mycobactéries qui ont infecté les macrophages
résident dans des vésicules cytoplasmiques qui résistent à la fusion
avec les lysosomes, évitant ainsi la destruction de la bactérie par les
actions microbicides du macrophage. Cependant, lorsque les cellules T
appropriées reconnaissent le macrophage infecté, elles libèrent des
molécules d’activation des macrophages qui induisent la fusion des
vésicules contanenat les mycobactéries avec les lysosomes et la
réalisation des actions bactéricides du macrophage.
|
-
Les cellules T auxiliaires Th1 (Figure 3)
Les cellules Th sont un sous-groupe de lymphocytes T qui expriment un
antigène unique à leur surface appelé CD4. Une sous-population de
lymphocytes T, les cellules Th1, constitue le principal moyen de défense
contre les pathogènes intracellulaires qui vivent à l'intérieur de
vésicules. Les cellules Th1 reconnaissent les antigènes de l'agent
pathogène qui sont exprimés à la surface des cellules infectées et
libèrent alors des cytokines qui activent la cellule infectée. Une fois
activée, la cellule infectée peut alors tuer l'agent pathogène. Par
exemple, Mycobacterium tuberculosis, l'agent causal de la tuberculose,
infecte les macrophages, mais n'est pas tué parce qu'il bloque la fusion
des lysosomes avec les endosomes dans lesquels il réside. Les cellules
Th1 qui reconnaissent les antigènes de M. tuberculosis à la surface des
macrophages infectés peuvent sécréter des cytokines qui activent les
macrophages. Après activation, la fusion des lysosomes avec les
endosomes a lieu et les bactéries sont tués.
Bien que les réponses immunitaires sont adaptées à l'agent pathogène et
à l'endroit où réside l'agent pathogène, la plupart des agents
pathogènes peut provoquer à la fois une réponse anticorps et une réponse
à médiation cellulaire, qui peuvent tous deux contribuer à débarrasser
l'hôte de l'agent pathogène. Cependant, la réponse anticorps ou la
réponse à médiation cellulaire peut être plus important pour la défense
contre un agent pathogène donné.
|
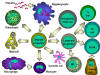 Figure 4
Figure 4
Toutes les cellules hématopoïétiques dérivent de cellules
souches pluripotentes qui donnet lieux à deux grands lignages : le
lignage lymphoïde et le lignage myéloïde. Le précurseur lymphoïde commun
peut se différencier en lymphocytes T ou B selon le microenvironnement
dans lequel il se trouve. Chez lles mammifères, les lymphocytes T se
développent dans le thymus alors que les lymphocytes B se développent
dans le foie fétal et dans la moelle osseuse. Le terme AFC fait
référence aux cellules productrices d’anticorps (antibody-forming cell)
, l’AFC la plus différenciée étant le plasmocyte. Les cellules NK
proviennent également du précurseur lymphoïde. Les cellules myéloïdes se
différencient pour former les types cellulaires présentés sur la gauche.
Le terme granulocyte est utilisé pour désigner collectivement les
éosinophiles, neutrophiles et basophiles.
|
CELLULES DU SYSTÈME IMMUNITAIRE
Toutes les cellules du système immunitaire proviennent d'une cellule souche
hématopoïétique présente dans la moelle osseuse et qui donne lieu à deux grandes
lignages cellulaires : l’un, issu d’une cellule souche myéloïde, et l’autre,
d’une cellule progénitrice lymphoïde (Figure 4). Ces deux progéniteurs donnent
naissance respectivement aux cellules myéloïdes (monocytes, macrophages,
cellules dendritiques, mastocytes, granulocytes et mégacaryocytes) et aux
cellules lymphoïdes (lymphocytes T, lymphocytes B et cellules tueuses naturelles
(NK). Ces cellules constituent l’ensemble des composants cellulaires des
réponses innées (non spécifique) et adaptatives (spécifique) du système
immunitaire.
Cellules du système immunitaire
inné
Les cellules du système immunitaire inné comprennent les cellules
phagocytaires (monocytes, macrophages et neutrophiles), les cellules NK, les
basophiles, les mastocytes, les éosinophiles et les plaquettes. Les rôles de
ces cellules ont été discutés précédemment (voir immunité non-spécifique).
Les récepteurs de ces cellules sont des récepteurs de reconnaissance de
motifs (PRR) qui reconnaissent des motifs moléculaires retrouvés sur les
agents pathogènes (motifs moléculaires associés à des pathogènes, PAMPS).
Cellules qui connectent les systèmes
immunitaires innés et adaptatifs
Un sous-groupe spécialisé de cellules appelées cellules présentatrices
d'antigène (CPA) forment une population hétérogène de leucocytes qui jouent
un rôle important dans l'immunité innée et permettent aussi l’établissement
d’un lien avec le système immunitaire adaptatif en participant à
l'activation des cellules T auxiliaires (cellules Th). Ces cellules
comprennent les cellules dendritiques et les macrophages. Un trait
caractéristique des APC est l'expression de molécules de surface cellulaire
codées par les gènes du complexe majeur d'histocompatibilité, appelés
molécules de classe II du CMH. Les lymphocytes B expriment également les
molécules de classe II du CMH et fonctionnent aussi comme des APC, même si
elles ne sont pas considérées comme faisant partie du système immunitaire
inné. En outre, certaines autres cellules (par exemple, les cellules
épithéliales thymiques) peuvent exprimer les molécules du CMH de classe II
et peuvent fonctionner comme APC.
Cellules du système immunitaire adaptatif
Les cellules qui composent le système adaptatif (spécifique) comprennent les
lymphocytes B et T. Après exposition à l'antigène, les lymphocytes B se
différencient en plasmocytes dont la fonction principale est la production
d'anticorps. De même, les cellules T peuvent se différencier soit en
cellules T cytotoxiques (Tc) ou T auxiliaires (Th), ces dernières existant
notamment sous deux types de cellules appelées Th1 et Th2.
Il existe un certain nombre de marqueurs de surface cellulaire qui sont
utilisés dans les laboratoires cliniques pour distinguer les cellules B, les
cellules T ainsi que leurs sous-populations. Celles-ci sont résumées dans le
tableau 1.
|
| |
|
Table 1. Principaux
marqueur permettant de distinguer les cellules T et B |
| Marqueur |
B cellules |
Tc |
Th |
| CD3 |
- |
+ |
+ |
| CD4 |
- |
- |
+ |
| CD8 |
- |
+ |
- |
| CD19 et/ou CD20 |
+ |
- |
- |
| CD40 |
+ |
- |
- |
| Récepteur à l’antigène |
BCR (Ig de surface) |
TCR |
TCR |
|
 Figure 5
Figure 5
Les récepteurs à l’antigène des lymphocytes B possèdent
deux sites de liaison à l’antigène alors que ceux des lymphocytes T n’en
possèdent qu’un seul.
|
SPÉCIFICITÉ DE LA
RÉPONSE IMMUNE ADAPTATIVE
La spécificité de la réponse immunitaire adaptative est
portée par les récepteurs à l'antigène présents sur les lymphocytes T et B,
c’est à dire le TCR et le BCR. Le TCR et le BCR sont semblables en ce que chaque
récepteur est spécifique d’un déterminant antigénique, mais ils diffèrent en ce
que les BCR sont divalents tout TCR sont monovalents (Figure 5). Une conséquence
de cette différence est que tandis que les cellules B peuvent avoir leurs
récepteurs d'antigène réticulé par un antigène, TCR ne peut pas. Ceci a des
implications sur la manière dont les lymphocytes B et T peuvent s'activent.
|
| |
Chaque lymphocyte B et T posséde un récepteur qui est spécifique pour un
déterminant antigénique particulier et il existe un répertoire large de
récepteurs antigéniques exprimés par des cellules B et T. La façon dont ces
récepteurs sont générés a été l’objet de beaucoup d’intérêt de la part des
immunologistes au cours des dernières années. Deux hypothèses ont été proposées
pour expliquer la génération de ces récepteurs : une hypothèse instructionniste
et l’hypothèse de la sélection clonale.
Hypothèse instructionniste
L’hypothèse instructionniste prévoit qu’il y aurait un récepteur commun codé
de façon germinale et que les différents récepteurs sont générés en
utilisant l’antigène comme matrice. Chaque antigène causerait le repliement
du récepteur commun pur qu’il s’adapte à la structure de l’antigène. Bien
que cette hypothèse soit simple et attractive, elle ne correspondait pas à
ce qui était connu de la structure des protéines (perçue comme dictée par la
séquence en acides aminés). De plus, cette hypothèse ne permettait pas
d’expliquer la discrimination entre le Soi et le Non Soi car on ne
comprenait pas pourquoi le récepteur commune ne pourrait pas s’adapter à un
antigène du Soi.
Hypothèse de la sélection clonale
La théorie de la sélection clonale propose que de nombreux récepteurs
pourraient être codés à partir de la configuration germinale des gènes, un
pour chaque déterminant antigénique contre lequel un individu sera apte à
générer une réponse immunitaire. L’antigène sélectionnerait alors les clones
de lymphocytes porteurs d’un récepteur approprié. Les quatre principes de
base de l’hypothèse de la sélection clonale sont :
- Chaque lymphocyte porte un seul type de récepteur avec une
spécificité unique.
- L’interaction entre la molécule étrangère et le récepteur du
lymphocyte capable de lier cette molécule avec une haute affinité
conduit à l’activation du lymphocyte.
- La cellule effectrice différenciée résultant de l’activation du
lymphocyte porte des récepteurs d’une spécificité identique à celle du
lymphocyte parental d’où la cellule différenciée provient.
- Les lymphocytes portant des récepteurs dirigés contre des molécules
du Soi sont détruites précocement au cours du développement des cellules
lymphoïdes et sont donc absents du répertoire des lymphocytes matures.
La théorie de la sélection clonale est maintenant très généralement acceptée
comme l’hypothèse correcte pour expliquer comment l’immunité adaptative se
déroule. Elle explique de nombreuses caractéristiques de la réponse immune :
1) la spécificité de réponse ; 2) le signal requis pour l’activation de la
réponse (c’est à dire l’antigène) ; 3) le délai pour la mise en place de
l’immunité adaptative (qui correspond au temps requis pour activer les
cellules et propager des clones à partir des cellules activées) et 4) la
discrimination entre le Soi et le Non Soi.
|
 Figure 6
Figure 6
Les lymphocytes T circulants rencontrent l’antigène dans
les tissus lymphoïdes périphériques.
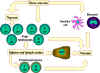 Figure 7
Figure 7
Les lymphocytes naïfs provenant de des organes lymphoïdes
primaires comme par exemple la moelle osseuse migrent vers les organes
lymphoïdes secondaires comme par exemple la rate ou les ganglions
lymphatiques. Les cellules présentatrices d’antigènes (CPA ou APC) qui
incluent notamment les cellules dendritiques et aussi les phagocytes
mononucléés (monocytes) proviennent également de cellules souches de la
moelle osseuse. Ces APC vont dans les tissus, capturent les antigènes et
les transportent dans les organes lymphoïdes secondaires pour les
présenter aux lymphocytes T et B. Les lymphocytes ainsi activés migrent
depuis l’organe lymphoïde vers les tissus infectés et enflammés où ils
s’accumulent.
|
RECIRCULATION DES
LYMPHOCYTES
Comme il y a très peu de lymphocytes T ou B possédant
un récepteur spécifique pour un déterminant antigénique donné (de l’ordre de
1/10.000 à 1/100.000), les chances pour qu’un rencontre se produise entre un
antigène et le lymphocyte approprié sont minces. Toutefois, ces chances sont
grandement augmentées par la recirculation des lymphocytes au travers des
organes lymphoïdes secondaires. Les lymphocytes du sang pénètrent dans les
ganglions lymphatiques et explorent ces derniers (Figure 6). S’ils n’y
rencontrent pas l’antigène, alors ces lymphocytes quittent le ganglion par
la circulation lymphatique et retournent dans le sang via le canal
thoracique. On estime que 1 à 2% des lymphocytes recirculent chaque heure.
Si, au contraire, les lymphocytes rencontrent l’antigène transporté dans le
ganglion lymphatique via la lymphe, alors le lymphocyte s’active, se divise
et se différencie en plasmocyte ou en cellules Thelper ou en CTL. Après
plusieurs jours, les cellules effectrices peuvent quitter le ganglion par
les vaisseaux lymphatiques efférents, retourner dans le sang et rejoindre
les tissus infectés
Les lymphocytes naïfs (aussi appelés vierges) pénètrent dans le ganglion à
partir du sang via les vénules endothéliales hautes ou HEV (High Endothelial
Venules). Des récepteurs d’adressage présents sur les lymphocytes dirigent
les cellules vers les HEVs. Dans les ganglions, les lymphocytes possédant le
récepteur à l’antigène approprié rencontrent l’antigène (amené au ganglion
par les cellules dendritiques ou les macrophages). Après activation, les
lymphocytes expriment de nouveaux récepteurs qui permettent à la cellule de
quitter le ganglion et de ré-entrer dans le sang. Ces récepteurs
interagissent avec des molécules d’adhérence présentes sur les cellules
endothéliales à proximité du site infectieux et les chimiokines produites au
site infectieux attirent les cellules activées (Figure 7).
|
| |
IMMUNITE:
CONTRASTES ENTRE RÉPONSES NON-SPÉCIFIQUES ET SPÉCIFIQUES
Réponses non-spécifiques
(naturelles, innées)
-
Le système est en place avant l’entrée du pathogène
-
Ne discriminent pas ou peu entre les différents
pathogènes
-
Peuvent être potentialisées après exposition à
l’antigène grâce à l’effet des cytokines
Spécifiques (acquises, adaptative)
Les caractéristiques principales de la réponse immune spécifique sont la
mémoire et la spécificité.
-
Le système immunitaire spécifique « se souvient » de
chaque rencontre avec un microbe ou antigène étranger, de telle
sorte que chaque nouvelle rencontre stimulera de façon plus forte
les mécanismes effecteurs de l’immunité.
-
La réponse immune spécifique amplifie les mécanismes
protecteurs de la réponse immune non-spécifique, dirige et focalise
ces mécanismes vers le site d’entrée de l’antigène et permet ainsi à
ces mécanismes effecteurs d’être plus à même d’éliminer les agents
étrangers.
|
| Figure
8 |
CELLULES DU
SYSTEME IMMUNITAIRE
L’ensemble des cellules du système immunitaire provient
de la moelle osseuse.
|
 Lymphocyte T humain (SEM x12,080) ©
Dennis Kunkel
Microscopy, Inc. Used with permission
Lymphocyte T humain (SEM x12,080) ©
Dennis Kunkel
Microscopy, Inc. Used with permission |
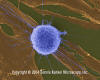 Lymphocyte
T humain attaquant un fibroblaste tumoral/cancéreux (grossissement
x4,000)
©
Dennis Kunkel Microscopy,
Inc.
Used with permission
Lymphocyte
T humain attaquant un fibroblaste tumoral/cancéreux (grossissement
x4,000)
©
Dennis Kunkel Microscopy,
Inc.
Used with permission
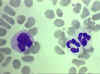 Frottis sanguin dans lequel on voit un monocyte (gauche) et deux
neutrophiles © Bristol Biomedical Image Archive Used with permission
Frottis sanguin dans lequel on voit un monocyte (gauche) et deux
neutrophiles © Bristol Biomedical Image Archive Used with permission
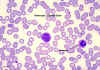 Monocyte, coloré au giemsa dans un frottis de sang périphérique © Dr
Peter Darben, Queensland University of Technology clinical parasitology
collection. Used with permission
Monocyte, coloré au giemsa dans un frottis de sang périphérique © Dr
Peter Darben, Queensland University of Technology clinical parasitology
collection. Used with permission
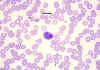 Eosinophile, coloré au giemsa dans un frottis de sang périphérique © Dr
Peter Darben, Queensland University of Technology clinical parasitology
collection. Used with permission
Eosinophile, coloré au giemsa dans un frottis de sang périphérique © Dr
Peter Darben, Queensland University of Technology clinical parasitology
collection. Used with permission
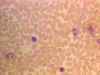 Frottis sanguin montrant de petits lymphocytes © Bristol Biomedical
Image Archive Used with permission
Frottis sanguin montrant de petits lymphocytes © Bristol Biomedical
Image Archive Used with permission
 Grand lymphocyte, coloré au giemsa dans un frottis de sang
périphérique © Dr Peter Darben, Queensland University of Technology
clinical parasitology collection. Used with permission
Grand lymphocyte, coloré au giemsa dans un frottis de sang
périphérique © Dr Peter Darben, Queensland University of Technology
clinical parasitology collection. Used with permission
 Neutrophile vu en microscopie électronique. Notez les deux lobes
nucléaires et les granules azurophiles © Dr Louise Odor, University of
South Carolina School of Medicine
Neutrophile vu en microscopie électronique. Notez les deux lobes
nucléaires et les granules azurophiles © Dr Louise Odor, University of
South Carolina School of Medicine
 Neutrophile, coloré au giemsa dans un frottis de sang périphérique © Dr
Peter Darben, Queensland University of Technology clinical parasitology
collection. Used with permission
Neutrophile, coloré au giemsa dans un frottis de sang périphérique © Dr
Peter Darben, Queensland University of Technology clinical parasitology
collection. Used with permission
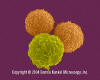 Lymphocytes T (cellules pré-T ) et granulocyte (neutrophile). ©
Dennis Kunkel
Microscopy, Inc. Used with permission
Lymphocytes T (cellules pré-T ) et granulocyte (neutrophile). ©
Dennis Kunkel
Microscopy, Inc. Used with permission |
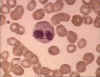 Eosinophile dans un frottis sanguin © Bristol
Biomedical Image Archive Used with permission
Eosinophile dans un frottis sanguin © Bristol
Biomedical Image Archive Used with permission |

Petit lymphocyte, coloré au giemsa dans un frottis
sanguin © Dr Peter Darben, Queensland University of Technology clinical
parasitology collection. Used with permission |
| |
Il y a deux principaux lignages qui proviennent de la
cellule souche hématopoïtéiqueThere are two main lineages that derive from
the hemopoietic stem cell:
-
Le lignage lymphoïde
Lymphocytes T (cellules T)
Lymphocytes B (cellules B)
Les Natural killer cells (cellules NK)
-
Le lignage myéloïde
Monocytes, macrophages, mastocytes
Cellules de Langerhans, cellules dendritiques
Mégacaryocytes
Granulocytes (éosinophiles, neutrophiles, basophiles)
|
|
|
Sélection clonale
Les quatre principes de base de la théorie de la sélection clonale |
|
Chaque lymphocyte porte un seul type de récepteur
ayant une spécificité unique |
|
L’interaction entre une molécule étrangère et un
récepteur de lymphocyte capable de se lier à cette molécule avec une
haute affinité conduit à l’activation du lymphocyte |
|
La cellule effectrice différenciée résultant de
l’activation du lymphocyte portera des récepteurs d’une spécificité
identique à celle de la cellules parentale à partir de laquelle la
cellule activée a dérivé |
|
Les lymphocytes portant des récepteurs spécifiques
pour des molécules du SOI sont éliminés à un stade précoce de
développement des lymphocytes et sont donc absents du répertoire de
lymphocytes matures |
 Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
This page last changed on
Tuesday, July 30, 2013
Page maintained by
Richard Hunt
Please report any problems to
richard.hunt@uscmed.sc.edu
|


 Les anticorps peuvent fixer et neutraliser une toxine bactérienne,
l'empêchant d'interagir avec les cellules hôtes et de provoquer la
pathologie. La toxine non liée peut réagir avec les récepteurs de la
cellule hôte, tandis que le complexe toxine: anticorps ne le peut pas.
Les anticorps peuvent également neutraliser les particules virales ainsi
que des cellules bactériennes en se liant à elles et en les inactivant.
Le complexe antigène: anticorps est finalement récupéré et dégradé par
les macrophages. Le recouvrement d’antigène par les anticorps rend
l’antigène reconnaissable comme étrangère par les phagocytes
(macrophages et leucocytes polynucléaires), qui peuvent alors l’ingérer
et le détruire : c’est l’opsonisation.
Les anticorps peuvent fixer et neutraliser une toxine bactérienne,
l'empêchant d'interagir avec les cellules hôtes et de provoquer la
pathologie. La toxine non liée peut réagir avec les récepteurs de la
cellule hôte, tandis que le complexe toxine: anticorps ne le peut pas.
Les anticorps peuvent également neutraliser les particules virales ainsi
que des cellules bactériennes en se liant à elles et en les inactivant.
Le complexe antigène: anticorps est finalement récupéré et dégradé par
les macrophages. Le recouvrement d’antigène par les anticorps rend
l’antigène reconnaissable comme étrangère par les phagocytes
(macrophages et leucocytes polynucléaires), qui peuvent alors l’ingérer
et le détruire : c’est l’opsonisation. Activation du système du complément par les anticorps recouvrant une
cellule bactérienne. Les anticorps liés forment un récepteur pour la
première protéine du système du complément, ce qui finit par former un
complexe protéique à la surface de la bactérie qui, dans certains cas,
peut tuer la bactérie directement, mais plus généralement favorise son
absorption et la destruction par les phagocytes. Ainsi, les anticorps
peuvent cibler les agents pathogènes et leurs produits pour permettre
leur élimination par les phagocytes
Activation du système du complément par les anticorps recouvrant une
cellule bactérienne. Les anticorps liés forment un récepteur pour la
première protéine du système du complément, ce qui finit par former un
complexe protéique à la surface de la bactérie qui, dans certains cas,
peut tuer la bactérie directement, mais plus généralement favorise son
absorption et la destruction par les phagocytes. Ainsi, les anticorps
peuvent cibler les agents pathogènes et leurs produits pour permettre
leur élimination par les phagocytes Figure 2
Figure 2 Figure 3
Figure 3 Figure 4
Figure 4 Figure 5
Figure 5 Figure 6
Figure 6 Lymphocyte T humain (SEM x12,080) ©
Dennis Kunkel
Microscopy, Inc. Used with permission
Lymphocyte T humain (SEM x12,080) ©
Dennis Kunkel
Microscopy, Inc. Used with permission Lymphocyte
T humain attaquant un fibroblaste tumoral/cancéreux (grossissement
x4,000)
©
Dennis Kunkel Microscopy,
Inc.
Used with permission
Lymphocyte
T humain attaquant un fibroblaste tumoral/cancéreux (grossissement
x4,000)
©
Dennis Kunkel Microscopy,
Inc.
Used with permission Monocyte, coloré au giemsa dans un frottis de sang périphérique © Dr
Peter Darben, Queensland University of Technology clinical parasitology
collection. Used with permission
Monocyte, coloré au giemsa dans un frottis de sang périphérique © Dr
Peter Darben, Queensland University of Technology clinical parasitology
collection. Used with permission Frottis sanguin montrant de petits lymphocytes © Bristol Biomedical
Image Archive Used with permission
Frottis sanguin montrant de petits lymphocytes © Bristol Biomedical
Image Archive Used with permission Neutrophile vu en microscopie électronique. Notez les deux lobes
nucléaires et les granules azurophiles © Dr Louise Odor, University of
South Carolina School of Medicine
Neutrophile vu en microscopie électronique. Notez les deux lobes
nucléaires et les granules azurophiles © Dr Louise Odor, University of
South Carolina School of Medicine
 Eosinophile dans un frottis sanguin © Bristol
Biomedical Image Archive Used with permission
Eosinophile dans un frottis sanguin © Bristol
Biomedical Image Archive Used with permission 








