|
|
 |
||||||||||||||||||||||||||||||||||
|
Dr Richard Hunt |
BACTERIOLOGÍA | INMUNOLOGÍA | MICOLOGÍA | PARASITOLOGÍA | VIROLOGÍA | ||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
VIDEOCONFERENCIA |
|||||||||||||||||||||||||||||||||||
|
OBJETIVOS |
El virus de la Rabia pertenece a la familia de los: Rabdoviridae. (Griego:
Rhabdos: bacilo). Estos pueden infectar una variedad de animales y plantas A nivel mundial, se estima que aproximadamente 55 000 personas mueren por rabia cada año
|
||||||||||||||||||||||||||||||||||
 Figura 1A – Estructura general de Rabdovirus
Figura 1A – Estructura general de Rabdovirus
|
Estructura de los rabdovirus (figura 1) Los Rabdovirus son virus de ARN de cadena negativa; esto es que tienen una única hebra de ARN que está en sentido contrario al del ARNm necesario para codificar proteínas virales. Esto significa que el ARN no puede codificar directamente la síntesis proteica y ha de ser copiado a una cadena de ARNm de sentido positivo. Como resultado, el virus debe de portar su propia ARN polimerasa dependiente de ARN. Como lo sugiere su nombre estos virus tienen forma bacilar. Tienen un lado que termina en una forma redondeada y por ello se dice que tiene forma de bala. Cada partícula vírica es de casi 100nm de diámetro y 400 nm de largo, pero esto puede variar. Tienen una envoltura derivada de la membrana plasmática de la célula huésped. El virus sólo tiene cinco proteínas.
|
||||||||||||||||||||||||||||||||||
|
|
Replicación (figura 2)
Fijación
Penetración
Transcripción
Replicación
Ensamblaje
|
||||||||||||||||||||||||||||||||||
|
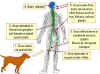
Patogénesis Virus de la Estomatitis Vesicular (VEV) El VEV infecta al ganado vacuno en el Caribe y ocasionalmente en los EU. También se encuentra en caballos y cerdos pero muy raramente se ve en humanos. Rabia Transmisión Los animales rabiosos se vuelven agresivos y albergan el virus en la saliva y con frecuencia la transmisión es a través de mordeduras. En raras ocasiones, la rabia ha sido transmitida mediante transplantes de córnea y otros transplantes de tejidos, o mediante contacto con saliva infectada con membranas mucosas o con una herida abierta. EL CDC establece: “La inhalación del virus de la rabia en aerosoles es también una ruta de exposición potencial, pero si no son empleados de laboratorios, es improbable que la mayoría de las personas encuentren aerosol del virus de la rabia”. Se ha sugerido que las personas en cuevas infectadas de murciélagos pueden estar expuestas a partículas del virus en aerosol. La mayoría de los murciélagos no están infectados. Patología El virus se fija a células nerviosas o musculares en el sitio de inoculación mediante receptores nicotínicos de acetilcolina. Aquí el virus puede permanecer por un periodo de tiempo prolongado (casi varios meses). El virus puede replicarse en las células musculares en el sitio de la mordedura sin ningún síntoma obvio. Esta es la fase de incubación. El virus luego se mueve a lo largo de los axones nerviosos al sistema nervioso central usando el transporte retrógrado. El virus llega a los ganglios de la raíz dorsal y a la medula espinal. Desde aquí, se da la diseminación al cerebro. Una variedad de células en el cerebro pueden ser infectadas incluyendo el cerebelo, las células de Purkinje y también células del hipocampo y los núcleos pontinos. Esta es la fase de pródromo. La infección cerebral conlleva encefalitis y degeneración neuronal aunque en cualquier otro sitio el virus parece no causar efectos citopáticos. La implicación del cerebro conlleva al coma y a la muerte. Este es la fase neurológica y durante este periodo, el virus puede diseminarse del sistema nervioso central, mediante neuronas, a la piel, ojos y otros tejidos (glándulas suprarrenales, riñones, células pancreáticas acinares) y las glándulas salivares (figura 4). Hay varios factores que determinan el tiempo de instauración de la rabia sintomática pero los más importantes son el número de partículas víricas en la infección y qué tan cerca está la mordedura del cerebro. El estatus inmunológico del paciente también es importante. Debe de notarse que la respuesta inmunológica al virus adquirido de forma natural es lenta y una buena respuesta neutralizante no se ve hasta que el virus ha alcanzado el cerebro y entonces ya es muy tarde para que el paciente sobreviva. La inmunidad mediada por células juega un papel mínimo en la infección de la rabia. La rabia es casi siempre fatal y sólo se han documentado tres sobrevivientes de rabia sintomática. No obstante, una buena respuesta inmune que elimine la infección, puede lograrse usando una vacuna aún después de la infección gracias al largo periodo de incubación. Epidemiología
La rabia usualmente se transmite por
mordeduras de animales. A nivel mundial la mayoría de los casos surgen de
mordidas de perros. La rabia canina es prevalerte en América Latina, Asia y
África.
En muchos países occidentales en donde la rabia es endémica, la vacunación de
animales ha reducido la tasa de enfermedad en humanos y en los Estados Unidos se
da aproximadamente un caso de rabia por año. En países como el Reino Unido, en
donde no se ve la rabia en la población animal silvestre, no se utiliza la
vacunación. En otros países, la rabia es un problema mayor. Por ejemplo, en la
India se reportan 25,000 casos de rabia en humanos por año, principalmente por
mordidas de perros. En América del Sur, la transmisión de la rabia por los
murciélagos vampiros es un gran problema para la industria del ganado (tabla 2). |
|||||||||||||||||||||||||||||||||||
|
FUENTES EN LA RED
Comportamiento del
mapache con rabia Requiere RealAudio |
|||||||||||||||||||||||||||||||||||
|
Figura 4 – Patogénesis de la Rabia
|
|||||||||||||||||||||||||||||||||||
|
FUENTES EN LA RED
Murciélagos y Rabia (CDC) |
Síntomas La vacunación, aún después de la exposición, es extremadamente efectiva en la prevención de la enfermedad. Sin tal tratamiento, la rabia sería, casi invariablemente, fatal (no obstante, refiérase al reporte de caso a la izquierda). Durante el periodo de incubación/pródromo, los síntomas incluyen: dolor o escozor en el sitio de la herida, cefaleas y problemas gastrointestinales. Luego de este periodo (de usualmente dos semanas), la infección del SNC es aparente. En casi la mitad de los pacientes, se observa hidrofobia. Este miedo al agua es el resultado del dolor asociado al beber. También hay convulsiones y alucinaciones. En algunos pacientes la parálisis es el único síntoma y esto puede llevar a fallo respiratorio. Siguiendo a la fase neurológica, el paciente se vuelve comatoso. Debido a los problemas neurológicos incluyendo la parálisis respiratoria, sobreviene la muerte.
|
||||||||||||||||||||||||||||||||||
|
Investigación de las Infecciones de Rabia en Donantes de Órganos y Receptores de Transplantes
|
|||||||||||||||||||||||||||||||||||
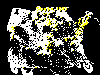
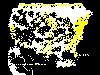 Casos reportados de rabia en los Estados Unidos, 1999
Casos reportados de rabia en los Estados Unidos, 1999 |
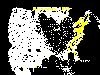 Casos reportados de rabia en los mapaches en los Estados Unidos, 1999
Casos reportados de rabia en los mapaches en los Estados Unidos, 1999
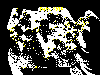 Casos reportados de rabia en murciélagos en los Estados Unidos, 1999
Casos reportados de rabia en murciélagos en los Estados Unidos, 1999
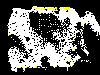 Casos reportados de rabia en otros animales silvestres en los Estados
Unidos, 1999
Casos reportados de rabia en otros animales silvestres en los Estados
Unidos, 1999
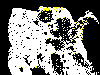 Casos reportados de rabia en gatos en los Estados Unidos, 1999
Casos reportados de rabia en gatos en los Estados Unidos, 1999
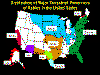
 La Expansión Epizoótica de Rabia en Mapaches, Estados Unidos Oriental,
1977-1996
La Expansión Epizoótica de Rabia en Mapaches, Estados Unidos Oriental,
1977-1996
Figura 5 (Todas las imagines del CDC)
|
||||||||||||||||||||||||||||||||||
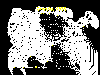
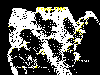 Casos reportados de rabia en zorros en los Estados Unidos, 1999
Casos reportados de rabia en zorros en los Estados Unidos, 1999 |
|||||||||||||||||||||||||||||||||||
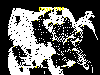 Casos reportados de rabia en perros en los Estados Unidos, 1999
Casos reportados de rabia en perros en los Estados Unidos, 1999 |
|||||||||||||||||||||||||||||||||||
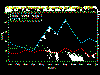 Rabia en animales domésticos de acuerdo al mes en los Estados Unidos,
1999
Rabia en animales domésticos de acuerdo al mes en los Estados Unidos,
1999 |
|||||||||||||||||||||||||||||||||||
 Figura 6 resultado de examen de PCR para la presencia del virus
de la rabia. Las flechas indican posiciones de bandas positivas
CDC
Figura 6 resultado de examen de PCR para la presencia del virus
de la rabia. Las flechas indican posiciones de bandas positivas
CDC |
Diagnóstico Hay síntomas manifiestos que claramente definen la rabia sintomática en personas que sufrieron de mordeduras de animales pero, ya para esa etapa, la intervención terapéutica es inútil. Luego de una mordida, hay análisis de laboratorio que pueden determinar si un animal tenía rabia. La presencia del virus de la rabia en un animal o en una persona infectada se determina mediante múltiples exámenes:
|
||||||||||||||||||||||||||||||||||
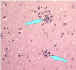
 Figura 7 Neurona sin cuerpos de Negri
CDC
Figura 7 Neurona sin cuerpos de Negri
CDC |
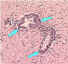
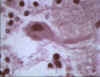
 Cuero de Negri en neurona infectada
CDC
Cuero de Negri en neurona infectada
CDC
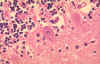 Histopatología de la rabia, cerebro. Cuerpos de Negri característicos
están presentes con una célula de Purkinje del cerebelo en este paciente
que falleció por rabia.
CDC/Dr. Makonnen Fekadu maf1@cdc.gov
Histopatología de la rabia, cerebro. Cuerpos de Negri característicos
están presentes con una célula de Purkinje del cerebelo en este paciente
que falleció por rabia.
CDC/Dr. Makonnen Fekadu maf1@cdc.gov
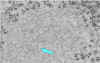 Ribonucleoproteína. Note las abundantes hebras enrolladas de
ribonucleoproteínas (casi todo en la imagen es ribonucleoproteína).
CDC
Ribonucleoproteína. Note las abundantes hebras enrolladas de
ribonucleoproteínas (casi todo en la imagen es ribonucleoproteína).
CDC
|
||||||||||||||||||||||||||||||||||
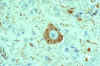 Célula nerviosa infectada con el virus de la rabia con inclusiones
intracitoplasmáticas (cuerpos de Negri). La tinción roja indica áreas
del antígeno viral de la rabia mediante el uso de inmunohistoquímica o
del complejo avidin-biotina
CDC
Célula nerviosa infectada con el virus de la rabia con inclusiones
intracitoplasmáticas (cuerpos de Negri). La tinción roja indica áreas
del antígeno viral de la rabia mediante el uso de inmunohistoquímica o
del complejo avidin-biotina
CDC |
|||||||||||||||||||||||||||||||||||

 Figura 8
Test directo de fluorescencia de anticuerpo (dFA)
Figura 8
Test directo de fluorescencia de anticuerpo (dFA)El test dFA se basa en el principio de que un animal infectado por el virus de la rabia tendrá proteína del virus de la rabia (antígeno) presente en sus tejidos. Puesto que la rabia está presente en el tejido nervioso (y no es sangre como muchos otros virus), el tejido ideal para evaluar la presencia del antígeno de la rabia es el cerebro. La parte más importante del test de dFA es el anticuerpo anti-rabia con marcadores fluoresencentes. Cuando se añada un anticuerpo marcado a un tejido cerebral en donde se sospecha rabia, se unirá al antígeno de la rabia si este está presente. Los anticuerpos no unidos pueden ser lavados y las áreas en donde se unió el antígeno aparecerán de color verde fluorescente brillante cuando se ven con microscopio de fluorescencia. Si el virus de la rabia está ausente no habrá tinción. El anticuerpo de la rabia en el examen dFA está principalmente dirigido contra la nucleoproteína del virus. El virus de la rabia se replica en el citoplasma de las células, y las células infectadas pueden contener inclusiones grandes redondas u ovaladas con colecciones de nucleoproteína (N) o agregados más pequeños de antígeno que tienen una apariencia de partículas fluorescentes espolvoreadas si se usa un procedimiento de tinción dFA CDC
|
PREVENCIÓN Y TRATAMIENTO DE UNA PERSONA QUE QUIZÁS HAYA SIDO EXPUESTA La herida debe de ser lavada inmediata y exhaustivamente con jabón antiséptico y agua, luego tratada con alcohol etílico al 40-70% o un antiséptico como cloruro de benzilamonio. Las autoridades estatales de Salud deben de ser prontamente notificadas. El riesgo de exposición a rabia y la determinación de administración de tratamiento profiláctico se hace en conjunto con una consulta con el Departamento de Salud Estatal. Si el animal es asequible, el cerebro debe de examinarse en busca del antígeno de la rabia con anticuerpo fluorescente. (En algunos casos, si la mordida fue de un perro o gato domesticado, el animal puede mantenerse para observación cercana). Profilaxis Post-exposición
Hasta ahora nunca ha habido un caso de alguna persona que, recibiendo la dosis profiláctica apropiada post-exposición, haya desarrollado rabia. (Cerca de 40,000 personas por año son tratadas en los EU). Profilaxis post exposición Las personas en riesgo de infección por rabia pueden ser vacunadas como medida preventiva. Entre tales individuos se incluyen
Las personas en alto riesgo de exposición a animales rabiosos deben de hacerse análisis serológicos regulares y aplicarse refuerzos de la vacuna cuando sea necesario. Aún si una persona vacunada es expuesta a la rabia, necesita de profilaxis post-exposición, pero la cantidad de vacunas es menor y no se utiliza HRIG. Tratamiento Si los síntomas son restringidos al área de la mordida, puede intentarse una terapia antiviral agresiva (vacuna, HRIG, ribavirina, interferón, anticuerpos monoclonales, etc.). No hay todavía un tratamiento antiviral específico una vez se desarrollan los síntomas del SNC. Se administra cuidados intensivos de mantenimiento. Cinco de los seis sobrevivientes conocidos de rabia recibieron profilaxis antes de desarrollar síntomas clínicos. Ha habido solo un caso documentado de un sobreviviente no vacunado de la rabia. (Willoughby RE Jr, et al. Survival after treatment of rabies with induction of coma. N Engl J Med. 2005 352:2508-14. Jackson AC. Recovery from rabies. N Engl J Med. 2005 16;352:2549-50).
Derechos de autor 2008 The Board of Trustees of the University of South Carolina
|
||||||||||||||||||||||||||||||||||
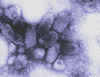
 CDC
CDC