|
|
|
|
 |
 |
|
|
BACTERIOLOGÍA |
INMUNOLOGÍA
|
MICOLOGÍA |
PARASITOLOGÍA |
VIROLOGÍA |
|
EN INGLÉS
|
INMUNOLOGÍA-CAPÍTULO UNO
INMUNIDAD INNATA (NO-ESPECÍFICA)
Dr Gene Mayer
Traducido por : Dr Fernando Enríquez-Rincón
Centro de Investigación y de Estudios Avanzados del IPN
|
|
VIDEOCONFERENCIA
EN INGLÉS |
|
CENTRO
DE INVESTIGACION Y DE ESTUDIOS AVANZADOS DEL IPN |
|
BUSCAR |
|
E-MAIL
DR FERNANDO ENRIQUEZ-RINCON |
|
Let us know what you think
FEEDBACK |
|
|
|
OBJETIVOS
Reconocer el significadoi del sistema immune en el combate a la
infección y a la enfermedad
Distinguir entre el sistema immune no-específico (innato) y el sistema
immune específico (adaptativo)
Entender
los mecanismos de combate a la infección/enfermedad (eliminación de
patógenos)
Conocer
los componentes humorales y celulares de la inmunidad no-específica
Comprender los mecanismos de acción de los components humorales y
celulares de la inmunidad no-específica
Figura 1
El sistema inmune
 Figura 2
Figura 2
Células del sistema inmune
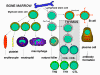 Figura 3
Figura 3
Desarrollo de las células del sistema inmune
|
GENERALIDADES DEL SISTEMA INMUNE
Aunque los seres humanos estamos constantemente
expuestos a agentes infecciosos, en la mayoría de los casos, somos
capaces de resistir a estas infecciones y es nuestro sistema inmune el
que se encarga de esta función. El sistema inmune está compuesto de dos
principales subdivisiones, el sistema innato o no-específico y el
sistema adaptativo o específico (Figura 1). El sistema inmune innato es
la primera línea de defensa contra organismos invasores mientras que el
sistema inmune adaptativo actúa como la segunda línea de defensa y pero
además ofrece protección contra re-exposiciones al mismo patógeno. Cada
una de las principales subdivisiones del sistema inmune cuenta con
componentes celulares y humorales los cuales llevan a cabo su función
protectora (Figura 1). Además, el sistema inmune innato tiene también
características anatómicas que actúan como barreras a la infección.
Aunque estas dos ramas del sistema inmune tienen distintas funciones,
existe una importante interacción entre los dos sistemas (i.e., los
componentes del sistema inmune innato influyen en el sistema inmune
adaptativo y viceversa).
Si bien la función de
ambos sistemas innato y adaptativo es la de protegernos contra
organismos invasores, estos difieren en ciertos aspectos. El sistema
inmune adaptativo requiere tiempo para reaccionar a un organismo
invasor, mientras que el sistema inmune innato incluye defensas que, en
su mayor parte, se encuentran presentes constitutivamente y listas para
ser movilizadas durante la infección. Segundo, el sistema inmune
adaptativo es específico para el antígeno y reacciona solo con el
organismo que indujo la respuesta. En contraste, el sistema innato no es
específico del antígeno y reacciona igualmente bien contra una variedad
de organismos. Finalmente, el sistema inmune adaptativo posee memoria
inmunológica. Es decir, “recuerda” que previamente se ha encontrado con
un agente invasor y reacciona más rápidamente a la exposición
subsecuente con el mismo organismo. En contraste, el sistema inmune
innato no tiene memoria inmunológica.
Todas las células del
sistema inmune tiene su origen en la medula ósea y estas incluyen a las
células mieloides (neutrófilos, basófilos, eosinófilos, macrófagos y
células dendríticas) y a las células linfoides (linfocitos B, linfocitos
T y células asesinas naturales) (Figura 2), las cuales se diferencian a
lo largo de distintas vías (Figura 3). La célula progenitora mieloide
(célula madre) en la médula ósea da lugar a los eritrocitos, plaquetas,
neutrófilos, monocitos/macrófagos y células dendríticas mientras que la
célula progenitora linfoide da lugar a las células asesinas naturales (NK),
células T y células B. Para el desarrollo de las células T se requiere
que células precursoras de T emigren al timo en donde se diferencian en
dos distintos tipos de células T, las células T cooperadoras CD4+ y las
células pre-citotóxicas CD8+. Dos tipos de células T cooperadoras se
producen en el timo, las células TH1, que ayudan a diferenciarse a las
células pre-citotóxicas CD8+ en células T citotóxicas, y las células
TH2, que ayudan a las células B a diferenciarse en células plasmáticas,
que secretan los anticuerpos.
La principal función del sistema inmune el la discriminación de lo
propio/no propio. Esta habilidad para distinguir lo propio de lo no
propio es necesaria para proteger al organismo de invasores patógenos y
para eliminar células propias modificadas o alteradas (vg. células
malignas). Ya que los patógenos se pueden replicar intracelularmente
(virus y algunas bacterias y parásitos) o extracelularmente (la mayoría
de las bacterias, hongos y parásitos), los diferentes componentes del
sistema inmune han tenido que evolucionar para protegernos de estos
diferentes tipos de patógenos. Es importante recordar que la infección
con un organismo no necesariamente significa enfermedad, ya que en la
mayoría de los casos el sistema inmune es capaz de eliminar la infección
antes de que ocurra la enfermedad. La enfermedad se presenta solo
cuando el tamaño de la infección es alto, cuando la virulencia del
organismo invasor es grande o cuando la inmunidad está comprometida.
Aunque el sistema inmune, en su mayor parte, tiene efectos benéficos,
puede haber efectos nocivos también. Durante la inflamación, producida
en respuesta a un organismo invasor, puede haber irritación local y
daños colaterales a los tejidos sanos como resultado de los productos
tóxicos producidos por la respuesta inmune. Además, en algunos casos la
misma respuesta puede dirigirse hacia los tejidos propios resultando en
una enfermedad autoinmune.
|
Tabla 1 |
|
Immunidad Innata |
Immunidad Adaptativa |
|
Respuesta antígeno-independiente |
Respuesta antígeno-dependiente |
|
Hay respuesta máxima inmediata |
Hay un periodo de latencia entre la exposición y la respuesta
máxima |
|
No antígeno-específica |
Antígeno-específica |
|
La exposición al antígeno no induce memoria inmunológica |
La exposición al antígeno induce memoria inmunológica |
|
| |
INMUNIDAD NO-ESPECÍFICA
Los elementos del sistema inmune
no-específico (innato) (Tabla 2) incluyen a las barreras anatómicas, a moléculas
secretorias y a componentes celulares. Entre las barreras mecánicas anatómicas
se encuentran la piel y las capas epiteliales internas, el movimiento de los
intestinos y las oscilaciones de los
cilios bronco-pulmonares. En asociación con estas superficies protectoras
están los agentes químicos y biológicos.
Barreras anatómicas a la infección
Factores mecánicos
Las superficies epiteliales forman una barrera física que es bastante
impermeable a la mayoría de los agentes infecciosos. Es decir, la piel actúa
como nuestra primera línea de defensa contra organismos invasores. La
descamación del epitelio de la piel también ayuda a eliminar bacterias y otros
agentes infecciosos que se han adherido a las superficies epiteliales. El
movimiento de los cilios o la peristalsis ayuda a conservar las vías
respiratorias y tracto gastrointestinal libre de microorganismos. El lavado
producido por el flujo de las lágrimas y la saliva ayuda a prevenir las
infecciones oculares y bucales respectivamente. El efecto pegajoso del moco que
cubre al tracto tanto respiratorio como gastrointestinal ayuda a proteger a los
pulmones y al sistema digestivo de las infecciones.
Factores químicos
Los ácidos grasos del sudor inhiben el crecimiento de bacterias. La
lisozima y la
fosfolipasa presentes en lágrimas, saliva y secreciones nasales pueden
romper la pared cellular de bacterias y desestabilizar sus membranas. El pH
ácido del sudor y de las secreciones gástricas previene el crecimiento de
bacterias. Las
defensinas (proteínas de bajo peso molecular) presentes en pulmón y tracto
gastrointestinal tienen actividad antimicrobiana. Los agentes surfactantes en
pulmón actúan como opsoninas (substancias que promueven la ingestión de
partículas por las células fagocíticas).
Factores biológicos
La flora normal de la piel y tracto gastrointestinal puede evitar la
colonización de bacterias patógenas al secretar substancias tóxicas o al
competir con los patógenos por los nutrientes o por la adhesión a las
superficies celulares.
Barreras humorales a la infección
Las barreras anatómicas son muy efectivas para evitar la colonización de los
tejidos por microorganismos. Sin embargo, cuando se presenta una lesión en los
tejidos, las barreras anatómicas se abren y la infección puede ocurrir. Una vez
que los agentes infecciosos han penetrado a los tejidos, otro mecanismo de
defensa innata entra en juego, la inflamación aguda. Los factores humorales
juegan un papel muy importante en la inflamación, la cual se caracteriza por
edema y el reclutamiento de
células fagocíticas. Estos factores humorales se encuentran en el suero o se
forman en el sitio de la infección.
Sistema del
complemento
Este sistema es el principal mecanismo de defensa
no-específico humoral (ver
capítulo del complemento). Una vez activado el complemento puede
ocasionar un incremento de la permeabilidad vascular, reclutamiento de
células fagocíticas y a la
opsonización y lisis de las bacterias.
Sistema de Coagulación
Dependiendo de la severidad del daño al tejido, el sistema de
coagulación puede ser activado o no. Algunos productos del sistema de
coagulación pueden contribuir a las defensas no-específicas debido a su
habilidad para incrementar la permeabilidad vascular y actuar como agentes
quimiotácticos para las células fagocíticas. Además, algunos de los
productos de la coagulación son por sí mismos antimicrobianos. Por ejemplo,
la beta –lisina, una proteína producida por las plaquetas durante la
coagulación puede lisar muchas bacterias Gram positivas al actuar como
detergente catiónico.
Lactoferrina
y transferrina
Al unir hierro, un nutriente esencial par alas bacterias,
estas proteínas limitan el crecimiento bacteriano.
Interferones
Los interferones son proteínas que pueden limitar la replicación de los
virus en las células
Lisozima
La lisozima degrada la pared celular de las bacterias.
Interleucina-1
La IL-1
induce fiebre y la producción de las proteínas de fase aguda, algunas de las
cuales son antimicrobianas porque pueden opsonizar las bacterias.
|
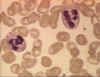 Figura 4A Dos neutrófilos en un frotis de sangre © Bristol Biomedical
Image Archive Used with permission
Figura 4A Dos neutrófilos en un frotis de sangre © Bristol Biomedical
Image Archive Used with permission
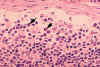 Figura 4B Histopatología de una linfadenopatía
debida a la infección por VIH-1. Seno subcapsular. El seno contiene
números incrementados de neutrófilos. CDC/Dr. Edwin P. Ewing, Jr. epe1@cdc.gov
Figura 4B Histopatología de una linfadenopatía
debida a la infección por VIH-1. Seno subcapsular. El seno contiene
números incrementados de neutrófilos. CDC/Dr. Edwin P. Ewing, Jr. epe1@cdc.gov
 Figura 4C
Figura 4C
Neutrófilo – micrografía electrónica. Note los dos lóbulos nucleares y
los gránulos azurófilos © Dr Louise Odor, University of South Carolina
School of Medicine
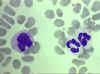 Figura
4D
Frotis sanguine mostrando un monocito (izq.) y dos neutrófilos © Bristol
Biomedical Image Archive Figura
4D
Frotis sanguine mostrando un monocito (izq.) y dos neutrófilos © Bristol
Biomedical Image Archive |
|
Tabla 2. Barreras fisicoquímicas a la infección
|
|
Sistema/órgano |
Componente Activo |
Mecanismo Efector |
|
Piel |
Células escamosas; Sudor |
Descamación; escurrimiento, ácidos orgánicos |
|
Tracto GI |
Células columnares |
Peristalsis, pH bajo, ácidos biliares, escurrimiento, tiocianato |
|
Pulmón |
Cilios traqueales |
Expulsión mucociliar, surfactantes |
|
Nasofaringe y ojos |
Moco, saliva, lágrimas |
Escurrimiento, lisozima |
|
Circulación, órganos linfoides |
Fagocíticos
Células NK y K
Células LAK
|
Fagocitosis y muerte intracellular
Citolisis directa y Ab-dependiente
Citolisis IL2-activada
|
|
Suero |
Lactoferrina y Transferrina |
Unión de hierro |
|
Interferones |
Proteínas antivirales |
|
TNF-alpha |
Antiviral,
activación de fagocitos |
|
Lisozima |
Hidrólisis de péptidoglicana |
|
Fibronectina |
Opsonización y fagocitosis |
|
Complemento |
Opsonización, mayor fagocitosis, inflamación |
|
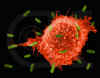 Figura 5
Figura 5
Macrófago atacando E.coli (SEM x8,800) © Dr Dennis Kunkel (used with
permission)
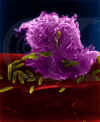
Figura 6
Macrófago alveolar (pulmón) atacando E. coli (SEM x10,000) ©
Dr Dennis Kunkel
(used with permission)
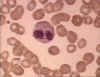
Figura 6A
Eosinófilo en
frotis sanguíneo © Bristol Biomedical Image Archive Used with permission
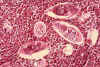 Figura 6B
Figura 6B
Histopatología de vejiga mostrando huevecillos de Schistosoma
haematobium rodeados por intenso infiltrado de eosinófilos CDC/Dr. Edwin
P. Ewing, Jr.
epe1@cdc.gov
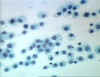 Figura 7
Figura 7
Histiocitos – Macrófagos residentes de vida larga encontrados en los
tejidos © Bristol Biomedical Image Archive Used with permission
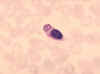
Figura 8
Monocito con parásitos de la malaria ingeridos.
CDC/Dr. Melvin
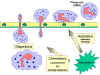 Figura
9
Respuesta quimiotáctica a estímulos inflamatorios Figura
9
Respuesta quimiotáctica a estímulos inflamatorios |
Barreras celulares a la infección
El reclutamiento de los
eosinófilos polimorfonucleares y de los macrófagos a los sitios de la
infección es parte de la respuesta inflamatoria. Estas células constituyen la
principal línea de defensa en el sistema inmune no específico.
Neutrófilos
Las células polimorfonucleares (PMNs, figura 4) son reclutados al sitio de la infección en
donde fagocitan a los organismos invasores y los destruyen intracelularmente.
Además, los PMNs contribuyen al daño colateral del tejido durante la
inflamación.
Macrófagos
Los macrófagos tisulares (figuras 5, 6, 7) y los nuevos
monocitos reclutados que se diferencian a macrófagos (figuras 4 y 8), también
participan en la ingestión y destrucción intracelular de los microorganismos.
Adicionalmente, los macrófagos son capaces de matar extracelularmente a
células infectadas células propias alteradas. Aún más, los macrófagos
contribuyen a la reparación de los tejidos y funcionan como células
presentadoras de antígeno, las cuales se requieren para la inducción de las
respuestas inmunes específicas.
Células asesinas naturales (NK) y células asesinas activadas por linfocinas (LAK)
Las células NK y LAK tiene capacidad de matar en forma no-específica tanto a
células infectadas por virus como a células tumorales. Estas células citotóxicas
no son parte de la respuesta inflamatoria pero son importantes en la inmunidad
innata a las infecciones virales y en la vigilancia a tumores.
Eosinófilos
Los eosinófilos (figuras
6a y b) tienen proteínas en sus gránulos que son efectivas para matar a ciertos
parásitos.
FAGOCITOSIS Y DESTRUCCIÓN INTRACELULAR
Células fagocíticas
Neutrófilos/células polimorfonucleares
Los PMNs son células fagocíticas móviles
que poseen núcleo lobulado. Pueden ser identificadas por su núcleo
característico o por un antígeno presente en la superficie celular denominado
CD66. Presentan dos tipos de gránulos cuyo contenido de ambos confieren las
propiedades antimicrobianas de estas células. Los gránulos primarios o
azurófilos abundantes en los PMNs jóvenes contienen proteínas catiónicas y
defensinas que pueden matar a las bacterias, enzimas proteolíticas como
elastasa y catepsina G para degradar a las proteínas, lisozima para romper las
paredes celulares de las bacterias y, característicamente, la mieloperoxidasa,
la cual está involucrada en la generación de compuestos bactericidas. El segundo
tipo de gránulos encontrados en los PMNs más maduros son los gránulos
secundarios o específicos. Estos contienen lisozima, componentes de la NADPH
oxidasa implicados en la generación de productos de oxígeno tóxicos, en forma
característica, lactoferrina, una proteína quelante del hierro y una proteína
que une B12.
Monocitos/Macrofagos
Los macrófagos son células que tienen un núcleo
característico en forma arriñonada. Se pueden identificar morfológicamente o por
la presencia del marcador de superficie CD14. A diferencia de los PMNs no
contienen gránulos pero poseen numerosos lisosomas con un contenido similar al
de los gránulos de los PMN.
Respuesta de los fagocitos a la
infección
Los PMNs y fagotitos circulantes responden a señales de “peligro” (SOS)
generadas en el sitio de la infección. Las señales SOS incluyen a los péptidos
que contienen
N-formil-metionina liberados por las bacterias, péptidos del sistema de la
coagulación, productos del complemento y citocinas liberadas por los macrófagos
que se han confrontado con las bacterias en los tejidos. Algunas de las señales
SOS estimulan a las células endoteliales de los vasos adyacentes al sitio de la
infección, a expresar moléculas de adhesión celular como la ICAM-1 y selectinas
que se unen a componentes de la superficie de los fagotitos y provocan que éstos
se adhieran al endotelio. Los vasodilatadores producidos en el sitio de la
infección ocasionan la relajación de los sitios de unión entre las células
endoteliales con lo que permiten que los fagotitos crucen la barrera epitelial
“escurriéndose” entre las células endoteliales en un proceso llamado
diapedesis (Figura 9). Una vez en los espacios titulares algunas de las
señales SOS atraen al los fagocitos al sitio de la infección por quimiotaxis
(movimiento hacia a un aumento del gradiente químico). Las señales SOS también
activan a los fagocitos resultando en una fagocitosis aumentada y en la muerte
intracelular de los organismos invasores.
|
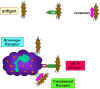 Figura 10
Adherencia de bacterias vía receptores
Figura 10
Adherencia de bacterias vía receptores |
Iniciación de la fagocitosis
(Figura 10)
Las células fagocíticas tienen una variedad de receptores en sus membranas
celulares a través de los cuales se unen los agentes infecciosos. Estos
incluyen a:
Los receptores
para Fc
Las Bacterias que tienen anticuerpos IgG unidos a su superficie
tiene la región Fc expuesta y esta parte de la molécula de Ig es reconocida
por el receptor Fc de los fagocitos. La unión al receptor para Fc requiere
de la interacción previa del anticuerpo con el antígeno. La unión de las
bacterias cubiertas con IgG a los receptores Fc resulta en una fagocitosis
aumentada y en la activación de la actividad metabólica de los fagocitos
(estallido respiratorio).
Receptores para el complemento
Las células fagocíticas tienen un
receptor para el tercer componente del complemento, C3b. la unión de las
bacterias cubiertas con el C3b a este receptor resulta también en una
fagocitosis aumentada y en la estimulación del estallido respiratorio.
Receptores de limpieza
Estos receptores se unen a una amplia variedad
de polianiones presentes en las superficies bacterianas lo que resulta en la
fagocitosis de las bacterias.
Receptores tipo Toll
Los fagocitos tienen una variedad de receptores
tipo Toll (TLRs) o también llamados receptores de patrones de reconocimiento
(PRRs) los cuales reconocen amplios patrones moleculares denominados PAMPS (pathogen
associated molecular patterns) que presentan los agentes infecciosos. La
unión de agentes infecciosos vía los TLRs resulta en fagocitosis y
liberación de citocinas inflamatorias (IL-1, IL-6 y TNF-alpha) por los
fagocitos.
|
| |
Fagocitosis
Después de que una bacteria se adhiere al fagocito, este comienza a extender sus
pseudópodos
hacia el microorganismo. Eventualmente los pseudópodos rodean a la bacteria y
terminan por engullirla y encerrarla en un fagosoma.
Durante la fagocitosis los gránulos o lisosomas del fagocito se fusionan con el
fagosoma vaciando su contenido en este último. El resultado es una bacteria
confinada en un
fagolisosoma que
contiene las sustancias de los gránulos o lisosomas.
|
|
|
|
ANIMACIÓN
Quimiotaxis de Neutrófilos
Low Resolution (Quicktime)
High Resolution (Quicktime)
© Mondo Media, San Francisco, Calif., USA
and
The
MicrobeLibrary
|
ANIMACIÓN
Fagocitosis
Quicktime
© James A. Sullivan, CellsAlive!
Video,
Charlottesville, Va., USA
and
The
MicrobeLibrary |
ANIMACIÓN
Fagocitosis y Patógenos Bacterianos
Interactive Flash Tutorial
©
Thomas M. Terry
University of Connecticut
Storrs, CT 06269 USA
and
The
MicrobeLibrary |
|
|

Figure11
A.
Estallido respiratorio: reacciones oxygeno-dependiente, mieloperoxidasa-independiente
 B.
Estallido respiratorio: reacciones oxygen-dependiente, mieloperoxidasa-dependiente
B.
Estallido respiratorio: reacciones oxygen-dependiente, mieloperoxidasa-dependiente
|
Estallido respiratorio y muerte
intracelular
Durante la fagocitosis hay un aumento en el consumo de glucosa y oxígeno lo cual
es referido como el estallido respiratorio. La consecuencia del estallido
respiratorio es la producción de un número de compuestos que contienen oxígeno y
que pueden matar a las bacterias fagocitadas. Esto es referido como muerte
celular dependiente de oxígeno. Además, las bacterias pueden ser destruidas por
sustancias pre-formadas liberadas de los gránulos o lisosomas al fusionarse con
el fagosoma. Esto se refiere como muerte intracelular independiente de oxígeno.
Muerte intracellular dependiente de oxígeno independiente de mieloperoxidasa (Figura
11A)
Durante la fagocitosis la glucosa es metabolizada por la
vía pentosa monofosfato
formándose el NADPH. El citocromo B que forma parte de los gránulos
específicos se combina con la NADPH oxidasa de la membrana y la activa. La
NADPH oxidasa utiliza al oxígeno para oxidar al NADPH. El resultado es la
producción del anión superóxido. Parte del anión superóxido es convertido a H2O2
y singlete de oxígeno por la superóxido dismutasa. Adicionalmente, el anión
superóxido puede reaccionar con H2O2 resultando en la formación de radicales
hidroxilo y más singlete de oxígeno. El resultado de todas estas reacciones es
la producción de los compuestos tóxicos como el anión superóxido (O2-),
H2O2, el singlete de oxígeno (1O2) y los
radicales hidroxidrilo (OH•).
Muerte intracelular dependiente de oxígeno dependiente de mieloperoxidasa
(Figura 11B)
A medida que los
gránulos azurófilos se fusionan con el fagosoma, la mieloperoxidasa es liberada
al fagosoma. La mieloperoxidasa utiliza H2O2 y iones
haluro (generalmente Cl-) para producir hipoclorito, sustancia sumamente tóxica.
Parte del hipoclorito se degrada espontáneamente para dar el singlete de
oxígeno. El resultado de estas reacciones es la producción del hipoclorito (OCl-)
y del singlete de oxígeno (1O2).
Reacciones de destoxificación (Tabla 3)
Los PMNs y los macrófagos tienen maneras de protegerse ellos mismos de los
intermediarios de oxígeno tóxicos. Estas reacciones implican la
dismutación del
anión superóxido a peróxido de hidrógeno por la superóxido dismutasa y la
conversión del peróxido de hidrógeno a agua por la catalasa.
|
Tabla 3 |
|
Reacción |
Enzima |
| H2O2 + Cl-
--> OCl- + H2O |
Mieloperoxidasa |
| OCl- + H2O
--> 1O2
+Cl- + H2O |
| 2O2 + 2H+
--> O2-
+ H2O2 |
Superóxido dismutasa |
| H2O2 --> H2O + O2 |
Catalasa |
Muerte celular
independiente de oxígeno (tabla 4)
Además de los
mecanismos de muerte que dependen de oxígeno también hay mecanismos
microbicidas independientes de oxígeno en los fagocitos: las proteínas
catiónicas (catepsina) liberadas en los fagolisosomas pueden dañar a las
membranes bacterianas; la lisozima rompe las paredes celulares de las
bacterias; la lactoferrina
quela al
hierro, lo cual priva a la bacteria de este requerimiento nutricional; las
enzimas hidrolíticas degradan proteínas bacterianas. Con lo anterior,
incluso los pacientes que tienen defectos en las rutas dependientes de
oxígeno son capaces de matar bacterias. Sin embargo, ya que los mecanismos
dependientes de oxígeno son mucho más eficientes, los pacientes con
deficiencies en estas rutas son más susceptibles y adquieren infecciones más
serias.
|
Tabla 4. Mecanismos
de muerte intracellular independientes de oxígeno |
|
Molécula
Efectora |
Función |
|
Proteínas catiónicas (incluyendo la
catepsina) |
Daña a las membranas microbianas |
|
Lisozima |
Corta al mucopéptido de la pared
celular bacteriana |
|
Lactoferrin |
Priva de hierro
a las bacterias |
|
Enzimas proteolíticas e hidrolíticas
|
Digiere a los organismos muertos |
|
|
 Figura
12
Muerte dependiente de óxido nítrico Figura
12
Muerte dependiente de óxido nítrico |
MUERTE
DEPENDIENTE DE ÓXIDO NÍTRICO
La unión de las bacterias a los macrófagos particularmente vía
receptores tipo Toll, resulta en la producción de TNF-alpha, la cual
funciona de manera autocrina para inducir la expresión del gen de la
oxido nítrico sintetasa inducible (i-nos ) dando lugar a la producción
del óxido nítrico (figura 12). Si la célula es también expuesta al
interferón gamma (IFN-gamma) se producirá más óxido nítrico (figura 12).
El óxido nítrico liberado por la célula es tóxico y puede matar a los
microorganismos cercanos a los macrófagos.
|
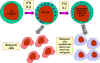 Figura 13 Células
NK y
su activación
Figura 13 Células
NK y
su activación
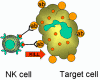 Figura 14
Figura 14
Muerte mediada por células NK de célula blanco opsonizadas |
CELULAS ASESINAS
NO-ESPECÍFICAS
Varios tipos de células que incluyen a las NK, LAK, K, macrófagos activados y
eosinófilos son capaces de matar células blanco extrañas y propias alteradas de
manera no-específica. Estas células juegan un papel muy importante en el sistema
inmune innato.
Células NK y LAK
Las células asesinas naturales (NK) se conocen también como linfocitos
granulares grandes (LGL, por sus siglas en inglés) ya que se asemejan
morfológicamente a los linfocitos, excepto que son ligeramente más grandes y
tienen numerosos gránulos. Las células NK se identifican por la presencia de
los marcadores de superficie CD56 y CD16 y la ausencia del marcador CD3. Las
células NK son capaces de matar células blanco infectadas con virus y células
malignas aunque son relativamente poco eficientes para hacerlo. Sin embargo,
cuando se incuban con IL-2 e IFN-gamma, las células NK se convierten en células
activadas por linfocinas (LAK, por sus siglas en inglés), las cuales son capaces
de matar células malignas. La exposición continua a IL-2 e IFN-gamma capacita a
las células LAK para matar a células transformadas así como malignas. La terapia
con células LAK es uno de las estrategias para el tratamiento del cáncer.
¿Cómo distinguen las células NK y LAK a las células normales de las infectadas
por virus o las malignas? Las células NK y LAK tienen dos tipos de receptores
en su superficie – un receptor activador de la citotoxicidad (KAR) y un
receptor inhibidor de la citotoxicidad (KIR). Cuando el KAR encuentra su
ligando, un ligando activador (KAL) en la célula blanco, las células NK o LAK
son capaces de matar a las blanco. Sin embargo, si el KIR se une también a su
ligando entonces la citotoxicidad es inhibida aunque el KAR se encuentre unido
al KAL. Los ligandos del KIR son las moléculas del MHC clase I. Por lo tanto, si
una célula blanco expresa moléculas MHC clase I no será destruida por las
células NK o LAK aunque ésta tenga KAL que se una al KAR. Las células normales
expresan constitutivamente moléculas MHC clase I en su superficie, sin embargo,
las células malignas y las infectadas por virus regulan negativamente la
expresión de las moléculas MHC clase I. Por lo tanto, las células NK y LAK matan
selectivamente células infectadas por virus y células malignas sin afectar a las
células normales.
Células K
(Figura 14)
Las células asesinas (K) no son un tipo morfológicamente distinto de células.
Más bien una célula K es cualquier célula efectora en la citotoxicidad celular
dependiente de anticuerpo (ADCC). En la ADCC el anticuerpo actúa como enlace
para acercar a la célula K con su blanco y permitir que la citotoxicidad ocurra.
Las células K tienen en su superficie receptores para la región Fc de los
anticuerpos y por lo tanto pueden reconocer unirse y matar a células blanco
cubiertas con anticuerpos específicos. Dentro de las células K que tienen
receptores Fc se incluyen a las NK, LAK y macrófagos que tienen receptores Fc
para IgG y los eosinófilos, con receptores para Fc de IgE.
|
| |
Todos los components del sistema immune no-específico son modulados por
productos del sistema immune específico, tales como las interleucinas, el
interferón gamma, los anticuerpos, etc. |
|
A este punto usted deberá saber lo siguiente:
1. Diferencias entre las funciones inmunes no-específicas y
específicas
2. Los componentes humorales del sistema immune no-específico y sus
actividades
3. Los componentes celulares del sistema immune no-específico y sus
actividades
4. Las rutas de la destrucción intracellular de bacterias por los
fagocitos y sus principales características
5. Efecto de los componentes humorales tales como el interferón, TNF, IL-2,
complemento etc., sobre los componentes celulares del sistema inmune
no-específico |
|
Tabla 5. Características de las células implicadas en la resistencia
no-específica
|
|
Célula efectora |
Marcadores específicos y/o función |
|
CD3 |
Ig |
Fc |
CD |
Fagocitosis |
|
Neutrófilo
Macrófago
Células NK
Células K
Celulas LAK
Eosinófilos |
-
-
-
-
-
- |
-
-
-
-
-
- |
IgG
IgG
IgG
IgG
?
IgE |
CD67
CD14
CD56 & 16
?
?
CD67 |
+
+
-
-
?
-
|
|
|
|
 Regreso a la sección de Inmunológica
Microbiología e Inmunología on line
Regreso a la sección de Inmunológica
Microbiología e Inmunología on line
|

 Figura 4A Dos neutrófilos en un frotis de sangre © Bristol Biomedical
Image Archive Used with permission
Figura 4A Dos neutrófilos en un frotis de sangre © Bristol Biomedical
Image Archive Used with permission
 Figura 5
Figura 5 Figura 10
Adherencia de bacterias vía receptores
Figura 10
Adherencia de bacterias vía receptores Figura 13 Células
NK y
su activación
Figura 13 Células
NK y
su activación













