|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VİROLOJİ |
|
|
VİROLOJİ - ÜÇÜNCÜ BÖLÜM
DNA VİRÜSLERİNİN REPLİKASYONU STRATEJİLERİ
Dr Margaret Hunt
Professor Emerita
Department of Pathology, Microbiology and Immunology
University of South Carolina School of Medicine
Katkı yapan:
Dr Dorian McIlroy
University of Nantes
Çeviren. Prof. Dr.
Selçuk Kaya
İzmir Katip Çelebi Üniversitesi, Tıp Fakültesi
|
|
SPANISH |
|
ENGLISH |
|
FRENCH |
|
ALBANIAN |
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|
|

 |
|
|
|
|
|
ÖĞRETİM HEDEFLERİ
Hayvan DNA virüsleri tarafından kullanılan replikatif stratejilerinin
tanımlayıcı analizi
Farklı DNA virüsü replikasyon şemaları ile ilişkili prototiplerin
tanımlanması
|
GENEL
Viral genom şu bilgileri içerir:
-
Viral genomların replikasyonunun sağlar
-
Genomların virionlar içinde paketlenmesini sağlar
-
Hücre yapısını ve/veya fonksiyonunu daha yüksek ya da düşük
dereceye değiştirir.
VIRAL STRATEJİ
Viral strateji her virüs yukarıdaki işlevleri hangi şekilde
yürüttüğünü ifade eder. Virüs, bir hücre içi paraziti olduğu için bu, konak
hücrenin koyduğu sınırlar içinde faaliyet gösterir veya bu sınırlamaları aşmak
zorundadır.
DNA VİRÜSÜNÜN REPLİKASYONU STRATEJİLERİ
Genel
-
Virüs, konak hücrenin translasyon mekanizmaları tarafından
proteine dönüştürülebilir mRNA'lar yapmak zorundadır.
-
Virüs kendi genomunu çoğaltmak zorundadır.
-
mRNA sentezi ve DNA replikasyonu için gerekli olan konakçı
enzimleri (mitokondride olanlar hariç) çekirdek içindedir ve bu nedenle
virüs kendi başına bu enzimlerden yaralanabilmek için çekirdeğe girmesi
gerekir.
|
 Şekil 1a DNA virüslerden Parvoviridae ailesinin Parvovirüs H-1 virionlar
Şekil 1a DNA virüslerden Parvoviridae ailesinin Parvovirüs H-1 virionlar
CDC
 İnsan parvovirus B19
İnsan parvovirus B19
Image courtesy of Dr J-Y Sgro
Used with permission
|
NUKLEER DNA
VIRUSLARI
PARVOVIRUS AiLESİ
Parvovirüsleri, çok küçük (18- 25nm çapında), tek iplikli DNA
virüsleridir(parvum = küçük) (Şekil 1a). İkosahedral kapsidleri vardır ve zarf
bulunmaktadır. DNA replikasyon çekirdeği gerçekleşir.
Birçok insan parvovirüsü replikasyon için ko-enfeksiyon yapacak
başka bir DNA virüsüne ihtiyaç duyan- adenovirüs ya da herpesvirüs gibi- uydu
virüslerdir. Bu adeno-ilişkili virüsler (AAV) gen terapi vektörleri olarak
geliştirilmiştir. Öte yandan, bocavirüsler(solunum enfeksiyonu etkeni) ve
parvovirüs B-19 yardımcı virüs olmadığında da replikasyon yeteneğine sahiptir.
İnsan parvovirüsü B-19 bölünen hücrelerde çoğalır- öncelikle
kemik iliğinde eritrosit öncüllerinde - ve beşinci hastalığa (eritema
enfeksiyozum) neden olur. Bu genellikle hafif bir hastalıktır ama kırmızı kan
hücrelerinin azalması üretim çeşitli ağır hemolitik anemisi olan kişilerde sorun
olabilir.
Tutunma, penetrasyon
ve soyulma
Parvovirüs B-19 eritrosit öncülleri yüzeyinde de bulunan eritrosit P-antijenine
( veya globosid) bağlanır. Bağlanmanın ardından eritrosit öncülleri
tarafında eksprese edilen ancak olgun eritrositlerde e eksprese edilmeyen
α5β1 integrin aracılı virion endositozu gerçekleşir. İntegrin co-reseptör
kullanımı, çekirdeği olmadığı için kırmızı kan hücrelerine giremeyeceğinden
parvovirüs B19 replikasyonunu destekleyemez.
Virion minör kapsid proteini, VP1 etkisine bağlı olarak, girdikten sonra
endolizozomdan kurtulur. Sonra parvovirüs virionları çekirdek civarına
mikrotübüler ağı üzerinden aktif taşınmaktadır. Nükleer por kompleksinden
geçerek nukleusa girebilecek kadar küçüktürler ve soyulma çekirdekte meydana
gelir.
Gen ekspresyonu ve DNA
replikasyonu
Tek iplikli DNA genomu önce konak hücre enzimleri tarafından çift iplikli
DNA'ya dönüştürülür. Viral genomun her iki ucunda ters tekrarlanan terminal
(ITR) sekanslar, kendi üzerlerine geri-katlanır, böylece tek iplikli virüs
genomunun ucundaki serbest 3'OH grubu, böylece komplementer DNA zinciri
sentez için primer olarak kullanılabilir.
Çift zincirli parvovirüsü B-19 genomu hücresel
transkripsiyon faktörleri ve RNA polimerazı çalıştıran tek bir promoter
element içerir. Alternatif kırpılma ile iki kapsid proteini (VP1 ve VP2) ve
yapısal olmayan protein NS1i kodlayan mRNA'lar oluşur. Bu viral proteinler
sitoplazmada sentezlenir, daha sonra nükleuslara aktarılır.
NS1 virüs genomunun replikasyonu için gereklidir - ama bir
DNA polimeraz değildir. Bunun yerine NS1 özellikle çift zincirli virus
DNAsına bağlanır ve parvovirüs genomunun çok sayıda tek-zincirli kopyalarını
türetmek üzere konakçı DNA polimerazın viral DNAyı replike etmesine izin
verir. Parvovirüs B19 sadece DNA replikasyonu için gerekli hücresel
faktörlerin hepsini eksprese eden aktif döngüsel hücreleri içinde
çoğalabilir.
Hem (+) hem de (-) iplikli kopya oluşturulur ve her ikisi
de:
Birleşme ve Salınım
Birleşme çekirdekte meydana gelir ve virionlar hücre lizizi ile serbest
kalır.
|
Parvovirüs replikasyon stratejilerinin ayırıcı özellikleri |
| En küçük DNA virus genomu |
| Konak hücre RNA sentez
mekanizmalarını, RNA modifikasyon mekanizmalarını ve DNA sentez
mekanizmalarını sağlar |
| Parvoviridae kendi başına
SADECE aktif döngüsel hücrelerde (eritrosit öncülleri gibi) replike
olabilir. Aksi takdirde, Adenovirüs yada Herpes ile ko-enfeksiyon
gereklidir |
| Adeno-ilişkili virüsler(AAV)
gen terapi vektörleri olarak kullanılmak üzere geliştirilmiştir |
|
 Şekil
1b Papilloma virus Şekil
1b Papilloma virus
© Dr Linda Stannard, University of Cape Town, South Africa. Used
with permission |
PAPILLOMAVIRUS AİLESİ
Her iki aile üyelerinin de benzer yapıya sahip olmaları
nedeniyle HPV ailesi eskiden Polyomavirüs ailesi ile birlikte Papovavirüs ailesi
(Papilloma, Polyoma, Simian Vakuolasyon Virüsü 40) içinde gruplandırılmıştı.
Ancak, bu iki ailenin replikasyon stratejilerinin çok farklı olduğunun
anlaşılması üzerine her grup artık ayrı aile olarak sınıflandırılmaktadır.
|
POLYOMA VİRÜSLERİN VE PAPİLLOMA VİRÜSLERİN
ÖZELLİKLERİ |
| Küçüktürler:
40 - 60 nm |
| İkosahedral
yapıdadırlar: Majör kapsid proteinleri VP1 daha az miktarlarda da VP2 ve
VP3tür |
|
Zarfsızdırlar |
| Birbirine
hücresel histonlarla (nukleozomlar) bağlı, dairesel, çift zincirli
DNAya sahiptirler. |
Papillomavirüsler (Şekil 1b) kültürde
zor ürerler. Bunlar bu bölümde daha ayrıntılı olarak ele alınmayacaktır ( DNA
tümör virüsleri bölümüne bakınız).
|
 Şekil 2 SV40 virus, polyoma virus
Şekil 2 SV40 virus, polyoma virus
©Dr J-Y Sgro, University of Wisconsin. Used with permission |
POLYOMAVIRUSLAR SV40 (Şekil
2), BK, JC ve polioma virüslerini içerir. Tümü DNA replikasyonu için benzer
stratejilere sahiptir. Bunlar küçük (~ 40 nm çapında), ikosahedral yapıda,
çekirdekte replike olan zarfsız virüslerdir. Konak hücreye bağlı olarak, hücreyi
transforme ederler (birlikte ) ya da replike olup hücreyi lizise uğratırlar.
LİTİK SİKLUS
Bağlanma, penetrasyon ve
soyulma
Viral kapsid proteinleri hücre yüzey reseptörleri ile etkileşir ve
muhtemelen penetrasyon endositoz yoluyla gerçekleşir. Virionlar
çekirdeğe taşınır ve soyulur. DNA (ve ilişkili histonlar) muhtemelen
nükleer porlar yoluyla çekirdeğe girer.
Viral mRNA ve proteinlerin üretimi
Gen ekspresyonu, erken ve geç evre olarak ikiye ayrılır.
Viral replikasyon işleminin başlaması için enzimleri ve regülatör
proteinleri kodlayan erken genlere ihtiyaç duyulur.
Geç genler, matür virüs oluşturmak için gerekli yapısal
proteinleri kodlar.
|
 Şekil 3, erken gen ekspresyonu
Şekil 3, erken gen ekspresyonu
Not: - - - - Alternatif mRNA işlenmesinde çıkarılan primer transkript
bölgeleri gösterilmektedir.
Modified from Fiers et al.,Nature 273:113
 Şekil 4
Şekil 4
Geç gen ekspresyonu
NOT:- - - Alternatif mRNA işlenmesinde çıkarılan primer transkript
bölgeleri gösterilmektedir. Kalın oklar proteine çevrilen bölgeleri
gösterir.
Modified from Fiers et
al.,Nature 273:113
|
LİTİK
SİKLUSUN ERKEN FAZI
Erken
gen ekspresyonu (Şekil 3 ve 6)
Erken promotör konak RNA polimeraz II tarafından tanınır
(SV40 güçlü bir çoğaltıcı içerir). Transkripsiyon sonrası
RNA modifikasyonu (kapanma, metilasyon, poliadenilasyon,
uzama gibi) konağın enzimleri tarafından gerçekleştirilir.
Erken transkript (primer transkript) yapılır ve sonrasında
mRNAlarda, küçük T ve büyük T antijenler (bu proteinler
ortak amino-uçlara, ancak farklı karboksi-uçlara sahiptir)
oluşumuyla sonlanan alternatif bir işleme tabi tutulur.
mRNAlar sitoplazmada çevrilir.
Not: birden fazla protein için işlenebilen
ve kodlanabilen primer transkriptler çeşitli virüs aile
lerinde ve konak hücrede görülür.
LİTİK
SİKLUSUN GEÇ FAZI
Tanım olarak geç faz, viral genom
replikasyonunun başlaması ile başlar.
DNA
replikasyonu
SV40 / polyoma DNA replikasyonu çekirdekte gerçekleşir.
Büyük T antijeni DNA replikasyonu için
gereklidir. Replikasyon orjinine bağlanır.
Polyoma virüsleri, T antijeni mevcut ise
viral replikasyon orjinini tanıyan konak hücre DNA
polimerazını kullanılır.
DNA replikasyonu iki yönlüdür ( her
dairesel DNA için iki replikasyon çatalı vardır ve
replikasyon lider/geciken dizi, Okazaki fragmanları, DNA
ligaz, vb içerir). T antijeninin katılımı dışında esas
olarak konak mekanizmalarını kullanan virüsün DNA
replikasyonunun bu işleyişinin, konak hücrede
gerçekleşene çok benzer olması şaşırtıcı değildir.
Yeni yapılan DNA ile konak histon
kompleksi
Geç
gen ekspresyonu (şekil 4 ve 6)
Geç mRNAlar DNA replikasyonundan sonra
yapılır (çok sayıda yeni yapılan viral DNA artık şablon
olarak kullanılabilir). Erken mRNA'lar hala transkribe
edilmektedir, ancak çok çok daha düşük orandadır.
T antijeni, geç promotörlerden
kaynaklanan artmış transkripsiyonun ve erken promoterden
kaynaklanan azalmış transkripsiyonun kontrolüne dahil
olmaktadır. Ayrıca, konak proteinler ile etkileşimde
bulunur ve kona hücrenin özelliklerini değiştirir
böylece de hücre dönüşümünde ve tümör oluşumunda rol
oynar.
Diferansiyel (farklılaştıran) kırpılmaya
uğrayan VP1, 2 ve 3 aynı primer transkriptten
yapılır(Şekil 5). Bu, VP1 için çerçeve okumasında VP2 ve
VP3 için olandan farklılık oluşması ile sonuçlanır.
Dolayısıyla, kullanılan okuma çerçevesine göre bir DNA
bölgesi, iki farklı aminoasit dizisi için kod
oluşturabilir. Bu kısa DNA esnemesi, virüslerin (ve
hücrelerin) birden fazla protein sekansını kodlamak için
kullanabildiği diğer bir yoldur.
BİRLEŞME
VP1, 2 ve 3 mRNA'lar sitoplazmada çevrilir,
proteinler çekirdeğe taşınır ve kapsidler kapsid içindeki
DNA (ve hücre histonları) ile birleşir. Çok sayıdaki kapsid
çekirdekte birikir ve inklüzyon cisimciklerini oluşturur.
Virionlar hücre lizisi ile serbest kalır.
|
 Şekil 5
Şekil 5
Diferansiyel (farklılaştıran) kırpılmaya uğrayan VP1, 2 ve 3 aynı primer
transkriptten yapılır. Bu, VP1 için çerçeve okumasında VP2 ve VP3 için
olandan farklılık oluşması ile sonuçlanır. |
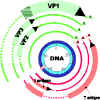 Şekil 6
Şekil 6
SV402nin gen ekspresyonu. Erken genler kırmızı, geç genler yeşille
gösterilmektedir. Not: - - - Alternatif mRNA işlenmesinde çıkarılan primer
transkript bölgeleri gösterilmektedir. Çapraz taranmış alan hangi alternatif
kırpılmış transkript dönüştürülüyorsa ona göre farklı çerçeve okumasıyla
RNAnın çevrildiği bölgeyi göstermektedir.
Modified from Fiers et al.,Nature 273:113 |
|
POLYOMA VİRÜS
STRATEJİSİNİN AYIRICI ÖZELLİKLER |
| Erken ve geç
fonksiyonlar |
| Aynı DNA dizisinin
çoklu kullanımı (alternatif kırpılma, örtüşen çerçeve okumaları) |
| Çok fonksiyonlu
protein (T antijeni) |
| Küçük genom Bu
yüzden virüsün çok sınırlı sayıda protein kodlaması şaşırtıcı
değildir |
| Konak hücre RNA
sentez mekanizmalarını, RNA modifikasyon mekanizmalarını, DNA sentez
mekanizmalarını, DNA paketlenmesi için histonları sağlar. |
|
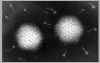 Şekil 7a
Şekil 7a
Adenovirüs yapısı
© Dr Linda Stannard, University of Cape Town, South Africa.
Used with permission
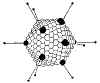 Şekil 7b
Şekil 7b
Adenovirüs yapısı |
ADENOVIRUSLAR
Adenovirüsler çift zincirli lineer genomlu, zarfsız ikosahedal yapıda
DNA virüsleridir. (Şekil 7 ve 8)
|
ADENOVIRUSLARIN ÖZELLİKLER |
| Papovavirüslerden daha
büyüktürler (70 nm çapında) |
| Zarfsız, köşe
fiberleriyle ikosahedral virüslerdir (şekil 7 ve 8) |
Genomu
Polioma virüs genomunun yaklaşık 7 kat boyutundadır
|
| DNAsı lineer, çift
zincirli, virüsün kodladığı virion içindeki temel proteinler ile
ilişkili dir (papilloma virüsleri ve polyoma virüslerinin aksine,
adenovirüsler virionu DNAsını paketlemek için hücre histonlarını
kullanmaz) |
|
| |
LİTİK SİKLUSU
Tutunma ve
penetrasyon
Adenovirüsler genellikle epitel hücrelerini enfekte eder. Fiberler,
bir hücre yüzeyi reseptörüne bağlanır ve virüs endositozla yutulur.
Görünüşe göre virüs endozomları parçalayabilmektedir. Soyulma
aşamalı gerçekleşir. DNA çekirdek içine (muhtemelen nükleer
porlardan) (Şekil 9) salınır.
Erken faz
Erken transkripsiyon: Adenovirüs konak hücre RNA polimerazını
kullanır ve erken mRNAlar her iki dizinin farklı bölgelerinden
transkribe edilir (Şekil 10). Çoklu promotörler daha değişken bir
kontrole neden olurlar. mRNAların başlık takılması, metilasyon,
poliadenilasyon ve enzim sistemlerinin kırpılması (bazen) işlemleri
konak hücre tarafından yapılır, daha sonra sitoplazmaya gönderilir
ve dönüştürülür.
|
| |
A

B
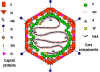 Şekil 8 Adenovirüs virion Modelleri.
Şekil 8 Adenovirüs virion Modelleri.
A: Bir intakt adenovirüs partikülünün 3 boyutlu yapısı ikosahedral 3
dönüşlü ekseni boyunca görülmektedir
© EMBL Virüs Yapısı kaynak alınmıştır
B: Adenovirüs partikülünün polipeptit bileşenlerinin ve DNA'sının mevcut
bilgilere dayanarak şekillendirilmesi. Hiçbir gerçek ikosahedral virion
tüm bileşenleri içeremez. Virion bileşenleri terminal protein (TP) hariç
olmak üzere polipeptit numaralarına göre belirtilmiştir.
Fields ve arkadaşları, Temel Virology (1996) dan uyarlanmıştır.
|
| |
Erken proteinler in yer aldığı olaylar:
-
transkripsiyon için gereklidirler (E1 proteini diğer
erken genlerin transkripsiyonu için gereklidir; bu nedenle diğer genler,
bazen "gecikmiş erken" olarak ve E1A da " hemen erken" gen olarak
adlandırılır).
-
adenovirüs DNA sentezi için gereklidirler (DNA polimeraz
dahil olmak üzere).
-
konak hücre, gen ekspresyonunu değiştirirler. Bunlar,
ürünleri konak hücre anti viral cevabını ve / veya hücre siklusu
regülasyonunu etkileyen genleri kapsar.
|
| |
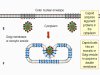
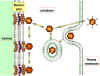 Şekil
9 Adenovirüs partiküllerinin alınması ve soyulmasının şematik gösterimi. Şekil
9 Adenovirüs partiküllerinin alınması ve soyulmasının şematik gösterimi.
Zinsser Mikrobiyoloji 20. baskıdan uyarlanmıştır
 Şekil 10
Şekil 10
Adenovirüsün transkripsiyon haritası. Erken genler kırmızı ile
gösterilmiştir. Siyah geç genleri gösterir. Mavi hat DNAyı göstermektedir.
Köşeli parantezler promotör konumlarını göstermektedir. Her promotörden
primer transkriptler yapılır ve daha sonra alternatif kırpılmaya tabi
tutulur, diyagram üzerinde primer transkriptler görülmemektedir. Sadece
alternatif olarak kırpılmış ürünlerde varolan bölümler gösterilmiştir.
Eksik bölgeler intronların kaldırıldığını göstermektedir.
Adapted from Broker, T.R. In Processing of RNA. (Apirion, D
ed) 181-212, 1984
|
 Şekil 11
Şekil 11
Yer değiştirme mekanizmasıyla Adenovirüs DNA replikasyonu |
Geç faz
DNA replikasyonu
Adenovirüs kendi DNA polimerazını (erken
proteinlerden biridir) kodlamaktadır. DNA dizi yer değiştirme
mekanizması (Şekil 11) ile çoğaltılır. Herhangi bir Okazaki
fragmanları yoktur, her iki dizi sürekli bir şekilde sentezlenir.
DNA polimeraz sentezi de novo olarak başlatamaz, bir
primere ihtiyaç duyar. Adenovirüsülerde, viral kodlanmış terminal
protein (TP), primer olarak rol oynar. Bu yüzden adenovirüs DNA
iplikçiklerinin 5 'ucuna kovalent bağlanır.
|
|
 Şekil
12 Şekil
12
Viral primer transkriptin işlenmesi |
Geç transkripsiyon
Geç transkripsiyonun başlayışı iyi anlaşılmamıştır.
Geç mRNA'lar esas olarak yapısal proteinleri ve bir ana geç
promotörü kodlar(Şekil 12) . Primer transkript çeşitli monosistronik
mRNA'ları (şekil 12) oluşturmak için işlenir:
Primer transkript bölünmesinin iki tipi vardır:
Her mRNA'dan doğru miktarlarda yapılması gibi
işlemlerin nasıl kontrol edildiği anlaşılamamıştır. Görünüşe göre
virüs virionderlenmesi için gerekli olandan daha fazla mRNA ve
protein yapmaktadır, bu yüzden çok sıkı bir kontrol gerekli
olmayabilir.
|
| |
Birleşme
Adenovirüs partiküllerinin birleştirilmesi çekirdekte
meydana gelir. İmmatür kapsidler oluşturulduktan sonra, DNA partiküllere
girer. hücrelerin lizisi ve virionların dışarı salınımı sonrasında
kapsidler bir olgunlaşma işlemimine tabi olur.
Gerekli olandan daha fazla yapısal proteinleri yapılır
ve bu fazlalık yapısal proteinler, inklüzyon cisimciklerini oluşturmak
üzere çekirdekte birikir.
|
| |
|
ADENOVİRÜS STRATEJİSİ AYIRICI ÖZELLİKLERİ |
| Adenovirüsler
papovavirüslerden daha büyük ve karmaşıktır |
| Adenovirüsler kendi
DNA polimerazlarını ve DNA paketleme proteinleri i kodlar |
| Ancak, adenovirüsler
kendi DNA polimerazlarını kodlasa da, DNA replikasyonu için viral
proteinlere ilaveten konakçı faktörleri de kullanırlar, konakçı RNA
polimeraz ve RNA modifikasyon sistemlerini kullandıkları içi nükleik
asit sentezinin çekirdek içinde olması gerekir |
|
|
 Şekil
13a Şekil
13a
Herpesvirüsünün yapısı
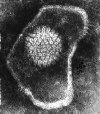 Şekil 13b
Şekil 13b
Herpes simplex virus
© Dr Linda M Stannard, University of Cape Town, South Africa,
1995 (used with permission).
|
HERPESVIRUSLAR
Herpesvirüsler doğrusal çift iplikli DNA ve hem zarflı hem de ikosahedral
yapıdadır (Şekil 13).
|
HERPES VIRUSLARIN ÖZELLİKLERİ |
| Adenovirüslerden daha
büyük virionlardır (180 - 200 nm) |
| Adenovirüslerden daha
büyük genoma sahiptirler (3-5 kez) |
| Lineer, çift iplikli DNA |
| Zarflı, ikosahedral
virüslerdir (bu da lipid çözücülerin kolayca bu virüsleri etkisiz hale
getirebileceği anlamına gelir) (Şekil 13) |
|
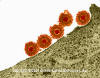 Şekil 14
Şekil 14
Herpes simpleks virüsünün plazma zarına tutunması
© Dennis Kunkel Microscopy, Inc. Used with permission
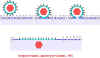 Şekil 15
Şekil 15
Membran bağımlı virüsün plazma membranı ile füzyonu |
Tutunma ve penetrasyon
Herpes simpleks virüsü de dahil olmak üzere pek çok herpes virüs, hücre
plazma zarıyla direkt olarak birleşebilir (kısmi soyulma ile sonuçlanır) (Şekil
14). Plazma membranı ile bu tür bir füzyonun hem virüse hem de konakçı
hücreye etkileri vardır. Bunlar arasında:
- Füzyon proteini, fizyolojik pH'da aktif olduğu için, virüs büyüme
döngüsü sırasında konak hücre membranı içine sokulduğu takdirde, enfekte
edilmiş hücre, potansiyel olarak diğer hücrelerle birleşir ve sinsitiyum
oluşturur.
- Viral membran hücre plazma membranında bir "ayak izi" bırakır ve bu
hücrenin enfekte olduğunu gösteren olası bir ipucudur (Şekil 15)
Kapsidler çekirdeğe doğru taşınır ve DNA çekirdeğin içine geçer (muhtemelen
nükleer porlar yoluyla).
|
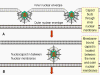
 Figure
16 Expression of immediate early, early and late genes of herpesviruses Figure
16 Expression of immediate early, early and late genes of herpesviruses |
Erken faz
Erken transkripsiyon (bu aşamada yapılan mRNA alfa ve beta
mRNAlardır) (Şekil 16)
Herpes virüsleri, konakçı RNA polimerazı kullanılır. Ancak, virion zar
proteini (VP16) enfeksiyonu takiben çekirdeğe girer ve bu konakçı RNA
polimerazı tarafından tanınan transkripsiyon faktör kompleksinin bir parçası
olarak önemlidir. Virüs konak mRNA modifikasyon enzimlerini kullanır.
Başlangıçta, alfa-mRNAların transkripsiyonu olur. Bunlar
hemen erken mRNAlardır ve sitoplazmaya gönderilerek ve alfa-proteinlere
çevrilirler. Sitoplazmada dönüştürülen α-proteinler, konakçı RNA polimeraz
tarafından kullanılacak olan beta-promoterların etkinleşebileceği yer olan
çekirdeğe taşınır (Şekil 16).
Beta-mRNAlar konak RNA polimeraz tarafından transkribe
edilir. ( Transkripsiyonlarından DNA sentez öncesine kadar beta-genleri hala
"erken" dir. Bazen bu nedenle, alfa-genler "hemen erken" ve beta-genler "erken"
olarak adlandırılırlar). Beta proteinler gen ekspresyonunun düzenlenmesinde
rol oynamaktadır. alfa-gen ekspresyonunu azaltırlar ve gama gen ekspresyonu
için gereklidirler. Ayrıca DNA sentezine pek çok açıdan katkıda bulunurlar;
örneğin, herpes beta- genleri dahil olmak üzere bir çok protein için kod
oluştururlar bunlar:
-
DNA polimeraz
-
DNA binding proteinleri
-
timidin kinaz
-
ribonukleotid reduktaz
BETA PROTEİNLER KONAK TARAFINDAN DEĞİL VİRAL OLARAK KODLANDIĞI İÇİN,
MUHTEMELEN VİRUS YAŞAM DÖNGÜSÜNDE ZAYIF BAĞLANIRLAR VE BU YÜZDEN VİRAL
KEMOTERAPİ İÇİN UMUT VEREN HEDEFLERDİR
|
|
 Şekil 17
Şekil 17
Herpes virüslerin olası genomik yapıları |
Geç faz
DNA replikasyonu
Herpesvirüsler DNA replikasyonu için gerekli olan DNA polimeraza ilave
olarak çeşitli proteinleri kodlarlar. DNA replikasyonunun mekanizması
tam olarak bilinmemektedir. DNA replikasyonuna bir çok rekombinasyon
eşlik etmektedir. Replike olmuş DNA uzun konkatamerik moleküller (baş-kuyruk
bağlantılı genomun tandem tekrarları) olarak mevcuttur. Bunlar, DNA
virion içinde paketleneceği zaman genom boyutundaki uzunluklara
bölünürler.
Diğerlerinin tersine bazı herpesvirüsler (örneğin herpes simpleks virüsü)
birbirine dönüşebilen ilişkili iki parçalı genoma sahiptir (şekil 17).
Bunun önemi net değildir.
Geç transkripsiyon
Tanım olarak, geç transkripsiyon, DNA replikasyonundan sonra oluşur.
Gama mRNAlar yapılır ve sitoplazmada çevrilir. Gama proteinleri
ağırlıklı olarak yapısaldır. Geç evrede beta genlerinin ekspresyonu
azalır. Bunun nedeni büyük olasılıkla gama proteinlerden birinin beta
gen transkripsiyonunu down-regüle etmesidir.
Herpesvirüslerde erken ya da geç transkripsiyon için genomun bölümlere
ayrılmış belirgin bir organizasyonu yoktur.
|
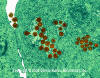 Şekil 18A
Şekil 18A
Hücresel vakuollerde ve periferik kan lenfosit sitoplazmasındaki herpes
simpleks virüsü
© Dennis Kunkel Microscopy, Inc. Used with permission
 Şekil 18B
Şekil 18B
Periferik kan lenfositleri üzerinde ve içindeki herpes simpleks virüs
© Dennis Kunkel Microscopy, Inc. Used with permission
|
Birleşme
Derlenme çekirdekte meydana gelir. Bir kapsid oluşur ve DNA kapside girer.
Kapsidler viral membran proteinlerin yerleşik olduğu iç nükleer membran
alanlarından tomurcuklanan bir zarf edinir(Şekil 18). Bu alanlar, iç nükleer
membranın iç yüzü ile ilişkili zar proteinlerine sahiptir. Virüs zarfı sonra
dış nükleer membran ile birleşir ve zarfsız nucleocapisid bir daha olgun bir
zar edineceği sitoplazma içine gönderilir. Golgiden türemiş veziküller
içinde tomurcuklanma ile tekrar zarf edinir ve sonrasında salınır.
Hemen erken mRNAların transkripsiyonu için gerekli geç protein
enfeksiyonun sonraki aşamasında virionda paketlenir.
Fazlalık yapısal proteinler genellikle inklüzyon cisimcikleri(sitopatik
etkinin bir parçası) şeklinde çekirdeğin içinde birikir.
|
HERPESVİRÜSLERİN
AYIRICI ÖZELLİKLERİ |
| Erken veya geç
genlerin hiçbir belirgin kalıbı yoktur |
| Bazı küçük
virüslerden daha bağımsızdırlar |
| Daha bağımsız
olduklarından, daha zayıf bağlantılar vardır ve bu sayede
ilaçlar için hedef olabilirler. |
|
|
|
|
 |
 |
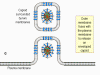 |
Şekil 18C (sağda) Virüs çekirdeğinin derlendiği nukleustan plazma zarına
herpes virüsün ekzositoz aşamaları |
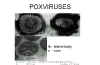 Şekil 19 pox virüslerin negatif boyanması ve ince kesiti
Şekil 19 pox virüslerin negatif boyanması ve ince kesiti
© F. Fenner |
SİTOPLAZMİK DNA VIRUSLARI
|
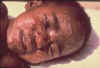 Şekil 20 çiçek hastalığı olan çocuk
Şekil 20 çiçek hastalığı olan çocuk
CDC/Cheryl Tryon ctt1@cdc.gov |
POXVIRUSLAR
Poksvirüslerin(Şekil 19) önemli olmasının birçok nedeni vardır:
- Çiçek hastalığı (şekil 20) ve vaksinia (çiçek aşısında kullanılan inek
çiçeği) gibi bazı poksvirüslerin tarihsel önemi vardır
- Pox virüsler biyoterörizm ajanı olabilirler
- Poks virüsleri, aşı geliştiriminin yeni tekniklerinde kullanılır (örneğin
genetik mühendislik aşıları gibi)
- Bu ailenin bazı üyeleri insanı (molluscum contagium (şekil 21), orf,
maymun çiçeği, inek çiçeği) enfekte eder. Not: Poxviridae üyesi olmayan
suçiçeğinin etkeni bir herpes virüstür.
|
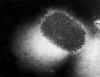 Şekil 21
Şekil 21
Molluscum contagiosum poksvirüsünün elektron mikroskobunda transmisyonu
CDC |
|
POXVIRUSLARIN ÖZELLİKLERİ |
| Büyük
virionlardır |
| Büyük
genom, çift iplikli bir DNA vardır boyutu değişir ama herpesvirüsler
kadar ya da daha büyüktürler |
|
Morfolojileri karmaşıktır |
| Zarflıdır |
|
| |
Poksvirüsleri sitoplazmada replike olur. Bu da kendi mRNA ve DNA sentez
sistemlerini sağlamak zorunda oldukları anlamına gelir.
Vaksiniya poksvirüs ailesinin
en yoğun çalışılan üyesidir.
Adsorpsiyon
ve penetrasyon
Virüs, hücre yüzeyi
reseptörlerine bağlanır. Endositoz yoluyla veya virüsün plazma zarı ile
doğrudan füzyonu ile hücreye girer. Virüs daha sonra sitoplazmaya salınır,
mebranından sıyrılır.
Erken
faz
Erken transkripsiyon
Soyulmanın ilk aşaması gerçekleştikten sonra, virüs sınırlı sayıda
mRNA'larını (hemen erken mRNA'lar) yapabilir. Bunu yapmak için poksvirüs,
bir DNA-bağımlı RNA polimeraza ihtiyaç duyar. Konak RNA polimerazının
hücre çekirdeğinde olması pox virüsünün neden kendi RNAlarını yapmak
için bir viral olarak kodlanan DNA-bağımlı RNA polimeraz kullandığını
açıklar. Bu enzim enfeksiyonun hemen ardından gerekli olduğu için,
enfekte olmuş hücreye virionda mevcut olan vaksinia DNAsı ile
getirilmiş olmalıdır. Tüm proteinleri çıkarılmış"çıplak" vaksinia DNAsı
onunla ilişkili RNA polimerazı olmadığı için enfektif değildir ve RNA
olmadan protein yapılamayacağından vaksinia RNA polimerazı olmadan
vaksinia yaşam döngüsünde hiçbirşey gerçekleşemez.
Poksvirüs mRNA'ları
tıpkı standart ökaryot mRNA'larında olduğu gibi şapkalı, metile ve
poliadeniledir ancak konak hücre mRNAları çekirdekte modifiye edilir ve
vaksinia sitoplazmada replike olur. Vaksinia sitoplazmik olduğu için, bu
değişiklikler viral kodlanmış enzimler tarafından gerçekleştirilmelidir.
Modifiye edici enzimler virionlar içinde paketlenir ve böylece mRNA'lar
hemen yapılarak sonrasında enfeksiyon modifiye edilebilir. Şimdiye kadar,
vaksinia için bildirilmiş hiçbir kırpılmış RNA yoktur (sitoplazmada
replike olduğu için ve konağın kırpılma enzimleri nukleusta olduğu için
bu şaşırtıcı değildir).
Hemen erken mRNA'nın
translasyon ürünlerinden biri de soyulma enzimidir. Bu sonraki vaksinia
DNA soyulmasına olanak sağlar ve böylece daha fazla gen transkribe
edilebir - artık tüm erken genler eksprese edilebilir. Pox virüsü
soyulma tamamlanabilmesi için, yeni enfekte olmuş hücrede yapılması
gereken bir soyulma proteini kodladığı için eşsizdir.
Virüs üretim "fabrikaları"
sitoplazmada görülür - vaksinia virüsü replikasyon siteleri.
Erken proteinler, DNA
replikasyonuna, RNA transkripsiyonuna, RNA modifikasyon ve soyulmasına
katılmaktadır. Ayrıca birkaç yapısal protein içerirler.
|
| |
Geç faz
DNA sentezi
DNA sentezi "fabrikalarda" gerçekleşir ve alışılmadık bir mekanizma
kullanır ancak burada ele alınmayacak.
Geç transkripsiyon ve
translasyon
Bu karmaşık bir süreçtir. Bazı geç proteinler geç faz boyunca yapılırken,
bazıları da sadece geç fazın başlangıcında yapılır. Bazı erken
proteinler yalnız DNA replikasyonunun başında yapılırken diğer erken
proteinler erken faz kadar geç fazda da yapılırlar. Bu yüzden, hangi
proteinlerin ne zaman vaksinia tarafından yapılacağı karmaşık bir
şekilde kontrol edilmektedir. Bu da sadece erken/geç kontroller değil
bunların dışında da başka kontroller var demektir. (Bu çok büyük bir
virüstür, dolayısıyla karmaşıklık şaşırtıcı değildir.)
|
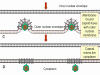
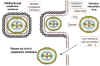 Şekil 22
Şekil 22
Enfeksiyöz pox virionu oluşumunun olası şeması. Virüs çekirdeği sitoplazmik
membranla sarılmış olabilir ve konak hücre parçalandığı zaman kaçabilir. Diğer
bazı zara-bağlı virionlar iki zara sahip olduklarında diğer zarlara
tomurcuklanabilirler. Her iki durumda da, viryonlar enfektiftir.
Adapted from Baron, S. Ed. Medical
Microbiology 4th Edition. 1996. |
Birleşme
Birleşme sitoplazmada "fabrikalarda" oluşur. Yeni,
olgunlaşmamış virüs parçacıkları sitoplazmadayken bir zar kazanır -
kesin mekanizması tam olarak anlaşılamamışsa da virüs hücresel
membranlar tarafından "sarılıyor" gibi görünüyor (Şekil 22). Daha önceki
mebranın önceden mevcut mebrandan değil de direkt olarak lipidlerden
oluştuğu düşüncesi doğru değildir. Zarf partikülleri kademeli
olgunlaşmaktadır. Virüs genellikle konak hücre parçalanmasıyla
salınmaktadır, ancak bazıları membranlar yoluyla tomurcuklanarak
çıkabilir ( ekstra bir membrana sahip olduklarında). Her iki form da
enfeksiyonda görülmektedir. Virüs enfekte olmuş hücrelerden çıkış
mekanizması konakçı hücre tipine bağlı olarak değişebilir.
|
POKSVİRÜSLERİN AYIRICI
ÖZELLİKLERİ |
| Sitoplazmik |
| Geniş genom |
| Virüs kendisi için
çok şey yapar |
| Virüs, diğer
virüslere göre alışılmadık yeteneklere sahiptir |
|
|

 |
 Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
This page last changed
Tuesday, May 31, 2016
Page maintained by
Richard Hunt
|

 Şekil 1a DNA virüslerden Parvoviridae ailesinin Parvovirüs H-1 virionlar
Şekil 1a DNA virüslerden Parvoviridae ailesinin Parvovirüs H-1 virionlar  Şekil
1b Papilloma virus
Şekil
1b Papilloma virus  Şekil 2 SV40 virus, polyoma virus
Şekil 2 SV40 virus, polyoma virus Şekil 5
Şekil 5 Şekil 6
Şekil 6 Şekil 7a
Şekil 7a Şekil 11
Şekil 11 Şekil 14
Şekil 14 Figure
16 Expression of immediate early, early and late genes of herpesviruses
Figure
16 Expression of immediate early, early and late genes of herpesviruses Şekil 18A
Şekil 18A


 Şekil 20 çiçek hastalığı olan çocuk
Şekil 20 çiçek hastalığı olan çocuk Şekil 21
Şekil 21 Şekil 22
Şekil 22













