|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VİROLOJİ |
|
ENGLISH |
VIROLOJİ - BÖLÜM SEKİZ
AŞILAR: GEÇMİŞ BAŞARI VE GELECEKTEN BEKLENTİLER
Dr Richard Hunt
Professor
University of South Carolina School of Medicine
Çeviren. Prof. Dr.
Selçuk Kaya
İzmir Katip Çelebi Üniversitesi, Tıp Fakültesi
|
|
En
Español |
|
SHQIP - ALBANIAN |
|
|
Let us know what you think
FEEDBACK |
|
SEARCH |

 |
|
|
|
EK
AŞILAMANIN GİRİŞİNDEN SONRA BELLİ HASTALIKLARIN GÖRÜLME SIKLIĞINDA
AZALMA
Polio Virus
(From the Hogle Lab at Harvard, URL unknown)
Bu dosyanın çiçek kısmındaki çoğu resim- Fenner, Henderson, Arita et al.
Smallpox and its Eradication. 1988 Cenevre, Dünya Sağlık Örgütü ve Laura
Gregorio onun denemesinde The Smallpox Legacy, Pharos. Güz 1996
|
GİRİŞ
Aşı nedir? Aşılar
düşman olarak algılanan zararsız maddelerdir. Genellikle protein
olmamalarına rağmen, bağışık yanıt oluşturan, bu sayede potansiyel bir
patojene karşı koruyucu bağışıklık sağlayan moleküllerdir. Patojen, bir
bakteri ya da bir ökariyotik protozoon olabilir ancak en başarılı aşılar
viruslara karşı oluşturulan aşılardır. Burada antiviral aşılar ele
alınacaktır. Aşılar saflaştırılmış bir protein yada bir moleküler kompleks
içerebilir, hatta bir bakterinin veya virusun tamamından oluşabilir. Bir
virusa karşı bağışıklık oluşması, virusla enfekte hücre yüzeyindeki veya
virüs partiküllerinin kendi yüzeyindeki antijenlere karşı immun yanıtın
gelişmesine bağlıdır. İnternal antijenlere karşı immün yanıtlar immünitede
genellikle küçük rol oynar. Bu nedenle influenza pandemilerinde, antijenik
shift sonucu oluşan yeni yüzey glikoproteinine sahip yeni virüs suşuna karşı
toplumun bağışıklığı çok az ya da yoktur. Ancak yeni suş, bir önceki
influenza suşu ile aynı internal proteinleri içerebilir. Yüzey
glikoproteinleri genellikle koruyucu antijenler olarak adlandırılır. Bir
virusa karşı başarılı bir aşı oluşturabilmek için, geçen yılın ampirik
yaklaşımı takip edimedikçe bu yüzey antijenlerinin yapısı bilinmelidir.
Bununla birlikte, dikkat edilmesi gereken virüsle enfekte hücre internal
viral antijen parçacıklarını yüzeyinde sergiler ve bu parçacıklar enfekte
hücreye karşı sitotoksik T hücre yanıtını ortaya çıkarabilir. Bir virüs
yüzeyinde birden fazla yüzey glikoproteini olabilir ve bunlardan biri
koruyucu immün yanıtta diğerlerinden daha önemli olabilir; bu antijen
enfeksiyonu önleyecek makul bir aşı için belirlenmelidir. Örneğin, influenza
virusunun viral partüküllerinin yüzeyinde bir hemaglütinin ve bir
nöraminidaz vardır. Hemaglütinin nötralizan immüniteyi uyarır çünkü virusu
hücre yüzey reseptörlerine bağlayan protein yapıdadır. Nötralizan antikorlar
virusun hücre yüzeyine bağlanmasını engeller.
Virüsün hücreye bağlanmasını engellemenin yanında, diğer faktörler de
virüsların nötralizasyonunda önemli olabilir; örneğin, komplemanlar
antiviral antikorların opsonizasyonundan sonra zarflı virionları lize
edebilir.
Bu bölümde, başarılı anti-bakteriyel aşılar (bkz: burada) da olmasına rağmen
biz çoğunlukla antiviral aşıların anlattık.
|
|
WEB KAYNAKLARI
Common Misconceptions about Vaccination and how to respond to them |
Viral enfeksiyonun etki alanı
Başarılı bir aşı geliştirmek için viral enfeksiyonun belirli özellikleri
bilinmelidir. Bunlardan biri virüsün vücuda girdiği bölgedir. Üç önemli
bölge tanımlanabilir:
- Solunum yolu ve gastrointestinal sisteminin mukozal yüzeyleri
aracılı enfeksiyon:Bu gruptaki virüs aileleri şunlardır: rinovirüsler,
mixovirüsler, coronavirüsler; parainfluenzavirüsler; solunum sinsitiyal
virüsler; rotavirüsler
- Mukozal yüzeylerden kan ve/veya nöronlar aracılığıyla sistemik
yayılım ile hedef organlara ulaşan enfeksiyon
Bu gruptaki virüs aileleri şunlardır: picornavirusler, kızamık virüsü,
kabakulak virüsü, herpes simpleks virüs, su çiçeği virüsü, hepatit A ve
B virüsleri
- İğne batması veya böcek sokması sonrası hedef organlara yayılan
enfeksiyon:
Bu gruptaki virüs aileleri hepatit B virüs, alfavirüsler, flavivirüsler,
bunyavirüslerdir.
IgA-aracılı lokal bağışıklık ilk iki kategoride çok önemlidir. Virus
çoğaldığında dolaşımda iyi bir nötralizan humoral antikora sahip küçük
bir nokta vardır, örneğin, üst solunum yolunda. Burada salgılanan
antikorların önemi açıktır.
Böylece, bilmemiz gerekir:
- Nötralizan antikorları ortaya çıkaran, viral antijen (ler)
- Nötralizan antikorları ortaya çıkaran hücre yüzey antijeni
- Virüsün replikasyon alanı
|
| |
Aşı türleri
Bugün kullanımda dört tip aşı vardır.
- Ölü aşılar: Doğal (vahşi tip) enfeksiyöz formlardır. Patojenik bir
virüs patojenik olmayan hale getirilmektedir. Genellikle formalin gibi
viral proteinlerin çapraz bağlarını etkileyen kimyasallarla muamele
edilir.
- Zayıflatılmış aşılar: Aşılanan kişide çoğalan, canlı virus
partülülleridir ancak hastalığa neden olmazlar; çünkü aşı virüsü non-patojen
bir forma (mutant) değiştirilmiştir. Örneğin tropizmi değiştirilmiştir
böylece artık hastalığa neden olabilecek bir bölgede gelişmez.
- Subunit aşılar: Bunlar virüsün saplaştırılmış komponentleridir,
yüzey antijeni gibi.
- DNA aşıları: Bir koruyucu antijen (sözde) için bir gen eklenmiş olan
genellikle zararsız virüslerdir. Koruyucu antigen bağışık yanıt
oluşturmak için aşı alıcısına yapılır.
Aşı geliştirme sorunları
Iyi bir koruyucu antiviral aşı geliştirmenin özünde pek çok sorun vardır.
Bunlar arasında:
- Farklı tipte virüslerin benzer hastalıklara neden olabilmesi,
örneğin soğuk algınlığı. Sonuç olarak, böyle bir hastalığa karşı tek bir
aşı mümkün olmayacaktır.
- Antijenik drift ve shift - Bu özellikle parçalı genomlu RNA
virüsleri için geçerlidir.
- Büyük hayvan rezervuarları. İnsanlardan elimine edilseler bile
reenfeksiyon oluşturabilirler.
- Viral DNA'nın integrasyonu. Laten virionlar antijenlerini hücre
yüzeyine eksprese etmedikçe aşılar etkili olamaz. Buna ek olarak, aşı
virüsü alıcı hücre kromozomu içine entegre olursa sorunlara neden
olabilir (Örneğin, zayıflatılmış virüs suşu temelli anti-HIV aşısı
kullanımı bir sorun olabilir)
- Sinsitiyumlar ile hücreden hücreye geçiş –Virüs dolaşıma girmeden
hücreden hücreye yayılabileceğinden, bu potansiyel AİDS aşıları için bir
sorundur.
- Zayıflatılmış bir aşıdaki aşı virüsünün rekombinasyonu ve mutasyonu.
Bu sorunlara rağmen, anti-viral aşılar, bazı durumlarda, insanlardan bir
hastalığın (çiçek hastalığı) elimine edilmesinin yönetiminde olağanüstü
başarılı olmuştur. Çiçek aşısı her ne kadar orijinal patojenik çiçek virüsü
olsada, bir zayıflatılmış aşı örneğidir. Bir diğer başarılı aşı yakında
insan nüfusundan bu hastalığın eliminasyonunu sağlayabilecek olan çocuk
felci aşısıdır. Bu aşı iki formdadır. Albert Sabin tarafından geliştirilen
aşı, zayıflatılmış canlı bir aşı iken, Salk aşısı ölü aşıdır. Çocuk felci
günümüzde Afrika (Nijerya) ve Güney Asya (Pakistan ve Afganistan)’da
sınırlıdır.
Çiçek virusu sadece insanlarda hastalık oluşturmasına rağmen aşılama ile
eradike edilmiştir, hayvan hastalığı olarak da eradike edilmiş olması
muhtemeldir. Rinderpest (sığır veba veya steppe murrain) sığır ve diğer
geviş getiren hayvanlarda ateş, ishal ve lenfoid nekroza neden olan yüksek
mortalite nedeni bir viral hastalıktır. Etken, kızamık virusu ailesinin (Aile:
Paramyxoviridae; Cins:Morbillvirus) bir üyesidir ve zayıflatılmış canlı aşı
kullanılarak eradike edilmiştir. 2010 yılında, Gıda ve Tarım Örgütü dokuz
yıldır hiç sığır vebası tanısı olmadığını bildirdi. Bu anlamda
tarım-hayvancılıkta başarıyla eradike edilen tek hastalıktır.
|
 Şekil 1b
Şekil 1b
Mary Wortley Montague
The work of art depicted in this image
and the reproduction thereof are in the
public domain
worldwide. The reproduction is part of a
collection of reproductions compiled by The Yorck
Project. The compilation copyright is
held by
Zenodot Verlagsgesellschaft mbH
and licensed under the
GNU Free Documentation License. |
GEÇMİŞ BAŞARILAR
Çiçek (Variola)
Çiçek hastalığı çok bulaşıcı, tahrip edici ve yıkıcı bir hastalıktır.
Etken variola virüsdür (aynı zamanda çiçek virüsü olarak bilinir) ,
Orthopoxvirdae ailesinin bir üyesidir (Şekil 2A). Çiçek hastalığı
binlerce yıldır bilinmektedir ve muhtemelen Asya kökenlidir. Orta
doğu’dan batıya doğru yayılmıştır ve Firavun Ramses V kurbanları
arasındaydı(Şekil 2B). Hastalık Haçlılar ile Avrupa'ya ulaşmış olabilir.
Çiçek hastalığı Avrupalı sömürgeciler tarafından Yeni Dünya’ya
tanıtılmış ve doğal bağışıklığı olmayan yerli nüfusta yıkıcı salgınlara
neden olmuş. Nitekim bazı eski sömürgeciler tarafından Kuzey ve Güney
Amerikanın yerlilerine karşı çiçek virusu biyolojik silah olarak
kullanılmıştır. Çiçek hastalığı tüm vücutta enfeksiyöz virüs içeren
çok sayıda püstüller ile karakterizedir (Şekil 2, C ve D) . Ölüm oranı
Variola majorun etken olduğu en ağır formu ile enfekte hastalarda dörtte
birden fazladır. Bir diğer form olan Variola minor’de ölüm oranı çok
daha düşüktür (% 5). Çiçek hastalığını kontrol altına almak için ilk
girişimler 10. yüzyılda meydana gelmiş ve aşılama yapılmıştır (smallpox
virusu Variola olduğu için böyle adlandırıldı) . Aşılama için (Şekil
2E), materyal (yara kabuğu) bu hastalıktan ölmemiş enfekte bir kişinin
püstüllerinden elde edilmiştir. Bu kişi, doğal olarak ortaya çıkan bir
varyantın oluşturduğu çiçek hastalığının hafif bir formunu gecirmektedir.
Bu materyal genellikle başka bir kişiyi hastalığın hafif formunu
geçirmesi için enfekte etmede kullanıldı. Kişi ölmedi ise yaşam boyu
bağışıklık kazandı. Aşılamanın başarısında bir diğer neden, yara
kabuğundaki virusun virulansı daha azdı çünkü donörün antikorları ile
kompleks oluşturduğu ve inaktive olduğu için kısmen etkisi azaltılmıştı.
Çiçek aşısı uygulamasında ölüm oranı yaklaşık %1-2’dir ve hala tehlikeli
bir uygulamadır. Bu teknik Pakistan, Etiyopya ve Afganistan’da 1970'e
kadar kullanılmıştır.1700'lerde İngiltere'de yaygın olan çiçek aşısı
uygulaması Türkiye'ye İngiliz Büyükelçisi eşi Mary Wortley Montague
tarafından tanıtılmıştır. (Şekil 1b).
|
|
Şekil 2
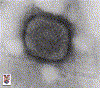
A. Smallpox virus
Copyright
1994 Veterinary Sciences
Division
Queen's University Belfast
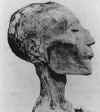 B. Ramses V (1157 M.Ö. öldü) mumyalanmış kafasındaki
döküntü muhtemelen smallpox sonucudur
B. Ramses V (1157 M.Ö. öldü) mumyalanmış kafasındaki
döküntü muhtemelen smallpox sonucudur
|
 C. Çiçekli bir çocuk
C. Çiçekli bir çocuk
 D. Deride Smallpox lezyonları. Fotoğraf Bangladeş’ten alınmıştır. CDC/James
Hicks
D. Deride Smallpox lezyonları. Fotoğraf Bangladeş’ten alınmıştır. CDC/James
Hicks
 E. Toz halinde smallpox kabuk yaraları Çin tıbbında çiçeğe karşı
korumak için inhale edildi
E. Toz halinde smallpox kabuk yaraları Çin tıbbında çiçeğe karşı
korumak için inhale edildi
|
| |
|
|
Şekil 3

A. Edward Jenner
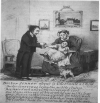 B. Dr Jenner bir çocuğu
aşılaması hakkında
B. Dr Jenner bir çocuğu
aşılaması hakkında |
 C.
İnek çiçeği C.
İnek çiçeği
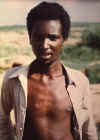 D. Dünyada bilinen en son doğal çiçek olgulu kişi. 23 yaşındaki Ali
Maow Maalin, Merca, Somali'de Variola minör
D. Dünyada bilinen en son doğal çiçek olgulu kişi. 23 yaşındaki Ali
Maow Maalin, Merca, Somali'de Variola minör
CDC
|
| |
Edward Jenner,
(şekil 3A) 1796’da, aşı denemeleri sırasında vaccinia virüsü, cowpox ajan (vacca,
Latince inek) kullanarak aşılamayı keşfetti.
Jenner İngiltere
batısındaki kırsalda, Gloucestershire’de yaşayan bir doktordur ve o zaman (örneğin
süçü gibi) sığır çiçeği almış insanlar çok daha öldürücü çiçeğe karşı
koruyucu bağışıklık kazandığı yaygın olarak biliniyordu. Jenner, Mr.Phipps (çalışanı)
ve oğlunu(şekil 3B) Blossom adı verilen bir sığırdan(şekil 3C) elde ettiği
cowpox virusu ile aşıladı ve virulan çiçek virusuna karşı bağışıklığını
sağladı. Aşılananların her ikisinde de neyse ki koruma sağlandı. Yakın
zamana kadar çiçek aşılamasında kullanılan aşı Jenner’in orijinal virüsu
değildi. Aşı virüsü cowpox veya horsepox virusundan rekombinant olarak da
elde edilebilir. Uzun bir süre için aşı virüsü atlardan ve bufalolardan
sağlanmıştır.
En son çiçek olgusu
İngiltere’ de 1930'da, ABD'de 1940 yılında ortaya çıktı. Dünyada son olgu
Somali'de Ekim 1977 (Şekil 3D) ortaya çıktı. Vahşi virüs elimine edilmiş
olmasına rağmen, İngiltere'de bir laboratuar kazası sonucu laboratuarda
tutulan virus ölümcül bir çiçek vakasına neden oldu. Dünya genelindeki
stokları Amerika Birleşik Devletleri ve Sovyetler Birliği laboratuarlarında
sınırlandırılmıştır. Enfeksiyöz virüsün Sovyetler Birliğinin dağılmasından
sonra Rusya laboratuarlarına dağıltılıp dağıtılmadığı bilinmemektedir.
Çiçek virusunun
eradikasyonu halk sağlığı için büyük başarılarından biri olmuştur. Bunun
birkaç nedeni vardır:
-
Variola için hiçbir
hayvan rezervuarı yoktur, sadece insanlar bu virüsle enfekte olur
-
Bir kişi virüs
tarafından enfekte olduktan sonra yaşam boyu bağışıklık sağlanır.
Bununla birlikte insanların aşı suşları kullanılarak immunizasyonunda
durum böyle değildir
-
Subklinik vakalar
nadirdir ve böylece enfekte bir kişi tespit edilebilir
-
Enfektivite açık
semptomlarla önceden kendini göstermez, prodromal faz yoktur
-
Sadece bir Variola
serotipi vardır ve böylece aşı tüm virüs suşlarına karşı etkilidir
-
Aşı oldukça etkilidir
-
Dünya Sağlık Örgütü
ve hükümetler tarafından çiçek virusu eradikasyonu programına büyük bir
bağlılık olmuştur.
|
 Şekil 4.
Şekil 4.
Louis Pasteur
 Şekil 5.
Şekil 5.
Rabies virus
|
Kuduz Jenner’in
öncülüğünde çiçek virusu üzerinde yapılan çalışmalardan neredeyse bir yüzyıl
sonra, 1885’te Louis Pasteur ve Emile Roux kuduza karşı ilk aşıyı
geliştirmiştir (şekil 5). Pasteur, kuduz olan ölü bir tavşanın spinal
kordundan alınan materyalin kuru bir ortamda (bir potasyum hidroksit içeren
şişede)15 gün bekletilip daha sonra bir köpeğe enjekte edilirse, köpeğin
ikinci bir kuduz virusu ile enfekte olmadığını keşfetmiştir. Kuru bir
ortamda muhafaza edilen omurilik dokusu ile gerçekleştirilen aynı prosedürü
daha az sürede (her biri iki günlük periyoda bölünmüş olan) gerçekleştirerek
bir protokol geliştirmiştir. Sonunda virulan virüs içeren spinal dokuyu
köpeklere enjekte etmiştir. Köpeklerin kuduza karşı bağışıklandığını
bulmuştur. Pasteur ard arda virulan virüs kullandığı bu protokol ile altmış
saat önce bir kuduz köpek tarafından ısırılan bir çocuğu (Joseph Meister)
başarıyla tedavi etmiştir. Aslında, Pasteure göre, son inoküle edilen kuduz
virusu, klasik köpek kuduzundan daha virulandı. Neyse ki, Meister ısırılmaya
ve virulan virüsa rağmen hayatta kalmıştı! Günümüzdeki anti-kuduz
aşılarını hazırlamada Pasteur’ün tekniği kullanılmamaktadır. İnsan Diploid
Hücre Aşısı (HDCV), insan WI-38 fibroblastlarının kullanıldığı doku
kültüründe yapılır. Kuduz virüsü, bir filtreden geçirilerek pasajlama ile
saflaştırılır ve beta-propiyolakton ile inaktive edilmektedir. Bu inaktive
virüs aşısı sadece özellikle gelişmiş ülkelerde kuduz pre- ve post-
aşılamada kullanılır. Saflaştırılmış Civciv Embriyo Aşısı (PCEC) da
saflaştırılmış virulan virüsdur. Bu aşı ultrasantrifüj ile elde edilir ve
beta-propiyolakton ile inaktive edilmektedir. HDCV’de on gün sonra yüksek
titrede nötralizan antikor oluşumu görülür. Doğru kullanıldığında,% 100
koruma sağlamaktadır. Civciv embriyolarında üretilen zayıflatılmış bir
canlı aşı (Flury suşu) mevcuttur ve sadece hayvanlarda kullanım içindir.
Bir rekombinant kuduz aşısı olan VRG yani Raboral, çiçek aşılamasında
kullanılan virus olan vaccinia virüsüne, kuduz virusunun yüzey
glikoproteiniyle ilgili genin yerleştirilmesiyle elde edilmiştir. Rekombine
virüs insanlar için güvenli gibi görünmektedir fakat vahşi hayvanların
tedavisi için kullanılmaktadır, (bir canlı virüs olduğu için) toplu immunite
sağlayabilir. Aşı virüsü yüksek sıcaklıklarda stabil olduğu için oral
verilebilir. Bu nedenle, gıda yemlerinde hayvanlara verilir. Raboral V-RG®,
Kuzey Amerika'da kuduzun en önemli yaban hayatı taşıyıcıları olan rakun ve
çakalların aşılanması için uygun bulunmuştur.
|
| |
|
|
|
Çocuk felci
Batı ülkelerinde, vahşi tip polio artık bir sorun değildir ancak
Nijerya, Pakistan ve Afganistan (şekiller 6) gibi bazı az gelişmiş
ülkelerde hala endemiktir. Bununla birlikte vahşi tip polio virüs
endojen yayılımın sonlandığı bazı ülkere importe olabilir ve bu
importasyonlardan salgınlar kaynaklanabilir. Birçok ülke bu tür
salgınlardan etkilenmeye devam etmektedir. Bu ülkelerin çoğu ‘’
vahşi poliovirus importasyon kuşağı’’ndadır (Batı Afrika’dan orta
Afrika’ya uzanan bir çok ülke).
Polio aşısının rutin uygulanmaya başladığı 1950’li yıllara
kadar, yazları yüzme havuzlarından fekal-oral yayılım nedeniyle
çocuk felci salgınları batı ülkelerinde yaygındı. Bu salgınlar
yaygın paralitik polio’ya yol açmıştır. Bu durum ‘demir
akciğerler’ in kullanımını ve nefes almada yardımı
gerektirmiştir (Şekil 7).
Anti-polio aşıları
İki tip polio aşısı vardır. ikisi de 1950’lerde geliştirilmiştir.
Jonas Salk tarafından geliştirilen ilk aşı, formalin ile
öldürülen normal vahşi tip polio virustur. Bu virüs maymun
böbrek hücrelerinde üretilir ve enjeksiyonla verilir. İyi
humoral (IgG) bağışıklık ortaya çıkarır ve virusun nöronlara
transportunu önler. Bazı İskandinav ülkelerinde sadece bu aşı
ile hastalık tamamen yok edilmiştir. İkinci aşı Albert Sabin
tarafından geliştirilmiştir. Bu aşı, hücre kültüründe virusun
seri pasajlarıyla deneysel olarak üretilen zayıflatılmış canlı
bir aşıdır. Bu durum, kültürde iyi üreyen, gerçekten de insan
barsaklarında üreyen mutant virusun seçilmesiyle sonuçlanır.
Bununla birlikte, nöronlara ulaşamaz. Virus aslında aşılanan
kişide üremeye devam ettiğinden normal bir enfeksiyonu taklit
eder ve hem humoral hem de hücre aracılı immüniteyi uyarır.
Virus normal bir enfeksiyonda insandan insana fekal-oral yolla
alındığından, aşı oral yolla verilir. Bu aşı, uygulama kolaylığı,
gerçekte aşı virusunun barsaklarda çoğalması ve sadece tek
uygulamada iyi bağışıklık oluşturması (genellikle tekrarlanan
uygulama kullanılsa da) nedeniyle ABD, İngiltere ve birçok
ülkede tercih edilen aşı olmuştur. Buna ek olarak Sabin aşısında
elde edilen immünite Salk aşısına göre çok daha uzun sürelidir,
birkaç hatırlatma dozu uygulaması gereklidir. Barsaklarda
mukozal immüniteyi uyardığından, Sabin aşısı vahşi tip virusu
eradike etme potansiyeline sahiptir (Şekil 10). Oysa Salk aşısı,
sadece vahşi tip virusun nöronlara geçişini önler.
Zayıflatılmış Sabin aşısı aynı zamanda bir problemle karşı
karşıya gelmiştir: back mutasyon. Bu durum vahşi tip virüs ve
aşı suşu arasındaki rekombinasyonun sonucu olabilir. Virulan
virüs Sabin aşısının alıcılarından sıklıkla izole edilir.
Zayıflatılmış canlı virüs aşısının kullanıldığı ülkelerdeki son
vakalarda (Günümüze kadar ABD’de yıllık yaklaşık 8 olgu. Şekil
9a,b ve c ) aşı suşunun mutasyonu virulans ile sonuçlanmıştır.
Bu vakaların yaklaşık olarak yarısı aşılanan yarısı da aşılı
kişilerle temas edenlerdir. Paralitik polio vahşi tip virus ile
enfekte 100 vakadan birinde görülür. 2.4 milyonda bir ilk
aşılamada aşının vahşi tip virüse geri dönüşümü sonucu paralitik
polio görülebilir. Zayıflatılmış virus ile aşılama, virusun
halen vücutta replike olduğu anlamına geldiğinden ve bunun IgA
aracılı immünite sağladığından bu durum kabul edilebilir
varsayılmıştır. Ölü Salk aşısı yapılsa bile kişinin
gastrointestinal sisteminde vahşi tip virüsün çoğalması
mümkündür çünkü ölü aşı enjekte edildiğinde oluşan major immün
yanıt dolaşımdaki IgG’dir(şekil10). Yukarıda bahsedildiği gibi
virüsün aşı yapılan kişinin bağırsağında çoğalabilmesine rağmen
bu aşı çocuk felcine karşı koruyucudur. Virüs, polio
semptomlarının oluştuğu sinir sistemine ulaşmaz. Bu nedenle,
vahşi tip virüsün sadece ölü aşı yapılan topluluklarda,
insanların dışkılarından atıldığı için yok olması mümkün
değildir. Hollanda ‘da 1992 yılındaki polio salgınında (aşıyı
reddeden insanlar arasında), toplumda vahşi tip virüsün
dolaşmasını Salk aşısının oluşturduğu immünitenin önlediği
gösterilmiştir. Canlı zayıflatılmış aşı kullanmanın getirdiği
diğer bir problem; preperatların virüsün geliştirildiği hücre
üzerindeki diğer patojenleri içermesidir. Bu başlangıçta ciddi
bir problemdi çünkü polio aşısının üretiminde kullanılan maymun
hücreleri simian virus 40 (SV40) ile enfekteydi ve muhtemelen
aşının da içindeydi. SV40 bir polyoma virüstür ve kansere neden
olma potansiyeli taşır. Fakat bu durum bu aşıyı yanlışlıkla
alanlarda bir sorun yaratmamıştır. Afrika ‘da kullanılan orjinal
zayıflatılmış canlı polio aşısının HIV virusu ile enfekte
olduğuna dair bazı iddialar ortaya atılmıştır ama böyle bir
durum olmadığı saptanmıştır. Eğer ölü aşı da uygun olmayan bir
şekilde inaktive edilmişse, benzer sorunlar olabilir.
Polio aşıları hakkında güncel öneriler
Bir dönem ABD’de polio vakaları sadece aşıyla ilişkili idi.
Sadece Sabin aşısının kullanıldığı eski politikalar
değerlendirildi. Öncelikle her iki aşı da önerildi. İlk olarak
ölü aşı, daha sonra zayıflatılmış aşı uygulaması önerildi. Ölü
aşı mutasyon gösteren canlı aşının sinir sistemine invazyonunu
önleyebilirdi. Bu nedenle, 1997 yılında aşağıdaki protokol
önerildi:
Aşı ilişkili olguların azaltılması için (yıllık 8-10 olgu),
CDC Bağışıklama Uygulamaları Danışma Komitesi (ACIP) 2. ve
4. aylarda inaktif ölü aşıyı takiben 12-18. ayda ve 4-6.
yaşta oral canlı aşı uygulamasını önermiştir. Şu anda
ağızdan aşının dört dozu genellikle yaşamın ilk iki yıl
içinde uygulanır. Yeni aşı programının aşı ile ilişkili
olguların çoğunu elimine ettiği düşünülmektedir. Bu rejim
birçok Avrupa ülkesinde ve Kanada’nın belli bölgelerinde
uygulanmaktadır.
2000 yılında polio aşı programı yeniden düzenlendi:
Aşı ilişkili paralitik poliyomiyelit riskini yok etmek
için ACIP, ABD’de çocukluk çağı rutin polio virus aşılama
programı için tam IPV programını önerdi.1 Ocak 2000 tarihi
itibariyle bütün çocuklar IPV ile 2. ay, 4.ay,6-18. ay ve
4-6.yaş toplam dört doz aşılanmalıdır.
|
|
VAKA RAPORU
Poliovirus Infections in Four
Unvaccinated Children --- Minnesota, August--October 2005 |
Şekil 6
Polio istatistikleri
dünyadaki insidansın karşılaştırılması 1988, 1998, 2004 ve 2013
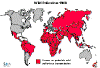 Polio - 1988 WHO
Polio - 1988 WHO
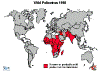 Polio - 1998 WHO
Polio - 1998 WHO
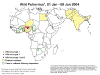 Polio - 2004
Polio - 2004
WHO
 Polio - 2013
Polio - 2013
polioeradication.org |
|
Şekil 7 (sağ) - Poliomyelit
|
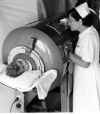 A. Demir akciğerde bir çocuk
A. Demir akciğerde bir çocuk
WHO
 B. Demir akciğer koğuşu
B. Demir akciğer koğuşu
 C. Polio sekelli bir çocuk
C. Polio sekelli bir çocuk
WHO
 D. Polio sekelli bir çocuk
D. Polio sekelli bir çocuk
WHO
 E. Polio kurbanları
E. Polio kurbanları
WHO
|
| |
|
 Şekil 8
Şekil 8
Jonas Salk tarafından geliştirilen ölü aşı kullanımı ile İsveç ve
Finlandiya (1950-1976) 'de toplam vaka raporları. Salk aşısı enjekte
edilir
|
 Şekil 9a
Şekil 9a
Başlangıçta ölü Salk aşısı kullanılan Amerika Birleşik Devletleri,
1951-1992, paralitik poliomyelit olgusu (100.000 nüfus başına olgu)
bildirilmiştir. Bu sonradan Albert Sabin tarafından geliştirilen canlı
zayıflatılmış ağızdan aşı ile değiştirildi. Sabin aşısı yutulur.
Genellikle şeker parçasıyla verilmiştir
 Şekil 9b
Şekil 9b
Poliomyelit, ABD’de 1980-1995
CDC
 Şekil
9c Şekil
9c
Aşı ile ilişkili paralitik polio - VAPP ABD’de 1964-1995
CDC
 Şekil 10
Şekil 10
Kas içi enjeksiyonla uygulanan ölü çocuk felci aşısına (solda) ve
ağızdan zayıflatılmış canlı çocuk felci aşısı (sağda) cevap olarak
salgısal antikor (burun ve bağırsak IgA) ve serum antikor (serum IgG,
IgM ve IgA)
|
| |
| |
Rotavirüs hastalığı: Başta
problem sonra başarı
Rotavirüsler dünyanın her yerinde görülür, büyük ölçüde
gastroenterite, diyare nedeniyle hastaneye yatışlara ve her yıl yarım
milyondan fazla 5 yaş altı çocuğun ölümüne neden olur. Dünya Sağlık
örgütüne göre 2008 yılında 5 ülkede (Hindistan, Nijerya, Kongo, Etiyopya
ve Pakistan) rotavirüs hastalıklarının yarısından fazlası, 5 yaş altı
çocukların ölümüne sebep olmuştur. Şu semptomlar görülür: ateş, kusma,
diyare ve karın ağrısı. Seroprevalans çalışmaları 3 yaşına kadar olan
bebeklerde antikorun bulundğunu göstermiştir.
2006 da ABD’deki yaygın aşılama girişimi öncesinde, yılda 3 milyonun
üstünde rotavirüs enfksiyonu vakası vardı. Bunların %1–2,5 ‘inde
şiddetli dehidratasyon mevcuttu. Bu durum her yıl beş yaş altı 20–60
çocuğun ölümüyle sonuçlandı. Bununla birlikte yılda 50.000-70.000
hastanede yatış ve 500.000 in üstünde de doktora başvuru vardı.
Aşılama başladığından beri rotavirüs nedeniyle hastaneye yatışlar yılda
%86 ya düştü. Aşılamanın ayrıca aşılanmamış bebekleri de enfeksiyon
oluşmasına karşı koruduğu olasıdır. Bu da ölüm oranının düşmesine işaret
eder. 2008’de ABD de tahmini olarak rotavirüs hastalığının neden olduğu
14 ölüm bildirildi ve İngiltere’de Hindistan’la karşılaştırıldığında
98.621 e karşı 10’dan daha az hasta bildirildi.
Rotashield ve intususepsiyon
Reassortant aşıları, yüzeyinde insan rotavirüslerinin antijenleri
bulunan insanda hastalık oluşturmayan rotavirüs suşlarını içeren
genetik reassortment tarafından oluşturulmuştur. Non-human suşlar
çoğalır ancak hastalığa neden olmazlar ve bunlar insanlarda düşük
derecede patojendir. Canlı, tetravalent maymun-insan reassortant
aşısı (Rotashield Wyeth laboratuarları) ilk defa infantlarda
kullanılmak üzere Ağustos 1998’de lisans almıştır. Bu aşı insan G
tipi 1,2, 4 ve simian G tipi 3 içeriyordu fakat lisans sonrası
izlemde aşı yapıldıktan 3 ila 20 gün sonra, özellikle ilk doz
sonrası (1.5 milyon vakada 15 doz tespit edildi) intusepsiyonun
varlığıyla arasında olası bir ilişki olduğu görüldü. İntususepsiyon,
bağırsağın kendi üzerine katlanması veya düşen kan basıncı sonucu
görülen iç içe geçmesi sonucu oluşan, nadiren görülen bağırsak
darlığıdır. Bu olay çocuklar arasında daha yaygın görülür.
İntusepsiyonun bağırsakta en sık rastlandığı yer ince bağırsağın
kolona bağlandığı yerdir. Aynı zamanda intususepsiyon bağırsağın
birçok bölgesinde meydana gelebilir. Hızlı bir tedaviyle neredeyse
tüm hastalar tamamıyla iyileşme gösterir. Ayrıca erkeklerde kızlara
nazaran daha fazla rastlanır.
Ekim 1999’da yapılan çalışmalar aşı ve intususepsiyon arasındaki
bağlantıyı onayladığında, Rotashield aşısının kullanımı önce askıya
alındı ve daha sonra piyasadan kaldırıldı.
RotaTeq
Canlı oral aşı olan RotaTeq (Merck) 2006 yılında ABD’de lisans
almıştır. Bu aşının içeriğinde 5 reosartant vardır (G1-4ün yüzey
proteinlerini içeren WC3 bovin rotavirüs suşu ile ve P1A insan
serotipleri) Rotateq içinde koruyucu ve thimerosal barındırmaz. 2,4
ve 6 aylıkken 3 doz verilir ve ilk doz en erken 6.haftada yapılır.
12 haftadan sonra başlatılmamalıdır. RotaTEq aşısının etkinliği
yüksektir. Aşının ilk yılı içinde ciddi gastroenteritlerde %98
azalma ve hastaneye yatışlarda %96 azalma sağlar. Aynı zamanda aşı
yapıldıktan sonra ilk ve ikinci yılda rotaavirüs
gastroenteritlerinde sırasıyla %74 ve %71’lik bir düşüş olmuştur.
Rotarix
Rotarix (Glaxo Smith Klein) G1P[8] spesifik rotavirüs suşunu içeren
insan zayıflatılmış rotavirüs aşısıdır. Bebeklere ve çocuklara iki
dozluk seri olarak,G1 ve non-G1tipler (G3,G4 ve G9) tarafından
ortaya çıkarılan rotavirüs gastroenteritini engellemek için
kullanılır.
Bu aşıların her ikisi de enfeksiyöz gastroenterit ve ishalleri
önlemede çok etkilidir (%85- %98). CDC bebeklerin iki aşıdan biriyle
rutin bir şekilde aşılanmasını önermektedir. Her iki aşı da oral
uygulanır.
- RotaTeq® (RV5). Bu aşı 2., 4. ve 6. aylarda 3 doz olarak
verilir.
- Rotarix® (RV1). Bu aşı 2.ay ve 4.ayda 2 doz olarak verilir.
|
| |
DİĞER ANTI-VIRAL AŞILAR
Yaygın olarak kullanılan anti-viral aşılar aşağıda listelenmiştir.
|
TABLO 1
Şuanda yaygın kullanılan anti-viral aşılar
|
|
Virus |
Aşı Tipi |
Mikrografi
|
CDC Bağlantısı |
|
Polio (Salk) |
Inaktif |
 Poliovirus tip 1’in Transmisyon elektron mikrografisi .
Poliovirus tip 1’in Transmisyon elektron mikrografisi .
CDC/Dr. Joseph J. Esposito jje1@cdc.gov |
Updated Recommendations of the Advisory Committee on Immunization Practices (ACIP)
Regarding Routine Poliovirus Vaccination (2009) Rutin
Poliovirüs Aşılamasına İlişkin Bağışıklama Uygulamaları Danışma Komitesi (ACIP)
güncelleştirilmiş Önerileri (2009)
|
|
Polio (Sabin) |
Zayıflatılmış |
|
Kuduz |
Şuan insan aşısı inaktif. Hayvanlar için zayıflatılmış
aşı var. |
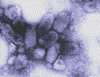
Rabies Virus
New York State Department of Health |
ACIP Recommendations
Use of a Reduced (4-Dose) Vaccine Schedule for Postexposure Prophylaxis to
Prevent Human Rabies (2008) ACIP öneriler
İnsan kuduzunu önlemek için maruz kalma sonrası Profilaksi için azaltılmış
(4-Doz) Aşı Takvimi kullanımı (2008)
|
|
Kabakulak |
Zayıflatılmış |
Mumps Virus
CDC PHIL |
Use of Combination Measles, Mumps, Rubella, and Varicella Vaccine
Recommendations of the Advisory Committee on Immunization Practices (ACIP) |
|
Kızamık |
Zayıflatılmış |

Measles Virus
CDC PHIL |
|
Kızamıkçık |
Zayıflatılmış |
Rubella virus
CDC PHIL |
|
Influenza |
Inaktif |
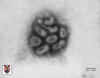
Influenza virus
Copyright 1994 Veterinary Sciences Division
Queen's University Belfast |
CDC
Vaccine Information
Prevention and Control of Influenza with Vaccines: Recommendations of the
Advisory Committee on Immunization Practices (ACIP), 2011
CDC Aşı Bilgisi
Aşı ile İnfluenza'yı Önleme ve Kontrolü: Bağışıklama Uygulamaları Danışma
Komitesi önerileri (ACIP), 2011
|
|
Hepatitis A |
Inaktif |
|
Prevention
of Hepatitis A Through Active or Passive Immunization.
Recommendations of the Advisory Committee on Immunization Practices (ACIP),
2006Aktif veya pasif bağışıklama yoluyla
Hepatit A önlenmesi.
Bağışıklama Uygulamaları Danışma Komitesi önerileri (ACIP), 2006
|
|
Hepatitis B |
Subunit |
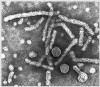
Hepatitis B Virus
Copyright Dr Linda M Stannard, University of Cape Town, South Africa, 1995. |
Hepatitis B
Vaccine Recommendations (2005, 2006, and 2011)
Part 1 - Infants, Children, & Adolescents
Part 2 - Adults
Hepatit B Aşı Önerileri (2005, 2006, ve 2011)
Kısım 1 - Infantlar, çocuklar, & Adolesan
Kısım 2 - Yetişkinler
|
|
Varicella |
Zayıflatılmış |

Varicella Virus
John Curtin School of Medical Research
Australian National University
Canberra,
Australia.
Micrograph:
Dr Frank Fenner |
Prevention of Varicella
Recommendations of the Advisory Committee on Immunization Practices (ACIP), 2007
Varicella Önlenmesi Bağışıklama Uygulamaları Danışma Komitesi
önerileri (ACIP), 2007
|
|
Rotavirus |
Zayıflatılmış |

Rotavirus
Copyright 1994 Veterinary Sciences Division , Queen's
University, Belfast |
Prevention of Rotavirus Gastroenteritis Among Infants and
Children Recommendations of the Advisory Committee on Immunization Practices
(ACIP), 2009
Rotavirus and Intussusception
Rotavirusun Önlenmesi Infant ve çocuklarda Gastroenterit
Bağışıklama Uygulamaları Danışma Komitesi önerileri (ACIP), 2009
Rotavirusve Intususepsiyon
|
|
Sarı Ateş |
Zayıflatılmış |
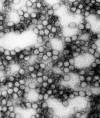
Yellow fever virus
CDC PHIL |
Yellow Fever Vaccine
Recommendations of the Advisory Committee on Immunization Practices (ACIP),
2010Sarı Ateş Aşısı
Bağışıklama Uygulamaları Danışma Komitesi önerileri (ACIP), 2010
|
|
İnsan Papilloma |
Subunit |
|
Quadrivalent Human Papillomavirus Vaccine
Recommendations of the Advisory Committee on Immunization Practices (ACIP),
2007Quadrivalan İnsan Papillomavirus Aşısı
Bağışıklama Uygulamaları Danışma Komitesi önerileri (ACIP), 2007
|
|
Japon Ensefaliti |
Inaktif |
|
Japanese Encephalitis Vaccines
Recommendations of the Advisory Committee on Immunization Practices (ACIP),
2010Japon Ensefalit Aşısı
Bağışıklama Uygulamaları Danışma Komitesi önerileri (ACIP), 2010
|
Varicella
|
Zayıflatılmış |
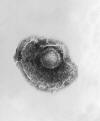
Varicella (Chickenpox) Virus
CDC PHIL |
Prevention of Varicella.
Recommendations of the Advisory Committee on Immunization Practices (ACIP),
2007Varicelladan Kounma.
Bağışıklama Uygulamaları Danışma Komitesi önerileri (ACIP), 2007
|
|
Herpes Zoster |
Zayıflatılmış |
|
Prevention of Herpes Zoster.
Recommendations of the Advisory Committee on Immunization Practices (ACIP),
2008
Herpes Zoster’den Korunma.
Bağışıklama Uygulamaları Danışma Komitesi önerileri (ACIP), 2008
|
Anti-HIV (AIDS) aşıları için daha fazla bilgi
burada
|
|
|
|
| |
ÖLÜ AŞILARA KARŞI ZAYIFLATILMIŞ AŞILAR
Zayıflatılmış aşılar
Zayıflatma genellikle virüsün, embiryonlu yumurta veya doku
hücre kültürleri gibi yabancı konağa pasajı ile meydana getirilir. Toplumda
var olan birçok mutant virüs arasından (özellikle RNA virüslerinde) yabancı
konakta yaşamaya daha egilimi olanlar (daha yüksek virulanslı)
seçileceklerdir. Bunlar orijinal konak için daha az virulanslı olmaya
eğilimlidirler. Sabin aşısını üretmek için zayıflatma sadece primer maymun
böbrek hücrelerinde yüksek dozda ekim ve hızlı pasaj yoluyla başarılmıştır.
Santral sinir sisteminde üremeyen, böbrek dokusunda iyi üreyen, daha az
virulan olan (insanlar için) virüs popülasyonu çoğalmış olur. Aşı için üç
polio tipinin non-virulan suşları üretildi.
Zayıflatmanın
moleküler temeli
Zayıflatma deneysel olarak gerçekleştirildiğinden çoğu
vakada zayıflatmanın temelini bilmiyoruz. Deneysel yabancı hücre pasajı
metodu bir virüste çok fazla mutasyona sebep olur ve bunların hangilerinin
önemli mutasyonlar olduğuna karar vermek zordur. Zayıflatılmış aşı
virüslerinin çoğu ısıya karşı hassas (böylece 32-35 derecede 37 derece
olduğundan daha iyi ürerler) ya da soğuğa dayanılklı (25 dereceye kadar olan
sıcaklıkta üreyebilirler). Zayıflatılmış polio virus tip 1 aşı suşunda,
genomlarda 21 aminoasitte değişiklikle sonuçlanan 57 nükleotid değişikliği
vardır. Mutasyonların üçte biri VP1 genindedir(bu gen, genomların sadece
%12’sidir). Bu durumda zayıflatma, virüsün yüzey proteinlerindeki değişiklik
sonucu oluşur.
İnfluenza için zayıflatılmış bir nazal aşı (FluMist®)
geliştirilmiştir. Bu aşı, sıcaklığın kademeli olarak azaldığı doku
kültüründe üretilen influenza virüsünün soğuğa adapte suşunu içerir. Çoklu
pasajlarından sonra, virus 25 derece civarı sıcaklıklarda iyi ürer ve in
vivo üremeleri üst solunum yolu ile sınırlıdır. İntranazal influenza aşısı
yapılan deneklerin sadece %7’sinde influenzanın hastalık oluşturduğu
çalışmalarda gösterilmiştir, buna karşın inaktif trivalan influenza aşısı
yapılanlarda %13, plasebo grubunda %45 hastalık oluştuğu gösterilmiştir. İki
aşı plasebo ile karşılaştırıldığında istatistiksel olarak anlamlı
bulunmuştur.
|
| |
Zayıflatılmış aşıların
avantajları
-
İmmün sistemin tüm aşamalarını aktive ederler. IgG ve
lokal IgA salınımına neden olurlar
-
Antijenlere karşı koruyucu immün yanıtı güçlendirirler.
İnaktivasyon Salk aşısındaki formaldehit ile olduğu gibi antijenitesini
değiştirebilir
-
Daha sağlam bir bağışıklık sistemi oluşturur ve daha
fazla çapraz reaksiyon sağlar. Böylece vahşi tip virüsler tarafından
oluşturulanlara benzer multiple epitoplara karşı antikorları uyarırlar
-
Üretim maliyeti düşüktür
-
Aşılananların çoğunda bağışıklık sağlarlar
-
Çoğu vakada( örn:polio ve adenovirus aşıları) yönetimi
kolaydır
-
Birçok alanda taşınmaları kolaydır
-
Toplumdaki vahşi tip virüslerin yok edilmesine öncülük
ederler
Zayıflatılmış aşıların dezavantajları
-
Mutasyon. Virulansa dönüşümüne neden olabilir (bu en
önemli dezavantaj)
-
Aşılı kişilerin temasıyla aşılanmak istemeyen kimselere
yayılımı (Aşılamanın %100 olmadığı ülkelerde bu bir avantaj olabilir)
-
Aşı virusunun dağılımı standardize değildir ve mutasyona
uğramış olabilir
-
Bazen tropik alanlarda zayıf kalırlar
-
Canlı virüsler immun yetmezlikli hastalar için bir
problemdir.
|
| |
İnaktif aşıların
avantajları
-
Eğer güçlendirilerek verilirlerse, yeterli humoral
bağışıklık sağlarlar
-
Mutasyon veya reversiyon yoktur.(Bu büyük bir
avantajdır)
-
İmmun yetmezliği bulunan hastalarda kullanılabilirler
-
Bazen tropik alanlarda daha iyi sonuç verirler
İnaktif aşıların dezavantajları
-
Aşılananların bazılarında bağışıklık oluşmaz
-
Güçlendiricilere gerek duyulması eğilimindedir
-
Çok az mukozal/bölgesel bağışıklık sağlar(IgA) Bu çok
önemlidir (Şekil 8)
-
Daha yüksek maliyetli
-
Polioda, maymunların bir eksikliği vardır.
|
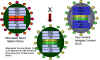 Şekil 11 Zayıflatılmış İnfluenza aşı suşu bir soğuk duyarlı mutant
kullanarak yeni virulan suşları ile reassorte edilebilir
Şekil 11 Zayıflatılmış İnfluenza aşı suşu bir soğuk duyarlı mutant
kullanarak yeni virulan suşları ile reassorte edilebilir |
AŞI ÜRETİMİNDE YENİ METODLAR
Duyarsızlık seçimi
Şartlı ölümcül mutasyonlar. İnfluenza A ve RVS’deki ısı duyarlı mutantlar
5-flourasil’deki mutasyon sonucu oluşmuştur ve sonra ısıya duyarlılık için
seçilir. İnfluenza vakalarında, ısı-duyarlı gen, zayıfatılmış suşun iç
proteinleri ve toplumda dolaşan suşun yüzeyi ile bir virüs suşu geliştirmek
için laboratuvarda reassorte edilebilir. Soğuğa adapte mutasyonlar da bu
yoldan üretilebilirler. Yüzey proteini olmayan tüm altı gen içinden mis-sense
mutasyonların elde edilmesi mümkündür.
FluMist olarak adlandırılan zayıflatılmış influenza aşısında, görülen her
yeni virulan influenza suşuyla birleştirilebilen soğuğa duyarlı bir mutant
kullanılır (şekil 11). Reassorted virüs zayıflatılmış virustan internal
proteinler için genleri alacaktır ancak yeni virulan antijenik varyantın
yüzey proteinlerini sergileyecektir. Çünkü canlı zayıflatılmış virüs
temeline dayanır, aşının her yılın yeni grip varyantlarına göre
özelleştirilmesi, bir sonraki grip sezonunda hangi influenza suşunu daha
önemli olacak ve ölü aşıda bunlar nasıl kombine edilecek diye tahmin
yürütmekten çok daha hızlıdır.
|
| |
Sentetik peptidler
Orijinal virüs proteinlerinden daha küçük olan enjekte edillen
peptitler IgG yanıtı oluşturur ancak burada zayıf antijenite
problemi karşımıza çıkar. Bu sebeptendir ki epitopun virüsün tüm
yapısına bağlanıyor olabilir. Viral olmayan bir örnek antimalaryal
aşı prototipidir. Sınırlı başarı elde edilmiştir.
|


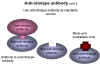 Şekil 12 Anti-idiotip antikorlar
Şekil 12 Anti-idiotip antikorlar |
Anti-idiotip aşılar
Bir antikordaki antijenin bağlandığı alan, antijenin parçasının yani
özel bir epitopun üç boyutlu yapısının bir yansımasıdır. Antikordaki
bu tek amino asit yapısı idyotip olarak bilinir. İdyotip antijendeki
epitopun yansıması olarak düşünülebilir. Antikorun bir başka hayvana
enjekte edilmesiyle, idyotipe karşı antikorlar (anti-id’ler)
çoğaltılabilir. Bu bize anti-idyotip antikoru verir, böylelikle
antijenin üç boyutlu yapısının parçası yani epitop kopyası elde
edilir (şekil 12). Bu aşı olarak kullanılabilir. Anti-idyotip
antikor bir kişiye enjekte edildiğinde antikorlar (anti-anti-idyotip
antikorlar) virüsün parçasına benzer bir yapıyı tanıyan ve virüsü
nötralize edebilir. Hepatit B S antijenine karşı anti-viral
antikorların oluşumu, antikorlara karşı anti-id’lerin çoğalmasıdır.
|
| |
Rekombinan DNA teknikleri
Virusun zayıflatılması
Geri dönüşü olmayan, yeterince geniş, delesyon mutasyonları yapılabilir.
(mutasyonun süpresyonu bir problem olarak kalsa bile. Potansiyel
anti-HIV aşısı olarak geliştirilen Nef delesyon mutasyonlarının
bazılarında görülmüştür.) bazı aşılarda bu yaklaşımla ilgili bir başka
problem virüsün onkojenite gibi diğer istenmeyen özelliklerini halen
kaybetmemesidir (örneğin; adenovirüs, herpes virüs, HIV)
Tek gen yaklaşımı (genellikle
virüsün yüzey glikoproteini)
Tek bir gen (koruyucu bir antijen için) yabancı bir konakta
tanımlanabilir. Tanımlayıcı vektörler aşı olarak kullanılacak çok sayıda
antijen oluşturmak için kullanılır. Gen, konak hücrede tanımlanabilir.
Posttranslasyonel sürecin sınırlılığı sorun olmasına rağmen.
fermantasyon yapan bakteriden protein saflaştırılır. Aşı için çok sayıda
antijen elde etmek için maya iyi bir seçimdir. Golgi aygıtlarında
memelilerdekine daha benzer bir tutum içinde glikoprotein üretirler.
Mayadan saflaştırılan ve ekspresse edilen viral proteini içeren aşıya
örnek Gardasildir. Günümüzde kullanılan hepatit B aşısı da bu tiptedir.
Servikal kanseri önlemede çok etkili olan bir anti-human papilloma virus
aşısıdır. Benzer bir anti-human papilloma virus aşısı, Cervarix, bir
böcek virüsü olan bacculovirus içinde böcek hücrelerinde rekombine viral
genlerin ekspresyonuyla oluşturulur.
Bu aşılar ölü bir
aşının pek çok dezavantajına sahiptir. Bu yaklaşım pek çok potansiyel
HIV aşısı elde etmek için kullanılmıştır fakat bunlar hücre aracılı
bağışıklığı küçük oranda da olsa olumsuz yönde etkilemiştir.
Bir genin bir başka virüse klonlanması
Zararlı bir başka virüse koruyucu antijen geninin klonlanmasıyla,
orijinal virüsün oluşturduğu kadar antijen oluşturabiliriz. Ek olarak
hücreler enfekte olur, hücre aracılı immünite sağlar. Bu durumda
Vaccinia (çiçek aşısı virüsü) insanlarda hastalık oluşturmadan yaygın
olarak kullanıldığından iyi bir adaydır. Bu yolla vaccinianın kabul
edeceği birkaç yabancı gen içeren multivalan aşı suşu elde edebiliriz.
Bir HIV aşısı adayı üzerinde pek çok klinik çalışma yapılmıştır. Buna
rağmen çiçek virusuna karşı aşının kullanımı immün-compromize hastalarda
nadir de olsa ciddi komplikasyonlar görülmüştür. Bu yüzden alternatif
aşılar geliştirme yoluna gidilmiştir. Bunlardan biri insan vücudunda
çoğalmayan fakat hücreleri enfekte eden rekombinant kanarya pox
virüsüdür. HIV virusu zarf geninin tanımlandığı canlı rekombinant
kanarya pox virusu vektörü ile immünizasyon HIV-1 virusu zarfına
spesifik CTL yanıtını uyarır. Benzer şekilde gag, proteaz, nef ve pol
genleriyle oluşturulanlar klinik çalışmalarda kullanılmaktadır fakat
şimdiye kadar hiçbir klinik etkinlik gösterilememiştir.
|
| |
DNA AŞILARI
Üçüncü Aşı Devrimi
Bu aşılar, kişiye bir DNA plazmidinin verilmesi temeline
dayanmaktadır. Plazmid, çok düşük etkinlikte hücre içine taşınan ve
bağışıklık cevabına neden olan bir antijeni tanımlayan bir protein kodu olan
gen taşır. Bunlar genellikle DNA aşıları olarak adlandırılır fakat DNA-aracılı
ya da DNA bazlı aşı demek daha doğrudur. Amaç DNA moleküllerinin kendilerine
karşı antikor oluşturmak değil, aşılanan kişinin hücreleri tarafından
tanımlanan proteini elde etmektir. Plazmid intramusküler verildiğinde
genellikle kas hücrelerinde bu olay gerçekleşir. Aşılanan kişinin
hücrelerinde plazmitin çoğalmadığına sadece proteinin üretildiğine dikkat
edilmelidir.
Ayrıca altın partikülleriyle kaplı DNA ile cilde bombardman
yoluyla DNA’nın dokuların içine aktarılabildiği gösterilmiştir. DNA’nın,
burun boşluklarından nazal dokuya aktarılabilmesi mümkündür. Altın
bombardmanı metodunda, bir nanogram altın kaplı DNA bağışıklık cevabı
oluşturur. Bir mikrogram DNA, aşılananlara bin farklı gen aktarabilir.
|
|
WEB KAYNAKLARI
DNA
vaccine web
|
| |
DNA aşılarının Avantajları
- Plazmidler kolaylıkla çok sayıda üretilebilir
- DNA çok stabildir
- DNA aşırı ısıya dirençlidir ve böylece depolaması ve taşıması
kolaydır
- Bir DNA dizisi laboratuarda kolaylıkla değiştirilebilir. Bu
demektir ki, enfeksiyöz kısımdaki değişikliklere karşılık
verebiliriz
- Aşılananlarda antijen sentezi için kodlama plazmid kullanılarak
olur. Üretilen antijenik proteinler, virüslere karşı korunmak için
üretilen proteinlerle benzer yolla işlenir (post-translasyonel
modifikasyon). Bu yöntem, örneğin, mayada antijen üretmek için
rekombinant bir plazmid kullanmak (örn; HBV aşısı), proteini
saflaştırmak ve bunu bir immunogen olarak kullanmaktan çok daha iyi
antijen elde edilmesini sağlar
- Plazmidlerin karışımı bir virüsten pek çok protein fragmanı
kodlamak için kullanılabilir, bu sayede geniş bir aşı spektrumu
üretilebilir
- Plazmid çoğalmaz ve sadece ilgili proteinleri kodlar
- Protein bileşeni yoktur ve böylece vektörün kendisine karşı bir
bağışıklık cevabı oluşmaz
- Antijenin hazırlanma şekli yüzünden, patojendeki herhangi bir
antijene karşı bir hücre aracılı yanıt olur. Bu durum ayrıca bazı
intrasellüler patojenlerin (örneğin mycobacterium tuberculosis)
neden olduğu hastalıklara karşı da koruma oluşturur
Yukarıdakilerden de anlaşılabileceği gibi DNA aşıları ucuzdur ve
bu nedenle ekonomik önemi daha az olan patojenlere karşı
geliştirildiği düşünülebilir (en azından ilaç şirketleri için).
|
| |
Olası Problemler
-
Konak genomunda plazmidin potansiyel integrasyonunun
insersiyona neden olması
-
Otoimmün yanıtlarının indüksiyonu (örneğin patojenik
anti-DNA-antikorları)
-
İmmünolojik toleransın indüksiyonu (örneğin, konakta
antijenin tanımlandığı yer, bu antijene özel yanıtsızlığa neden
olabilir.)
Başlangıç çalışmaları
DNA bazlı plazmid aşılarından sonra virüslere karşı yapılan pek çok DNA
aşı çalışmaları aslında virüs enfeksiyonunu andırmaktadır. İyi
karakterize edildiklerinde immün yanıtlar geniş bazlıdır ve homolog
virüsün oluşturduğu normal bir enfeksiyonda görülen durumu taklit eder.
Bağışıklık cevabı farkedilebilir derecede uzun süreli olabilir ve hatta
sonrasında ek doz gerekebilir. Bağışıklık sisteminin enfekte bir hücreyi
fark ettiğinde oluşan sitotoksik T lenfosit (CTL) yanıtları, beklendiği
kadar iyi olmuştur.
İnfluenza A virüsün yıllık değişimlerinin (antigenic drift and shift)
üstesinden gelmek mümkün olursa korunmuş, sabit bir internal protein
tanımlanır ve böylece sitotoksik hücresel immünite uyarılır. Bu DNA
aşısı kullanımıyla ilgili önemli bir görüştür. CTL’ler korunmuş viral
nükleoproteine karşı farelerden elde edilmiştir. Farklı bir yüzey
hemaglütinine sahip virulan bir heterolog virusun letal dozuna maruz
kalsa bile fareleri hastalığa karşı korumakta başarılı olmuştur. Tedavi
edilmemiş farelere anti-nükleoprotein antikorların transferi fareleri
hastalığa karşı korumaz, aşının koruyucu etkisi hücre aracılı olmalıdır.
Mevcut grip aşısı, bir sonraki grip sezonunda etkili olacağı
tahmin edilen grip türlerinin antijenlerini içeren inaktif bir aşıdır.
Yanlış tahmin durumunda, aşı kullanımının da faydası az olur. Aşı (it),
virusun hayvan rezervuarlarında (ördek) reassortmentı sonucu değişen yüzey
antijenleridir. Aşı, intramusküler enjekte edilir ve IgG yanıtına (dolaşımdaki
humoral antikor) yol açar. Aşı koruyucudur; çünkü yerterli düzeydeki IgG,
yüzey antijenlerine bağlanıp onları nötralize edebildiği yer olan akciğer
mukozasına geçer. Bir plazmid bazlı DNA aşısı kullanıldığında, plazmidle
enfekte hücrelerden salınan antijenleri tanıyan hem humoral yanıt oluşur hem
de sitotoksikT-lenfositler üretilir. Enfekte kas hücreleri MHC sınıf-I
molekülleri ile influenza (flu) antijenlerini sunduğunda CTL üretilir.
Sunulan antijen nükleokapsit proteini ise (ki bir korunmuş proteindir),
antijenik varyasyon problemini önler. Böyle bir yaklaşım, grip aşısını
tamamiyle değiştirebilir.
|
| |
Diğer çalışmalarda, hem
nükleoprotein hem de yüzey antijenlerini kodlayan plazmid karışımı
kullanılmıştır. DNA aşılarıyla korunma ayrıca kuduz, mikoplazma ve
Plasmodium yoelii için de gösterilmiştir. Ayrıca anti-HIV aşıları da
denenmektedir. HIV bölümünde, diğer potansiyel problemler yüzünden tüm virüs
aşılarının (CTL yanıtlarına neden olabilen) kullanımı reddedilirken aslında
gerçekte sadece humoral antikor oluşumuna neden olan pek çok aşı nedeniyle
AIDS aşılarında sürecinin engellendiğine dikkat çekilmiştir. Plazmid bazlı
aşılar bu problemlerin üstesinden gelebilir..
|
 Şekil 13 Aşı ile önlenebilen Hastalıklar, Aşı geliştirme ve lisans yılı
- ABD, 1798-1998
Şekil 13 Aşı ile önlenebilen Hastalıklar, Aşı geliştirme ve lisans yılı
- ABD, 1798-1998
(MMWR/CDC) |
Bugün birçok anti-viral aşılar mevcut ve daha geliştirilmektedir. Bu
aşılann tüm dünyada halk sağlığı üzerinde önemli bir etkisi mevcut
(Şekil 13 ve buraya bakınız).
|
|
WEB KAYNAKLARI
Baseline 20th century annual morbidity and 1998 provisional
morbidity from nine diseases with vaccines recommended before 1990 for universal
use in children in the United States
MMWR/CDC
Are
your child's vaccines up to date?
CDC |
| |
 Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
This page last changed on
Sunday, June 05, 2016
Page maintained by
Richard Hunt
|

 Şekil 1b
Şekil 1b Şekil 4.
Şekil 4. Şekil 8
Şekil 8 Şekil 11 Zayıflatılmış İnfluenza aşı suşu bir soğuk duyarlı mutant
kullanarak yeni virulan suşları ile reassorte edilebilir
Şekil 11 Zayıflatılmış İnfluenza aşı suşu bir soğuk duyarlı mutant
kullanarak yeni virulan suşları ile reassorte edilebilir
 Şekil 12 Anti-idiotip antikorlar
Şekil 12 Anti-idiotip antikorlar  Şekil 13 Aşı ile önlenebilen Hastalıklar, Aşı geliştirme ve lisans yılı
- ABD, 1798-1998
Şekil 13 Aşı ile önlenebilen Hastalıklar, Aşı geliştirme ve lisans yılı
- ABD, 1798-1998 


































