|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIOLOGJIA |
IMUNOLOGJIA |
MIKOLOGJIA |
PARAZITOLOGJIA |
VIROLOGJIA |
|
ANGLISHT |
VIROLOGJI
KAPITULLI XII
NDĖRVEPRIMET VIRUS-STREHUES
Dr Gene Mayer
Professor Emeritus
University of South Carolina
Pėrktheu:
Blerim Berisha
Kryetar i OJQ Qendra pėr Avansimin e Studimeve, Ekspert i
librarisė elektronike biomjekėsore nė Qendrėn e Telemjekėsisė sė
Kosovės
|
|
En
Espańol |
|
|
|
|
|
|

 |
|
|
OBJEKTIVAT MĖSIMOR
Tė pėrshkruaj mekanizmat e mbrojtjes specifike dhe jospecifike tė
strehuesit tė pėrfshira nė rezistencė ndaj infeksioneve me virus dhe
shėrimin ndaj tyre
Tė diskutojė rolin e interferoneve nė infeksionet virale
Tė rishikojė mekanizmat pėrmes tė cilėve interferoni e shfaq aktivitetin
e tij antiviral
Tė diskutojė kontributin relativ tė mekanizmave tė ndryshėm mbrojtės tė
strehuesit nė infeksionet virale |
Qėndrueshmėria dhe shėrimi nga infeksionet virale varen
nga ndėrveprimi qė ndodh ndėrmjet virusit dhe strehuesit. Mbrojtja, e
cila krijohet
nga strehuesi, mund tė veproj drejtpėrdrejt nė virus ose tėrthorazi nė
riprodhimin e virusit duke dėmtuar ose mbytur qelizėn e infektuar.
Mbrojtja jospecifike e strehuesit funksionon nė fazėn e kontaktit tė
hershėm me virusin, pėr tė parandaluar ose kufizuar infeksionin. Kurse,
mbrojtja specifike vepron pas infeksionit nė imunitetin rikuperues ndaj
sfidave pasuese. Mekanizmat mbrojtės tė strehuesit, tė pėrfshirė nė njė
infeksion tė caktuar viral do tė varen nga virusi, doza dhe porta e
hyrjes sė tij. Nė vijim janė dhėnė disa parime tė pėrgjithshme tė
ndėrveprimit virus-strehues.
MBROJTJA NDAJ INFEKSIONIT
Mbrojtja e
lindur
Strehuesi i ka disa mekanizma mbrojtės ndaj
infeksionit, tė cilėt janė tė bashkėlindur pėr organizmin. Kėto
paraqesin vijėn e parė tė mbrojtjes dhe funksionojnė duke e
parandaluar ose kufizuar infeksionin.
Lėkura
Lėkura vepron si barrierė e pamposhtur ndaj shumė
viruseve dhe vetėm pasi kjo barrierė tė tejkalohet, virusi do tė
mund tė infektojė strehuesin.
Mungesa e receptorėve tė membranės
Virusėt hyjnė nė qelizat e strehuesit duke u
lidhur sė pari me receptorėt specifikė nė qeliza (Tabela 1;
adaptuar nga: Roitt, Immunology, 5th ed).
|
|
FJALĖT KYĒE
Mbrojtja e lindur
Mbrojtja e nxitur
Interferoni
2'5' Oligo A sintetaza
Protein-kinaza e aktivizuar nga IFN
Aktiviteti i brendshėm antiviral
Aktiviteti i jashtėm antiviral
ADCC
Imunoadherenca
Qelizat VN
LTC-tė |
|
|
Tabela 1 |
|
Virusi |
Receptori |
Tipi i qelizės sė
infektuar |
|
HIV |
CD4 |
Limfocitet
TH |
|
Virusi Epshtajn-Barr |
CR2 (receptori i komplementit
tip 2) |
Limfocitet B |
|
Virusi i gripit A |
Glycophorin A |
Shumė tipe
qelizore |
|
Rinoviruset |
ICAM-1 |
Shumė tipe
qelizore |
Rangu i strehuesit tė virusit do tė varet nga
prania e kėtyre receptorėve. Pra, nėse strehuesit i mungon
receptori pėr virusin ose nėse qelizės strehuese i mungojnė disa
komponenta tė nevojshme pėr riprodhimin e virusit, atėherė
strehuesi do tė jetė rezistent ndaj atij virusi. P.sh. minjėve
iu mungon receptori pėr virusin e polios dhe si rrjedhim ata
janė rezistent ndaj poliomielitit. Ngjashėm, njerėzit kanė
rezistencė tė lindur ndaj shumė viruseve tė bimėve dhe kafshėve.
Mukusi
Mukusi, qė e mbulon indin epitelial, vepron si barrierė pėr tė
parandaluar infektimin e qelizės sė strehuesit. Nė disa raste,
mukusi vepron thjesht si njė barrierė, kurse nė raste tė tjera
mukusi mund tė parandalojė infeksionin duke konkurruar me
receptorėt e viruseve nė qeliza. P.sh. familjet e orthomyxo dhe
paramyxoviruseve infektojnė qelizat e strehuesit duke u lidhur
me receptorėt e acidit sialik. Prandaj, glikoproteinat nė mukus,
tė cilat pėrmbajnė acidin sialik, mund tė konkurrojnė me qelizat
e receptorėve dhe tė dobėsojnė ose parandalojnė lidhjen e
virusit me qelizėn.
Epiteli me cilie
Epiteli ciliar mund ti ndihmojė strehuesit nė dobėsimin e
infektivitetit tė disa viruseve. Ky sistem ėshtė treguar i
rėndėsishėm nė infeksionet respiratore, meqenėse kur aktiviteti
i kėtij sistemi frenohet nga barnat ose infeksionet, kemi njė
rritje tė shkallės sė infektivitetit nga njė inokulum i caktuar
i virusit.
pH e ulėt
Vlera e ulėt e pH nė sekrecionet gastrike e inaktivizon shumicėn
e viruseve. Megjithatė, enterovirusėt janė rezistent ndaj
sekrecioneve gastrike, prandaj mund tė mbijetojnė dhe tė
shumėzohen nė zorrė.
Komponentat humorale dhe qelizore
Shih mė poshtė.
|
| |
Barrierat e
nxitura
Ndryshimet tė cilat ndodhin tek strehuesi si
pėrgjigje ndaj infeksioneve, po ashtu, mund tė ndihmojnė nė
dobėsimin e infektivitetit tė virusit.
Ethet
Ethet mund tė ndihmojnė nė frenimin e riprodhimit
tė virusit duke fuqizuar mbrojtjet e tjera imunitare dhe duke
zvogėluar riprodhimin e virusit. Riprodhimi i disa viruseve
zvogėlohet nė temperaturat mbi 37°C.
pH e ulėt
pH e infiltrateve inflamatore ėshtė gjithashtu e
ulėt dhe mund tė ndihmojė nė kufizimin e pėrhapjes sė
infeksioneve virale duke i inaktivizuar virusėt.
Komponentat humorale dhe qelizore
Shih mė poshtė.
KOMPONENTAT
HUMORALE TĖ PĖRFSHIRA NĖ REZISTENCĖN NDAJ INFEKSIONEVE VIRALE
Jospecifike
Nė rezistencėn ndaj infeksioneve virale funksionon
njė numėr i komponentave humorale tė sistemit imunitar jospecifik.
Disa nga kėto komponenta janė tė pranishme nė mėnyrė konstitutive,
pėrderisa disa tė tjera nxiten nga prania e infeksionit.
Interferoni
(IFN)
IFN ėshtė zbuluar para mė shumė se 40 viteve nga Issacs dhe
Lindemann, tė cilėt kanė treguar se fraksionet supernatante nga
qelizat e infektuara me virus pėrmbanin njė proteinė, e cila
mund tė jep rezistencė ndaj infeksionit pėr qelizat e tjera. Kjo
substancė nuk vepronte drejtpėrdrejt nė virus, por vepronte nė
qeliza duke i bėrė ato rezistente ndaj infeksionit (figura 1).
|
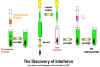 Figura
1 Zbulimi i interferonit
Figura
1 Zbulimi i interferonit
 Figura
2. Pėrgjigja tipike ndaj infeksionit akut viral
Figura
2. Pėrgjigja tipike ndaj infeksionit akut viral |
IFN ėshtė njėra nga vijat e
para tė mbrojtjes kundėr viruseve sepse ėshtė e nxitur herėt
pas infeksionit me virus- para se tė paraqiten mekanizmat
tjerė mbrojtės (p.sh. antitrupat, qelizat Tc etj.) (figura
2). Koha, pas sė cilės fillon tė krijohet IFN, varet nga
doza e virusit.
a) Tipet dhe karakteristikat e interferoneve
Tabela 2; Adaptuar nga: Murray, Medical Microbiology, 5th
ed. tabela 14-3)
|
Tabela 2
Tipet dhe karakteristikat e interferoneve |
|
|
Interferoni |
|
Karakteristika
|
Alfa |
Beta |
Gama |
|
Emėrtimi i mėparshėm |
IFN Leukocitar
Tipi I |
IFN Fibrobllastik
Tipi I |
IFN Imunitar
Tipi II |
|
Gjenet
|
>20 |
1 |
1 |
|
Stabiliteti
i pH2
|
Stabil |
Stabil |
Labil |
|
Nxitėsit
|
(ARN>ADN)
dvARN Virusėt
|
(ARN>ADN)
dvARN Virusėt
|
Antigjenet, Mitogjenet |
|
Burimi
kryesor |
Leukocitet, Epiteli |
Fibroblastet |
Limfocitet |
Ekzistojnė tri
tipe tė interferonit, IFN-alfa (i njohur edhe si interferoni
leukocitar), IFN-beta (interferoni fibroblastik) dhe
IFN-gama (interferoni imunitar). IFN-alfa dhe IFN-beta quhen
edhe si Tip I, kurse IFN-gama si Tip II. Ekzistojnė rreth 20
nėntipe tė IFN-alfa por vetėm njė IFN-beta dhe IFN-gama.
Interferonet kanė karakteristika tė ndryshme tė cilat
shfrytėzohen pėr ti dalluar ato (p.sh. stabiliteti dhe
aktiviteti i pH nė prani tė SDS) por aktualisht
identifikohen duke pėrdorur antitrupa specifik ndaj
interferoneve.
b) Nxitėsit e interferoneve Qelizat normale nuk pėrmbajnė
IFN tė paraformuar si dhe nuk sekretojnė nė mėnyrė
konstitutive. Kjo vjen nga fakti se gjenet e interferonit
nuk transkriptohen nė qelizat normale. Transkripcioni i
gjeneve tė IFN ndodh vetėm pas ekspozimit tė qelizave ndaj
nxitėsit tė duhur. Nxitėsit e IFN-alfa dhe IFN-beta
pėrfshijnė infeksionet me virus, ARN dy vargor (p.sh. poli
inosinik: acidi policitidilik; [poli I:C]), LPS dhe
komponentet nga disa baktere. Nga viruset, ARN virusėt janė
nxitėsit mė tė mirė, pėrderisa ADN virusėt janė nxitės tė
dobėt, me pėrjashtim tė poxvirusėve. Nxitėsit e IFN-gama
pėrfshijnė mitogjenet dhe antigjenet (d.m.th. ato qė i
aktivizojnė limfocitet).
|
 Figura 3
Figura 3
Mėnyra
e veprimit tė interferonit |
c) Ndodhitė qelizore nė
nxitjen e interferoneve
IFN gjenet nuk shprehen nė qelizat normale sepse qelizat
prodhojnė njė proteinė labile represore, e cila lidhet me
regjionin e promotorit mėsipėr gjenit dhe e inhibon
transkripcionin. Si shtesė, transkripcioni i gjeneve ka
nevojė pėr proteinėn aktivizuese pėr tu lidhur me regjionin
e promotorit dhe pėr tė kyēur transkripcionin. Nxitėsit e
IFN veprojnė ose duke parandaluar sintezėn e proteinės
represore ose duke e rritur nivelin e proteinave aktivizuese
dhe nė kėtė mėnyrė duke i kyēur IFN gjenet. Pasi tė largohet
nxitėsi, IFN gjeni pėrsėri ēkyēet nga proteina represore dhe/ose
nga mungesa e proteinės aktivizuese. Pasi tė aktivizohet
gjeni, ai transkriptohet, ARNi pėrkthehet dhe proteina
sekretohet nga qeliza. IFN do tė lidhet pėr IFN receptorėt
nė qelizat fqinje dhe nxisin gjendjen antivirale nė qelizėn
tjetėr (figura 3).
|
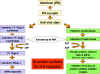 Figura
4
Figura
4
Baza
molekulare e gjendjes antivirale |
d) Ndodhitė qelizore nė
veprimin e interferoneve Lidhja e IFN me receptorin e tij
rezulton me transkripcionin e njė grupi tė gjeneve, tė cilėt
kodojnė proteinat antivirale tė pėrfshira nė parandalimin e
riprodhimit tė viruseve nė atė qelizė. Si rrjedhim, qeliza
do tė mbrohet nga infeksioni me virus derisa proteinat
antivirale tė degradohen (ky proces zgjat disa ditė).
Gjendja antivirale nė qelizat e trajtuara me IFN rezulton
nga sinteza e dy enzimeve, tė cilat bėjnė inhibimin e
sintezės sė proteinave. Njėra proteinė nė mėnyrė indirekte
ndikon nė sintezėn e proteinave duke e zbėrthyer ARNi viral,
kurse tjetra nė mėnyrė direkte ndikon nė sintezėn e
proteinave duke inhibuar zgjatjen (figura 4). Njė proteinė e
quajtur 2'5'Oligo A sintetaza, ėshtė enzimė e cila e
konverton ATP-nė nė polimer unik (2'5' Oligo A) qė pėrmban
lidhje 2'- 5'fosfodiesterike. ARN dy vargor ėshtė i
nevojshėm pėr veprimin e kėtij enzimi. 2'5'Oligo A pastaj
aktivizon ARNazen L e cila e zbėrthen ARNi virale. Proteina
e dytė ėshtė proteinė-kinazė, e cila nė prani tė ARN
dyvargore, autofosforilohet dhe nė kėtė mėnyrė aktivizohet.
Proteinė-kinaza e aktivizuar pastaj fosforilon faktorin
zgjatės eIF-2 dhe e inaktivizon atė. Nga veprimi i kėtyre dy
enzimeve tė nxitura nga IFN sinteza e proteinave inhibohet.
Megjithėse qeliza e infektuar mund tė shkatėrrohet si pasojė
e inhibimit tė sintezės sė proteinave tė strehuesit,
progredimi i infeksionit ndalet. Qelizat e painfektuara nuk
vriten nga veprimi i IFN pasi pėr aktivizimin e dy enzimave
nevojitet ARN dyvargore, e cila nuk prodhohet. Disa viruse
kanė mėnyra pėr tė inhibuar efektin antiviral tė IFN. P.sh.
adenovirusėt prodhojnė ARN, i cili parandalon aktivizimin e
proteinėkinazės nga ARN dyvargore dhe nė kėtė mėnyrė e
zvogėlojnė efektin antiviral tė IFN.
|
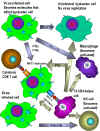 Figura
5
Figura
5
Efektet e interferonit alfa, beta dhe gama |
e) Veprimet tjera biologjike
tė interferoneve - IFN jo vetėm qė nxit prodhimin e
proteinave antivirale, por gjithashtu ka edhe efekte tė
tjera tek qelizat, disa nga tė cilat nė mėnyrė indirekte
kontribuojnė nė aftėsinė e strehuesit qė tė rezistojė ose
rikuperohet nga infeksionet virale (figura 5). IFN mund tė
ndihmojė modulimin e pėrgjigjeve imunologjike pėrmes efektit
tė tij nė MHC molekulat e klasės I dhe II. IFN-alfa, IFN-beta
dhe IFN-gama e rrisin ekspresionin e molekulave tė klasės I
nė tė gjitha qelizat, duke ndihmuar nė njohjen nga
limfocitet Tc, tė cilat mund tė shkatėrrojnė qelizat e
infektuara me viruse. IFN-gama, gjithashtu mund tė rrisė
ekspresionin e molekulave MHC tė Klasės II, tė cilat
pėrmbajnė antigjenin. Kjo rezulton me prezantimin mė tė mirė
tė antigjeneve virale ndaj limfociteve T ndihmėse CD4+ .
Gjithashtu, IFN-gama mund tė aktivizojė qelizat NV, tė cilat
mund tė vrasin qelizat e infektuara me virus. IFN-tė
gjithashtu e aktivizojnė edhe veprimin e brendshėm dhe tė
jashtėm antiviral tė makrofagjeve pėr tė shkatėrruar qelizat
e tjera tė infektuara me virus. IFN-tė gjithashtu kanė edhe
veprim antiproliferativ, prandaj pėrdoren nė trajtimin e
disa sėmundjeve malinje.
|
| |
f) Pėrdorimet klinike tė
interferoneve IFN janė pėrdorur nė trajtimin e disa
sėmundjeve virale dhe sėmundjeve tė tjera (Tabela 3;
Adaptuar nga: Mims, Medical Microbiology, Fig. 37.5)
|
Tabela 3
Pėrdorimi klinik i interferoneve |
|
Interferoni |
Pėrdorimi terapeutik |
|
IFN-alfa, IFN-beta |
Hepatiti
B (kronik)
Hepatiti C
Herpes zosteri
Papilloma virusi
Rinovirusi (vetėm profilaktik)
Lythat |
|
IFN-gama |
Lepra
lepromatoze
Leishmaniaza
Toksoplazmoza
Sėmundjet kronike granulomatoze (SKG) |
|
| |
Pėrveē kėsaj, pėr shkak tė efektit tė tyre antiproliferativ,
IFN-tė pėrdoren edhe nė trajtimin e shumė sėmundjeve malinje
(Tabela 4; Adaptuar nga: Zinsser, Microbiology, 20th Ed,
Tabela 58.3).
|
Tabela 4
Pėrdorimi i interferoneve nė trajtimin e kancerit |
|
Tumori |
Pėrqindja e
kompletimit ose remisioni i pjesėrishėm |
|
Hairy cell leukemia |
90 |
|
Leukemia
mielocitare kronike |
90 |
|
Limfoma e
limfociteve T |
53 |
|
Sarkoma e
Kaposit |
42 |
|
Neoplazmat
pankreatike endokrine |
30 |
|
Limfomat non-Hoxhkin |
25 - 35 |
|
| |
Megjithatė, efektet anėsore tė terapisė me IFN e kufizojnė
pėrdorimin e tyre rutinor nė praktikėn klinike (Tabela 5;
Adaptuar nga: Mims, Medical Microbiology, Fig. 37.6).
|
Tabela 5
Efektėt
mė tė shpeshta anėsore tė interferoneve |
|
Interferonet |
Ethet
Kėputje
Plogėshti
Dhembja e muskujve (mialgjia)
Toksiciteti ndaj:
veshkave
mėlēisė
palcės sė eshtrave
zemrės |
|
| |
Komplementi
Shumica e virusėve nuk e fiksojnė komplementin pėrmes rrugės
alternative. Megjithatė, ndėrveprimi i antitrupit
komplement-fiksues me qelizėn e infektuar me virus tek viruset
me mbėshtjellės mund tė rezultojė nė lizėn e qelizės ose tė
virusit. Prandaj, nė ndėrveprim me sistemin imunologik specifik,
komplementi, gjithashtu luan njė rol me rėndėsi nė rezistencėn
ndaj infeksioneve virale.
Citokinet
Pėrveē IFN, edhe citokinet mund tė luajn njė rol me rėndėsi nė
rezistencėn ndaj infeksioneve virale. Faktori i nekrozės
tumorale alfa (FNT- α), interleukina-1 (IL-1) dhe IL-6 janė
treguar tė kenė veprime antivirale in vitro. Kėto citokine
prodhohen nga makrofagėt e aktivizuar, por kontributi i tyre
ndaj rezistencės in vivo nuk ėshtė sqaruar plotėsisht.
|
| |
Specifik
Antitrupi i prodhuar nga sistemi imunologjik specifik
ėshtė i pėrfshirė kryesisht nė rikuperimin nga infeksionet virale
dhe nė rezistencėn ndaj sfidave pasuese me virusin. Antitrupat IgG,
IgM dhe IgA mund tė luajnė rol nė imunitetin ndaj infeksioneve
virale, por kontributi relativ ndaj klasave tė ndryshme varet nga
virusi dhe porta e hyrjes. Pėr shembull, IgA do tė jetė mė e
rėndėsishme tek virusėt tė cilėt infektojnė mukozėn; pėrderisa
antitrupat IgG do tė jenė mė tė rėndėsishėm nė infeksionet, nė tė
cilat viremia ėshtė veēoria mė e theksuar. Antitrupat mund tė kenė
efekte edhe tė dobishme edhe tė dėmshme pėr strehuesin.
Efektet e
dobishme (Tabela 6: Adaptuar nga: Roitt, Immunology 5th Ed.,
Fig 16.5)
Antitrupi mund tė neutralizojė nė mėnyrė direkte infektivitetin
e virusit duke e penguar lidhjen e virusit me receptorėt nė
qelizat e strehuesit ose hyrjen e virusit nė qelizė. Antitrupat,
gjithashtu mund tė pengojnė heqjen e mbėshtjellėsit duke
ndėrhyrė me ndėrveprimin e proteinave virale tė pėrfshira nė
heqjen e mbėshtjellėsit. Antitrupat fiksues tė komplementit mund
tė asistojnė nė lizėn e qelizės sė infektuar me virus ose tė
viruseve me mbėshtjellės. Antitrupat, gjithashtu mund tė
veprojnė edhe si opsonine dhe tė fuqizojnė fagocitozėn e
viruseve ose duke lehtėsuar kapjen e tyre pėrmes receptorėve Fc
ose C3b ose duke aglutinuar virusėt pėr ti bėrė ato me lehtė tė
fagocitueshėm. Qeliza e infektuar me virus, e cila ėshtė e
mbėshtjellur me antitrupa mund tė vritet nga qelizat K, me
ērast parandalohet pėrhapja e infeksionit.
|
Tabela 6
Efektet antivirale tė antitrupave |
|
Caku |
Agjenti |
Mekanizmi |
|
Virusi i lirė |
Antitrupi i vetėm |
Bllokon lidhjen me qelizė
Bllokon hyrjen nė qelizė
Bllokon heqjen e mbėshtjellėsit tė virusit |
|
Antitrupi + Komplementi |
Dėmtimi i mbėshtjellėsit
tė virusit
Opsonizimi i virusit |
|
Qeliza e infektuar me virus |
Antitrupi + Komplementi |
Liza e qelizės sė
infektuar
Opsonizimi i qelizės sė infektuar |
|
Antitrupi i lidhur pėr qelizėn e infektuar |
ADCC nga K qelizat, NV
qelizat dhe/ose makrofagėt |
Efektet e dėmshme
a) Dėmtimi
imunopatologjik Fiksimi i komplementit nga imunokomplekset
mund tė rezultojė me lirimin e amineve vazoaktive,
rekrutimin e qelizave antiinflamatore dhe dėmtimin pasues tė
indit tė strehuesit. Disa viruse, siē ėshtė virusi i
koriomeningjitit limfocitar prodhojnė sasi tė mėdha tė
imunokomplekseve nė qarkullim, tė cilat depozitohen nė
shtratin vaskular dhe nė veshka, ku e fiksojnė komplementin
dhe rezultojnė me dėmtimin e indit. Shembuj tė tjerė tė
viruseve tė cilėt shkaktojnė efekte tė tilla janė: morbili,
virusi sincicial respirator, virusi i etheve tropikale dhe
virusi i hepatitit B.
b) Imunoadherenca Opsonizimi i viruseve me antitrupin
mund tė rrisė kapjen nga qelizat fagocitare. Nėse virusi
ėshtė nė gjendje tė mbijetojė nė fagocit, kjo mundėson
pėrhapjen e infeksionit viral. Ethet tropikale dhe HIV janė
shembuj tė viruseve tė cilėt mund tė mbijetojnė nė makrofag.
Serologjia
Pasqyra klinike dhe serologjia luajnė njė rol tė mė tė madh nė
diagnostikimin e sėmundjeve virale, pasi qė metodat e tjera (izolimi
dhe identifikimi i viruseve) zakonisht nuk bėhet nė mėnyrė
rutinore nė laboratoret klinike. Tipet kryesore tė antitrupave
tė cilėt kėrkohen nė diagnostikė janė antitrupat neutralizues,
hemaglutinues, inhibues dhe fiksues tė komplementit. Antitrupat
fiksues tė komplementit e pėrcjellin kinetikėn e IgM dhe janė mė
tė dobishėm pėr tė dėshmuar infeksionin e tanishėm ose tė
sapokaluar. Pėr dallim, antitrupat neutralizues dhe
hemaglutinues e pėrcjellin kinetikėn e IgG, perzistojnė pėr kohė
mė tė gjatė dhe pėrdoren pėr tė vlerėsuar imunitetin. Krijimi i
antitrupave ndaj komponentave tė ndryshme tė virusit
shfrytėzohet nė etapizimin e sėmundjes. P.sh., kjo pėrdoret tek
infeksioni me Hepatit B dhe HIV.
|
| |
KOMPONENTAT
QELIZORE
Pėrveē barrierave dhe komponentave humorale tė pėrfshira
nė rezistencė dhe rikuperim nga infeksionet virale, ekzistojnė edhe disa
qeliza tė ndryshme tė cilat luajnė rol nė mbrojtjen tonė kundėr viruseve.
Jospecifike
Makrofagėt
Makrofagėt, pėrmes mundėsisė sė ndodhjes nė pjesė tė ndryshme tė
trupit, janė ndėr qelizat e para qė takohen me viruset. Dėshmitė
eksperimentale sugjerojnė se kėto qeliza luajnė njė rol tė
rėndėsishėm nė rezistencėn ndaj infeksioneve virale. P.sh. miu i
porsalindur ėshtė i ndjeshėm ndaj infeksioneve me virusin e
herpesit tip 1, pėr shkak tė defektit nė aftėsinė e makrofagut
pėr tė penguar riprodhimin e virusit. Mirėpo, makrofagėt nga
mijtė e rritur janė nė gjendje qė tė pengojnė riprodhimin e
virusit dhe kėta minj janė rezistent ndaj infeksionit me kėtė
virus. Gjithashtu, kafshėt tek tė cilėt makrofagėt janė nė numėr
mė tė vogėl janė mė tė ndjeshėm ndaj infeksionit nga njė mori e
viruseve. Makrofagėt kontribuojnė nė mbrojtjen antivirale nė
disa mėnyra:
a)
Aktiviteti i brendshėm antiviral Makrofagėt mund tė
infektohen me virus por shumė virus nuk janė nė gjendje qė
tė replikohen nė makrofag. Makrofagėt e aktivizuar (p.sh.
pėrmes IFN-γ) janė edhe mė shumė nė gjendje qė ti
rezistojnė replikimin viral. Kėshtu qė, makrofagėt ndihmojnė
nė kufizimin e infeksionit viral pėrmes vetisė sė tyre tė
brendshme qė tė pengojnė riprodhimin e viruseve. Megjithatė,
disa virus janė nė gjendje qė tė riprodhohen ose sė paku qė
tė mbijetojnė nė makrofagė dhe kėshtu mund tė shpėrndahen
pėrmes makrofagut (shih mė sipėr).
b) Aktiviteti i brendshėm
antiviral Makrofagėt janė gjithashtu nė gjendje qė tė
njohin qelizat e infektuara me virus dhe ti shkatėrrojnė
ato. Makrofagėt gjithashtu kontribuojnė nė mbrojtjen
antivirale pėrmes vetisė sė aktivitetit citotoksik tė tyre.
c) ADCC Qelizat e infektuara me virus, tė cilat janė tė
mbėshtjella me antitrupa IgG mund tė shkatėrrohen nga
makrofagėt pėrmes ADCC.
d) Prodhimi i IFN Makrofagėt janė burim i IFN.
Qelizat VN
Dėshmitė eksperimentale gjithashtu sugjerojnė se qelizat vrasėse
natyrore(VN) luajnė rol nė rezistencėn ndaj infeksioneve virale.
Minjėt tek tė cilėt ėshtė zvogėluar numri i qelizave VN janė mė
tė ndjeshėm ndaj infeksioneve me disa virus. Gjithashtu,
pacientėt me aktivitet tė zvogėluar tė qelizave VN janė mė tė
ndjeshėm ndaj rishfaqjes sė infeksionit me virusin Herpes
simpleks tip 1. Qelizat VN veprojnė pėrmes njohjes dhe vrasjes
sė qelizave tė infektuara me virus. Njohja e qelizave tė
infektuara me virus nuk ėshtė e kufizuar nga MHC ose antigjenet
specifike. Prandaj, qelizat VN do tė vrasin qelizat e infektuara
nga shumė virus tė ndryshėm. Qelizat VN mund tė ndėrmjetėsojnė
ADCC dhe mund tė vrasin qelizat e infektuara me virus pėrmes
kėtij mekanizmi. Veprimet e qelizave VN mund tė fuqizohen pėrmes
IFN-γ dhe Il-2 (shih mė sipėr).
|
| |
Specifike
Limfocitet T limfocitet T luajnė rol tė rėndėsishėm nė rikuperimin
nga infeksionet virale. Qelizat T citotoksike (LTC-tė) tė prodhuara
si pėrgjigje ndaj antigjenit viral nė qelizėn e infektuar mund tė
vrasin qelizėn e infektuar dhe nė kėtė mėnyrė e pengojnė pėrhapjen e
infeksionit. Limfocitet ndihmėse T janė tė pėrfshira nė formimin e
LTC-ve dhe nė asistimin e limfociteve B pėr tė prodhuar antitrupa.
Pėrveē kėsaj, limfokinet e sekretuara nga limfocitet T mund tė
rekrutojnė dhe aktivizojnė makrofagėt dhe qelizat VN, nė kėtė mėnyrė
duke e mobilizuar njė sulm tė pėrbashkėt ndaj virusit.
|
| |
PĖRMBLEDHJA E
MBROJTJEVE
Tabela 7 (Adaptuar nga: Baron, Medical
Microbiology, 2nd Ed., Tabela 69-2) pėrmbledh mbrojtjet e strehuesit
kundėr infeksoneve virale dhe tregon caqet pėr tė gjitha kėto mbrojtje.
|
Tabela 7
Funksionet efektore tė strehuesit nė infeksionet virale
|
|
Mbrojtja e strehuesit |
Efektori |
Caku i efektorit |
|
Pėrgjigjet e hershme
jospecifike |
Ethet
Fagocitoza
Inflamacioni
Aktiviteti i qelizave VN
Interferoni |
Riprodhimi i virusit
Virusi
Replikimi i virusit
Qeliza e infektuar me virus
Riprodhimi i virusit, imunomodulimi |
|
Pėrgjigjet imune tė
ndėrmjetėsuara nga qelizat |
Linfocitet T citotoksike
Makrofagėt e aktivizuar
Limfokinet
ADCC |
Qeliza e infektuar me virus
Virusi, qeliza e infektuar me virus
Qeliza e infektuar me virus, imunomodulimi
Qeliza e infektuar me virus |
|
Pėrgjigjet imune humorale |
Antitrupi
Antitrupi + komplementi |
Virusi, qeliza e infektuar me
virus
Virusi, qeliza e infektuar me virus |
KONTRIBUTET
RELATIVE TĖ MEKANIZMAVE MBROJTĖS TĖ STREHUESIT
Kontributet relative tė mekanizmave tė ndryshėm mbrojtės
tė strehuesit do tė varen nga natyra e virusit dhe porta e hyrjes.
Antitrupat do tė jenė mė tė rėndėsishėm nė infeksionet nė tė cilat
viremia ėshtė karakteristika mė e theksuar. Megjithatė, antitrupat mund
tė mos jenė tė dobishėm nė infeksionet me herpes ose paramyxovirus, nė
tė cilat virusi mund tė kalojė nga qeliza nė qelizė pėrmes fuzionit tė
qelizave. Nė kėtė rast, imuniteti i ndėrmjetėsuar nga qelizat ėshtė mė i
rėndėsishėm. Nėse virusi i infekton qelizat vetėm nė sipėrfaqen e
mukozave, atėherė rėndėsi kanė antitrupat IgA.
Tė kuptuarit e mekanizmave mbrojtės tė strehuesit ėshtė i rėndėsishėm nė
zhvillimin e vaksinave dhe pėr administrimin e duhur tė vaksinave. Nėse
antitrupat IgA janė tė rėndėsishėm pėr mbrojtje kundėr virusit tė
caktuar, atėherė vaksina duhet tė jetė nė gjendje tė stimulojė prodhimin
e antitrupave IgA nė sipėrfaqen e duhur mukozave. Nė mėnyrė alternative,
nėse LTC-tė janė tė rėndėsishme, atėherė vaksina duhet tė jetė nė
gjendje qė tė stimulojė prodhimin e LTC. Kjo ėshtė arsyeja pse vaksinat
e gjalla janė shpesh tė preferuara kundrejt vaksinave te vdekura, sepse
vaksinat e gjalla zakonisht ēojnė nė gjenerimin e LTC-ve pėrderisa
vaksinat e vdekura nuk e bėjnė njė gjė tė tillė.
|
| |
IMUNOPATOLOGJIA E
NXITUR NGA VIRUSI
Ndonėse strehuesi ka njė mori tė mbrojtjeve pėr ti pėrballuar
infeksioneve virale, nganjėherė shkaku kryesor i dėmtimit tė indit ėshtė
pikėrisht pėrgjigja imunologjike ndaj infeksionit. P.sh. infantėt e
infektuar me citomegalovirus kanė imunokomplekse nė qarkullim tė gjakut,
tė cilat depozitohen nė veshka dhe nyje duke rezultuar nė artrit dhe
glomerulonefrit. Shembull tjetėr ėshtė sindromi i shokut hemorragjik
fatal, qė ndėrlidhet me ethet tropikale. Nė kėtė rast fiksimi i
komplementit nga ana e imunokomplekseve qarkulluese rezulton me lirimin
e produkteve tė kaskadės sė komplementit qė ēon nė rritjen e befasishme
tė lėshueshmėrisė sė enėve tė gjakut, shok dhe vdekje.
IMUNOSUPRESIONI
Shumė virusė janė tė aftė qė tė pengojnė pėrgjigjen imune dhe kėshtu tė
tejkalojnė ose minimizojnė mbrojtjen e strehuesit. Shembulli mė i mirė
ėshtė HIV, i cili infekton qelizat CD4+ dhe nė kėtė mėnyrė shkatėrron
sistemin imun specifik. Virusėt tjerė (p.sh. virusi i morbillit) mund
gjithashtu tė infektojnė limfocitet dhe tė ndikojnė nė riprodhimin dhe
diferencimin e tyre. Disa nga mekanizmat pėrmes tė cilėve virusėt mund
tė shmangin mbrojtjen e strehuesit janė dhėnė nė tabelėn 8 (Adaptuar nga:
Roitt, Immunology 5th Ed., Fig 16.10).
|
Tabela 8
Prodhimet virale qė interferojnė me mbrojtjet e strehuesit |
|
Mbrojtja e prekur e
strehuesit |
Virusi |
Prodhimi i virusit |
Mekanizmi |
|
Interferoni |
EBV |
EBERS (ARN-tė
e vogla) |
Bllokon aktivizmin e protein-kinazės |
|
Vaccinia |
eIF-2alfa
homolog |
Pengon fosforilimin e
eIF-2alfa pėrmes proteinė- kinazės |
|
Komplementi |
Vaccinia |
Homologe e
proteinave kontrolluese tė komplementit |
Bllokon aktivizimin e
komplementit |
|
Antitrupi |
HSV-1 |
gE/gI |
Lidh
Fc-gama dhe bllokon funksionin |
|
Citokinet |
Myxoma |
Homolog me
receptorin e
IFN-gama |
Konkurron me IFN-gama dhe
bllokon funksionin |
|
Shope fibroma virus |
FNT
receptor |
Konkurron me FNT dhe bllokon
funksionin |
|
EBV |
IL-10
homolog |
Zvogėlon funksionin e
IFN-gama |
|
MHC Klasa I |
CMV |
Proteina e
hershme |
Pengon transportin e MHC tė
ngarkuar me peptide |
|
Adenovirus |
E3 |
Bllokon
transportin e MHC pėr nė sipėrfaqe |
|
Apoptoza |
Adenovirus |
14.7K |
Inhibon kapsazat |
|
EBV |
Bcl-2 homolog |
Anti-apoptoik |
|
Qelizat VN |
HCMV |
UL-18 |
MHC homolog
inhibon qelizat VN |
|
|
|
 Kthehu
nė seksionin e virologji tė Microbiology and Immunology On-line
Kthehu
nė seksionin e virologji tė Microbiology and Immunology On-line
faqja sė fundi e ndėrruar nė
Monday, February 16, 2015
faqja mbahet nga
Richard Hunt
|

 Figura
1 Zbulimi i interferonit
Figura
1 Zbulimi i interferonit Figura 3
Figura 3 Figura
4
Figura
4 Figura
5
Figura
5
