|
OBJECTIFS DU COURS
Connaître la différence entre immunisation passive et active et leurs
exemples
Distinguer les modes d’immunisation naturels et artificiels
Connaître les applications et les problèmes de l’immunisation
artificielle passive
Connaître les applications et les problèmes de l’immunisation
artificielle active
Connaître les approches modernes d’immunisation
|
L’immunisation est un moyen d'assurer une protection spécifique
contre de nombreux agents pathogènes courants en stimulant le système
immunitaire de l'organisme afin qu’il produise soit des anticorps (immunité à
médiation humorale) contre l'agent pathogène (ou contre des toxines produites
par l'agent pathogène) soit des cellules T qui peuvent assurer l'immunité à
médiation cellulaire.
Le type d'immunité nécessaire pour neutraliser un agent
pathogène spécifique dépend du site où se localise l'agent pathogène ainsi que
des mécanismes de sa pathogénicité. Par exemple, certains agents pathogènes
causent des maladies en sécrétant des exotoxines. Dans ce cas, le seul mécanisme
immunitaire efficace contre cet organisme est basé sur les anticorps
neutralisants qui empêchent l’exotoxine de se lier à son récepteur présent sur
sa cellule cible et d’exercer ses effets néfastes, ce qui, au final, conduit à
sa dégradation par les phagocytes.
Si l'agent pathogène cause des maladies par d'autres moyens, les
anticorps devront alors réagir avec l'agent pathogène lui-même et l'éliminer.
Cela peut intervenir soit par le mécanisme de lyse dépendante du complément soit
par la phagocytose suivie de la destruction intracellulaire. Toutefois, si
l'organisme pathogène est localisé dans le compartiment intracellulaire, il ne
sera pas accessible aux anticorps et c’est la cellule hébergeant le pathogène
qui devra être détruite à la place; c’est seulement à cette condition que les
anticorps pourront avoir un effet sur l'agent pathogène. La plupart des virus,
les bactéries intracellulaires et les protozoaires sont des exemples de tels
agents pathogènes. Dans ce cas, les cellules hébergeant le pathogène peuvent
être détruites par des acteurs de l’immunité à médiation cellulaire. Si
l’infection conduit la cellule infectée à exprimer à sa surface des antigènes
reconnaissables par les anticorps, alors une lyse de la cellule infectée
dépendante des anticorps et du complément permettra d’exposer l'agent pathogène
à l'immunité humorale. Il est également possible, pour les cellules hébergeant
un pathogène intracellulaire, d’être activées de telle sorte à pouvoir tuer
elle-même l'agent pathogène. Cela n'est manifestement pas le cas avec certains
agents pathogènes qui ont la capacité de survivre dans les cellules
phagocytaires.
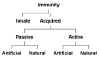
L'immunité spécifique peut résulter d'une immunisation passive
ou active. Ces deux modes de vaccination peuvent se faire par des processus
naturels ou artificiels (Figure 1C).
IMMUNITE PASSIVE
L’immunité peut être obtenue sans que le système immunitaire
n’ait été exposé à un antigène. Cela se produit par un transfert à un receveur
non-immunisé de sérum ou de gamma globulines provenant d’un donneur immunisé.
Cela peut également se produire par transfert de cellules provenant d’un
individu immunisé. L’immunité passive peut être naturelle ou artificielle.
Immunité passive
acquise de façon naturelle
L’immunité est transférée de la mère au fœtus grâce au
passage des IgG maternelles au travers de la barrière placentaire ou par le
transfert d’IgA présentes dans le colostrum.
Immunité passive
acquise de façon artificielle
L’immunité est souvent transférée artificiellement par
l’injection de gamma globulines provenant d’autres individus ou d’animaux
immunisés. Le transfert passif de l’immunité par l’injection
d’immunoglobulines ou de gamma globulines est utilisé dans de nombreuses
situations d’infection aigüe (comme pour la diphtérie, le tétanos, la
rougeole, la rage, etc.), d’empoisonnement (insectes, reptiles, botulisme)
et en prophylaxie (hypogammaglobulinémie). Dans ces situations, les
gammaglobulines d’origine humaine sont préférables, mais des anticorps
spécifiques obtenus dans d’autres espèces sont également efficaces et sont
utilisées dans certains cas (empoisonnement, diphtérie, tétanos, gangrène,
botulisme). Bien que cette forme d’immunisation offre l’avantage d’apporter
une protection immédiate, les immunoglobulines hétérologues ne sont
efficaces que peu de temps et peuvent conduire à des complications (maladie
du sérum et anaphylaxie par exemple. Les immunoglobulines homologues
présentent aussi le risque de transmettre l’hépatite ou le sida.
Le transfert passif de cellules immunitaires peut aussi être
réalisé dans certains cas (cancer, immunodéficiences) mais est compliqué par
la difficulté de trouver un donneur histocompatible et peut par ailleurs
conduire à une maladie du greffon contre l’hôte.
|

Figure 1A. Edward Jenner met en œuvre une vaccination
 B. Incidence pré- et post-vaccinale de maladies infectieuses communes
B. Incidence pré- et post-vaccinale de maladies infectieuses communes
 C. Modes d’immunisation
C. Modes d’immunisation
 D. Grandes dates de l’immunisation
D. Grandes dates de l’immunisation
 Figure
2 Introduction de la variolisation Figure
2 Introduction de la variolisation
 Figure 3
Figure 3
Vaccins vivants atténués
 Figure 4 Organismes entiers tués
Figure 4 Organismes entiers tués

 Figure 5
Figure 5
Vaccins sous-unitaires
 Figure 6 Modification de toxines en toxoïdes
Figure 6 Modification de toxines en toxoïdes
 Figure 7
Figure 7
Avantages et désavantages de l’immunisation passive
|
IMMUNITE ACTIVE
Ce terme fait référence à l’immunité produite par
l’organisme lui-même suite à l’exposition à des antigènes.
Immunité active
acquise de façon naturelle
L’exposition à divers pathogènes conduit à des
infections présentant des signes infra-cliniques ou cliniques qui ont
comme résultat la mise en place d’une réponse immunitaire protectrice
contre ces pathogènes.
Immunité active
acquise de façon artificielle
Une immunisation peut être obtenue en administrant
volontairement un pathogène tué ou attenué ou encore des composants de
ce pathogène. Les vaccins utilisés pour l’immunisation active utilisent
des organismes vivants (mais attenués), des organismes entiers tués, des
composants microbiens ou des toxines sécrétées qui ont été préalablement
détoxifiées.
Vaccins vivants
Le premier vaccin vivant utilisé a été le virus de
la vaccine introduit par Edward Jenner comme vaccin contre la
variole (voir la section sur le vaccin), mais la variolisation
(inoculation avec du pus provenant d'un patient présentant un cas
bénin de variole) était déjà utilisée depuis plus de mille ans
(Figure 2)
Les vaccins vivants sont utilisés contre un certain
nombre d'infections virales [la poliomyélite (vaccin Sabin), la
rougeole, les oreillons, la rubéole, la varicelle, l'hépatite A, la
fièvre jaune, etc…] (Figure 3). Le seul exemple de vaccin bactérien
vivant est celui contre la tuberculose (il s’agit de Mycobacterium
bovis encore appelé BCG pour Bacille de Calmette et Guérin).
Celui-ci est utilisé dans de nombreux pays africains, européens et
asiatiques, mais pas aux États-Unis. Alors que de nombreuses études
ont démontré l'efficacité du vaccin BCG, un certain nombre d'autres
études ont remis en question l’efficacité de cette vaccination.
Les vaccins vivants produisent normalement des
infections présentant symptômes infra-cliniques et une infection
autocontrôlée. Ils conduisent à la mise en place d’une immunité à la
fois humorale et cellulaire, cette dernière étant essentielle pour
les agents pathogènes intracellulaires. Toutefois, ils comportent un
risque sérieux : celui d'entraîner une maladie déclarée chez les
personnes immunodéprimées. En outre, dans la mesure où les vaccins
vivants sont souvent atténués (rendus moins pathogène) par passage
chez les animaux ou par mutation induite par un choc thermique, ils
peuvent parfois « reverter » (c’est à dire revenir à leur forme
pathogène) et entraîner des maladies graves. C'est pour cette raison
que le vaccin vivant (vaccin Sabin) contre la poliomyélite, qui a
été utilisé pendant de nombreuses années, a finalement été remplacé
dans de nombreux pays par un vaccin inactivé (vaccin Salk).
Vaccins tués
Les vaccins viraux tués par la chaleur, des
traitements chimiques ou une irradiation aux UV incluent ceux contre
la poliomyélite (vaccin Salk), la grippe, la rage, etc... La plupart
des vaccins bactériens sont constitués d’organismes tués (typhoïde,
choléra, peste, coqueluche etc…) (Figure 4).
Vaccins sous-unitaires
Certains vaccins anti-bactériens utilisent des
composants de la paroi cellulaire bactérienne purifiés (haemophilus,
coqueluche, méningocoque, pneumocoque, etc…) (Figure 5). Certains
vaccins viraux (hépatite-B, etc..) sont constitués de protéines
antigéniques purifiées obtenues en faisant exprimer un gène cloné
dans un vecteur approprié (par exemple dans la levure). Lorsque le
mécanisme pathogénique d'un microbe met en jeu une toxine, une forme
modifiée de la toxine qui a perdu sa toxicité tout en restant
immunogène (le toxoïde,) est utilisée en tant que vaccin (c’est le
cas par exemple pour la diphtérie, le tétanos, le choléra) (Figure
6). Ces vaccins sous-unitaires sont conçus pour limiter les
problèmes de toxicité. Chaque type de vaccin a ses propres avantages
et inconvénients (Figure 7).
Les vaccins sous-unitaires peuvent consister en des
protéines ou des polysaccharides. Comme les polysaccharides sont de
relativement faibles antigènes T-indépendants, et ne produisent que
des réponses IgM sans mémoire immunologique, ils sont souvent rendus
plus immunogènes et T-dépendants par conjugaison avec des protéines
(par exemple : haemophilus, méningocoque, pneumocoque, etc.)
Autres nouveaux types de vaccins
Un certain nombre de nouvelles approches pour
l'immunisation active sont au stade de la recherche fondamentale et
ne sont utilisés qu'à titre expérimental. Ceux-ci comprennent les
anticorps anti-idiotypes, les vaccins à ADN et l’utilisation des
peptides immunodominants (reconnus par les molécules du CMH). Ces
nouveaux types de vaccins pourront être disponibles à l'avenir.
-
Des anticorps anti-idiotypiques dirigés contre
des polysaccharides conduisent à la mise en place de réponses
immunitaires durables et présentant une mémoire immunologique
-
Les vaccins à ADN (gènes codant pour des
peptides viraux clonés dans des vecteurs) doivent être injectés.
Ils transfectent les cellules hôtes et, en conséquence,
produisent une réponse similaire à celle obtenue contre les
virus vivants atténués (immunité à médiation cellulaire et
humorale). Plusieurs vaccins à ADN anti-VIH ont été développés
mais aucun n'a jusqu'ici fait preuve de beaucoup d'efficacité.
-
Des peptides immunodominants sont simples et
faciles à préparer et, lorsqu'ils sont incorporés dans des
polymères, peuvent provoquer à la fois des réponses à médiation
humorale et cellulaire.
Adjuvants
Des antigènes faibles peuvent être rendus plus immunogènes par l'ajout
de produits chimiques. Ces produits chimiques sont connus comme étant
des adjuvants. Il y a beaucoup de substances biologiques et chimiques
qui ont été utilisées au niveau expérimental (Tableau 1). Toutefois,
seuls les sels d'aluminium (alun) sont homologués pour un usage chez
l’homme. C’est utilisé par exemple dans le vaccin DTP. En outre, la
coqueluche a intrinséquement des effets adjuvants. Les adjuvants
utilisés expérimentalement comprennent des mélanges d’huiles minérales
et de détergents, avec (adjuvant complet de Freund) ou sans (adjuvant
incomplet de Freund) adjonction de certaines bactéries. Les bactéries
les plus souvent utilisées dans les adjuvants sont les mycobactéries (BCG)
et Nocardia. Dans certains cas, des fractions subcellulaires de ces
bactéries peuvent également être utilisés efficacement comme adjuvants.
De nouvelles formulations adjuvantes sont formées par des polymères
synthétiques et des oligonucléotides. La plupart des adjuvants
reconnaissent les récepteurs de type Toll-like, activant ainsi les
phagocytes mononucléaires et permettant d’induire des cytokines
sélectives qui peuvent améliorer les réponses Th1 ou Th2 (selon la
nature de l'adjuvant).
|
Table
1. Adjuvants utilisés en clinique ou expérimentalement
|
|
Type d’ adjuvant |
Utilisation chez l’homme |
Utilisation expérimentale seulement |
|
Sels:
hydroxide d’aluminum, phosphate
d’aluminum
phosphate de calcium
|
Oui
Oui
Oui |
Relargage lent des antigènes,
interaction avec les TLR et induction de cytokines |
|
hydroxide de beryllium
|
Non
|
|
Particules synthétiques:
Liposomes, ISCOMs, polylactates
|
Non
Non
|
Relargage lent des antigènes |
|
Polynucléotides:
CpG et autres |
Non* |
Interaction avec les TLR et induction
de cytokines |
|
Produits bactériens:
B.pertussis
|
Oui |
Interaction avec les TLR et induction
de cytokines |
M. bovis (BCG et autres)
|
Non |
Huiles minérales
|
Non |
Dépôt d’antigènes |
|
Cytokines:
IL-1, IL-2, IL12,
IFN-γ, etc. |
Non* |
Activation et différenciation des cellules T et B et des APC |
*Utilisation
expérimentale dans des tumeurs humaines
|
L'immunité protectrice
conférée par le vaccin peut durer toute la vie (comme pour la rougeole,
les oreillons, la rubéole, la variole, la tuberculose, la fièvre jaune,
etc…) ou peut durer seulement quelques mois (le choléra). La
primo-vaccination peut être administrée à l'âge de 2 à 3 mois (diphtérie,
coqueluche, tétanos, polio), ou à 13-15 mois (oreillons, rougeole,
rubéole). Le calendrier actuellement recommandé (par les CDC et l’AIP)
pour la vaccination de routine aux Etats-Unis est résumé dans le Tableau
2. Ce calendrier est révisé sur une base annuelle ou si besoin par le
Comité consultatif du CDC sur les pratiques d'immunisation (AICP).
|
Table 2 Planning des
immunisations pour des enfants normaux* |
|
Age
Vaccin
|
Naissance |
Mois |
Ans |
|
1 |
2 |
4 |
6 |
12 |
15 |
18 |
19 -23 |
2-3 |
4-6 |
|
Hepatite-B 1 |
HeB |
HeB |
1 |
HeB |
|
|
HeB |
|
Rotavirus |
|
|
Rota |
Rota |
Rota |
|
|
|
|
|
|
Diphthérie, Tetanos, Coqueluche 3 |
|
|
DTaP |
DTaP |
DTaP |
3 |
DTaP |
|
|
DTaP |
|
Hemophilus influenzae-b
(CV) 4 |
|
|
Hib |
Hib |
Hib4 |
Hib |
|
|
Pneumocoques 5 |
|
|
PCV |
PCV |
PCV |
PCV |
|
PPV |
Poliovirus inactivé |
|
|
IPV |
IPV |
IPV |
|
|
IPV |
|
Grippe 6 |
|
|
|
|
Grippe (chaque année) |
|
|
Rougeole, Oreillons, Rubéole 7 |
|
|
MMR |
|
|
MMR |
MMR |
|
Varicelle
8 |
|
|
Var |
|
|
|
|
|
Hepatite A 9 |
|
|
|
|
|
Hep A (2 doses) |
Séries HepA |
|
Meningocoques 10 |
|
|
|
|
|
|
MCV4 |
|
* Recommandé par
l’Advisory Committee on Immunization , American Academy of Pediatrics (2008).
|
Plage d’âges recommandés |
Certains groupes à haut risques |
CDC
Immunization
schedules |
|

Adverse events occurring with 48 hours of DPT vaccination |
Immunisation prophylactique versus thérapeutique
La plupart des vaccins sont administrés à titre prophylactique, c'est à dire
avant l'exposition à l'agent pathogène. Cependant, certains vaccins peuvent être
administrés de façon thérapeutique, c'est à dire après l'exposition au pathogène
(exemple : le virus de la rage). L'efficacité de ce mode de vaccination dépend
de la vitesse de réplication de l'agent pathogène, la période d'incubation et le
mécanisme pathogénique. Une seule injection de rappel contre le tétanos est
suffisante si l'exposition à l'agent pathogène intervient moins de 10 ans après
la vaccination initiale et si l'exposition est minime (cas de blessures
relativement superficielles). Dans une situation où l'agent pathogène a une
période d'incubation courte, même une petite quantité de molécules pathogéniques
pourrait être fatale (par exemple, le tétanos et la diphtérie). Dans ce cas, à
la fois les vaccinations passives et actives post-exposition sont essentielles.
C'est aussi le cas quand la charge infectieuse est relativement importante.
La vaccination prophylactique passive est également courante en cas de déficits
immunologique, tels que les hypogammaglobulinémies.
Effets indésirables de l’immunisation
L’immunisation active peut entraîner l’apparition de fièvre, de malaise et
d'inconfort. Certains vaccins peuvent aussi causer des douleurs articulaires ou
de l'arthrite (rubéole), des convulsions qui peuvent parfois être fatales (coqueluche)
ou des troubles neurologiques (grippe). Les allergies aux œufs peuvent se
développer suite à l’administration de vaccins viraux cultivés sur des œufs (rougeole,
oreillons, grippe, fièvre jaune). Les rappels peuvent entraîner des effets
inflammatoires plus prononcés que la primo-vaccination. Des effets secondaires
graves ont été documentés après l'utilisation du vaccin DTP (Tableau 3). La
plupart d'entre eux étaient attribuables à la présence de l’agent de la
coqueluche dans le vaccin. Ces problèmes ont été résolus grâce à l'utilisation
d'une préparation acellulaire contre la coqueluche.
|
Table 3. Taux approximatifs
d’effets indésirables se produisant 48 heures après une vaccination DTP
|
|
Effet |
Fréquence |
|
Local |
| Rougeur, gonflement, douleur |
1 dose sur 2-3 |
|
Systémique légers/modérés |
| Fièvre somnolence, irritabilité |
1 dose sur 2-3 |
| Vomissements, anorexie |
1 dose sur 5-15 |
|
Systèmiques plus sérieux |
| Pleurs persistants, fièvre |
1 dose sur 100-300 |
|
Evanouissements, convulsions |
1 dose sur 1750 |
| Encéphalopathie aigüe |
1 dose sur 100.000 |
| Déficit neurologique permanent |
1 dose sur 300.000 |
|













