|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGY |
IMMUNOLOGY |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
VIDEO LECTURE |
IMMUNOLOGIE
– CHAPITRE SEPT
IMMUNOGLOBULINES : REACTIONS ANTIGENE-ANTICORPS ET TESTS EXPERIMENTAUX
POUR LA DETECTION DE CES RÉACTIONS
Gene Mayer,
Ph.D.
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Denis
Hudrisier, Ph.D.
Centre national de la recherche scientifique (CNRS) · Institute of
Pharmacology and Structural Biology
Université de Toulouse
|
|

 |
|
EN ANGLAIS |
|
EM PORTUGUES - PORTUGUESE |
|
SHQIP - ALBANIAN |
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|

 |
|
Logo image
© Jeffrey Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
LECTURE
Male et al. Immunology
7ème édition pp 67-74
|
|
OBJECTIFS DU COURS
Décrire la nature des réactions Ag-Ac
Comparer et faire la différence entre affinité et avidité des anticorps
Donner les bases de la spécificité et cross-réactivité des anticorps
Discuter les principes des tests communs pour analyser les réactions
Ag-Ac
 Figure 1
Figure 1 |
NATURE DES REACTIONS
ANTIGENE-ANTICORPS
Concept clé/serrure
Le site de liaison de l’anticorps est situé dans la
partie Fab de la molécule et formé par la mise en commun des régions
hypervariables (CDR) des chaînes lourdes et légères. Les études de
cristallographie aux rayons-X ont révélé que le déterminant antigénique
se nichait dans une gorge formée par le site de liaison de l’anticorps
comme illustré dans la Figure 1. Le concept des réactions
antigène-anticorps peut donc être assimilé à celui d’une clé (l’antigène)
qui s’insère dans une serrure (le site anticorps).
Liaisons non-covalentes
Les liaisons qui maintiennent l’antigène fixé dans le
site anticorps sont de nature non-covalente. Cela inclue des liaisons
hydrogènes, des liaisons électrostatiques, des forces de Van der Waals
et des liaisons hydrophobes. De multiples liaisons entre l’antigène et
l’anticorps assurent une interaction stable entre ces deux molécules.
Réversibilité
Comme les réactions antigène-anticorps se produisent par
l’intermédiaire de liaisons non-covalentes, elles sont par nature
réversibles.
|
|
Mots-clés
Affinité
Avidité
Spécificité
Cross réactivité
Agglutination
Hémagglutination
Agglutinines
Titre
Prozone
Hémagglutination passive
Test de Coomb direct
Test de Coomb indirect
Inhibition d’hémagglutination
Point d’équivalence
Excès d’anticorps
Excès d’antigènes
Immunodiffusion radiale
Immunoélectrophorèse
Contre-
immunoélectrophorèse
Radioimmuno-essai (RIA)
Enzyme linked
immunosorbent assay (ELISA)
RIA/ELISA par compétition
RIA/ELISA non-compétitif
Immunofluorescence
Cytométrie en flux
Fixation du complément
 Figure
2
Figure
2
 Figure
3
Figure
3
 Figure
4
Figure
4
 Figure
5
Figure
5 |
AFFINITE ET AVIDITE
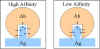
Affinité
L'affinité des anticorps est l'intensité de la réaction entre un
déterminant antigénique unique et un seul site de liaison de l'anticorps. Il
est la somme des forces d'attraction et de répulsion agissant entre le
déterminant antigénique et le site de liaison de l'anticorps tel que
représenté sur la Figure 2.
L’affinité est la constante d'équilibre qui décrit la réaction
antigène-anticorps, comme illustré dans la Figure 3. La plupart des
anticorps ont une forte affinité pour les antigènes.
Avidité
L'avidité est une mesure de la force globale de la liaison d'un antigène
possédant des déterminants antigéniques multiples avec des anticorps
polyvalents. L’avidité est influencée à la fois par la valence de
l'anticorps et la valence de l'antigène. L’avidité est supérieure à la somme
des affinités différentes. Ceci est illustré dans la Figure 4.
L’affinité fait donc référence à la force de liaison entre un déterminant
antigénique unique et un site anticorps individuel alors que l'avidité fait
référence à la force globale de la liaison entre les antigènes et les
anticorps multivalents.
SPECIFICITE ET CROSS-REACTIVITE
Spécificité
La spécificité fait référence à la capacité d’un site anticorps donné
à réagir avec un seul déterminant antigénique ou encore à la capacité
d’une population d’anticorps polyclonaux à réagir avec un seul antigène.
En général, il y a un fort degré de spécificité dans une interaction
antigène-anticorps. Les anticorps peuvent reconnaître des différences
entre :
- La structure primaire d’un antigène
- La nature isomérique d’un antigène
- Les structures secondaires et tertiaires d’un antigène
Cross-réactivité (ou réaction
croisée)
La cross-réactivité (encore appelée réaction croisée) fait référence
à la capacité d’un site anticorps donné à réagir avec plus d’un
déterminant antigénique ou encore à la capacité d’une population
polyclonale d’anticorps à réagir avec plus d’un antigène. La Figure 5
illustre comment des réactions croisées peuvent se produire. Elles
peuvent résulter de l’existence d’un épitope en commun entre l’antigène
donnant lieu à la réaction croisée et celui ayant servi à l’immunisation
ou encore de la reconnaissance d’un épitope possédant une structure
similaire dans l’antigène cross-réactif et l’antigène immunisant (multispécificité).
TESTS POUR LES RÉACTIONS
ANTIGENE-ANTICORPS
Facteurs affectant la mesure
des réactions antigène-anticorps
La seule façon de savoir si la réaction antigène-anticorps s’est
produite est de disposer de moyens directs ou indirects pour détecter
les complexes formés entre antigène et anticorps. La facilité avec
laquelle il sera possible de détecter les réactions antigène-anticorps
dépend de plusieurs facteurs.
Affinité
Plus l’affinité de l’anticorps pour l’antigène sera élevée et plus
l’interaction sera stable. Ainsi, la détection de cette interaction
sera facilitée.
Avidité
Les réactions entre les antigènes multivalents et les anticorps
multivalents sont plus stables et sont donc plus facilement
détectables.
|
 Figure
6
Figure
6 |
Rapport molécuaire antigène/anticorps
Le rapport moléculaire entre l’antigène et l’anticorps influence la
détection des complexes antigène-anticorps car la taille des
complexes formés dépend de la concentration de l’antigène et de
l‘anticorps. Cette relation est illustrée dans la Figure 6.
Nature physique de l’antigène
La nature physique de l'antigène influence la façon de mesurer sa
réaction avec l’anticorps. Si l'antigène est de nature particulaire,
on recherche généralement une agglutination de l'antigène par
l'anticorps. Si l'antigène est soluble, on privilégie la recherche
d’une précipitation de l'antigène après la production de larges
complexes antigène-anticorps insolubles.
|
 Figure 7
Figure 7 |
Tests d’agglutination
Agglutination/Hémagglutination
Lorsque l’antigène est de nature particulaire, la réaction de
l’anticorps avec l’antigène peut être détectée par des tests
d’agglutination de l’antigène. Le terme d’agglutinine est utilisé pour
décrire les anticorps qui agglutinent les antigènes particulaires. Quand
l’antigène est un érythrocyte, on utilise le terme d’hémagglutination.
Tous les anticorps peuvent théoriquement agglutiner des antigènes
particulaires mais les IgM, en raison de leur valence élevée, sont de
particulièrement bonnes agglutinines et on conclue souvent que
l’anticorps est de classe IgM lorsque de fortes agglutinations sont
détectées.
Test qualitatif
d’agglutination
Les tests d’agglutination peuvent être utilisés de façon qualitative
pour détecter la présence d’un antigène ou d’un anticorps.
L’anticorps est mélangé avec un antigène particulaire et le test est
positif si une agglutination de l’antigène particulaire se produit
(Figure 7).
Par exemple, les globules rouges d’un patient
peuvent être mélangés avec des anticorps dirigés contre des
antigènes définissant les groupes sanguins afin de déterminer le
groupe sanguin d’une personne. Dans un autre exemple, le sérum
d’un patient peut être mélangé avec des globules rouges de
groupes sanguins bien définis afin de savoir s’il existe des
anticorps dirigés contre tel ou tel groupe sanguin dans le sérum
du patient.
|
 Figure 8
Figure 8 |
Test quantitatif
d’agglutination
Les tests d’agglutination peuvent aussi être utilisés pour mesurer
la quantité d’anticorps dirigés contre un antigène particulaire.
Dans ces tests, des dilutions successives de l’échantillon dans
lequel on souhaite déterminer la quantité d’anticorps sont mélangés
à une quantité fixe de globules rouges ou de bactéries ou de tout
antigène particulaire pertinent. La dilution la plus forte
permettant d’avoir une agglutination est alors déterminée. Cette
dilution est appelée le « titre » en anticorps. Les résultats sont
présentés comme la réciproque de la dilution maximale donnant une
agglutination visible. La Figure 8 montre un test quantitatif
d’hémagglutination.
Effet de la prozone. Occasionnellement, on n’observe
pas d’agglutination aux fortes concentrations d’anticorps (c’est à
dire aux premières dilutions) et celle-ci n’apparaît qu’à des
dilutions plus fortes (voir par exemple le patient 6 dans la Figure
8). L’absence d’agglutination à forte concentration d’anticorps
s’appelle « effet de prozone ». L’absence d’agglutination dans la
prozone est due à un excès d’anticorps qui conduit à la formation de
complexes trop petits pour être visibles sous la forme d’une
agglutination.
|
| |
Applications des tests
d’agglutination
-
Détermination des groupes sanguins ou de la présence
d’anticorps contre des antigènes de groupes sanguins.
-
Diagnostique d’infections bactériennes
Par exemple, l’augmentation du titre en anticorps dirigés contre une
bactérie donnée indique qu’une infection par cette bactérie a eu
lieu. N.B. une augmentation d’un facteur quatre du titre en
anticorps contre une bactérie donnée est généralement retenue comme
la limite significative pour s’assurer de l’augmentation du titre en
anticorps.
Considérations pratiques
Bien que ce test soit facile à réaliser il donne seulement une
information semi-quantitative.
|
 Figure
9
Figure
9 |
Hémagglutination passive
Les tests d’agglutination ne marchent qu’avec des antigènes
particulaires. Toutefois, il est possible de recouvrir des
érythrocytes avec un antigène soluble (par exemple un antigène
viral, un polysaccharide ou un haptène) et d’utiliser les
érythrocytes ainsi recouverts d’antigène dans des tests
d’agglutination visant à rechercher la présence d’anticorps contre
l’antigène soluble (Figure 9). Ces tests sont appelés «
hémagglutination passive ». Les applications de ces tests se situent
au niveau de la détection d’anticorps contre des antigènes solubles
ou des antigènes viraux.
|
 Figure
10
Figure
10 |
Test de Coomb (ou test «
antiglobulines »)
Test direct de Coomb
Lorsque des anticorps se lient aux érythrocytes, il n'y a pas
toujours d’agglutination. Ceci peut être dû au rapport antigène /
anticorps (excès d'antigène ou excès d'anticorps ou, dans certains
cas, présence de charges électriques sur les globules rouges qui
empêchent la liaison transversale efficace des cellules entre elles
nécessaire à l’agglutination). Ces anticorps qui se lient, mais ne
provoquent pas d'agglutination des globules rouges sont parfois
appelés anticorps incomplets. Cela ne signifie pas, comme on l’avait
cru à un moment, que ces anticorps ont des structures différentes.
Il s'agit plutôt d'une définition purement fonctionnelle. Afin de
détecter la présence d'anticorps non agglutinants sur les globules
rouges, on ajoute simplement un second anticorps dirigé contre
l'immunoglobuline (anticorps) recouvrant les globules rouges. Cet
anticorps secondaire anti-immunoglobuline peut maintenant agréger
les globules rouges et conduire à l'agglutination. Ce test est
illustré dans la Figure 10 et est connu sous le nom de Test direct
de Coomb.
|
 Figure
11
Figure
11 |
Test indirect de Coomb
Quand il s’agit de savoir si un sérum contient des anticorps,
même non agglutinants, dirigés contre des globules rouges
particuliers, on utilise un test indirect de Coomb (Figure 11).
Ce test est réalisé en incubant les globules rouges avec le
sérum, puis en lavant les anticorps non liés et en ajoutant,
finalement, le réactif secondaire (anticorps anti-immunoglobulines)
pour agréger les cellules.
Applications
Les applications de ces tests incluent la détection d’anticorps
anti-facteur rhesus (Rh). Les anticorps contre le facteur Rh
n’agglutinent généralement pas les globules rouges. Ainsi les
globules rouges d’un enfant Rh+ né d’une mère Rh- (possédant
potentiellement des anticorps anti-Rh) peuvent être recouverts
avec les anticorps maternels. Pour révéler cela, un test direct
de Coomb peut-être réalisé. A l’inverse, pour savoir si la mère
possède des anticorps anti-Rh dans son sérum, un test indirect
de Coomb pourra être mis en oeuvre.
|
 Figure
12
Figure
12 |
Inhibition d’hémagglutination
Les tests d'agglutination peuvent être adaptés pour être utilisés avec
des antigènes solubles. Ce test est appelé test d’inhibition de
l'hémagglutination. Il est appelé inhibition de l'hémagglutination parce
que l'on mesure la capacité d'un antigène sous forme soluble à inhiber
l'agglutination de globules rouges portant le même antigène par des
anticorps dirigés contre l’antigène. Dans ce test, une quantité fixe
d'anticorps dirigés contre l'antigène en question est mélangé avec une
quantité fixe de globules rouges portant le même antigène (voir plus
haut le test d’hémagglutination passive). On inclue également dans le
mélange différentes quantités de l'échantillon à analyser pour la
présence de l'antigène. Si l'échantillon contient l'antigène, l'antigène
soluble entre en compétition avec l'antigène immobilisé sur les globules
rouges empêchant ainsi aux anticorps de se lier, ce qui se traduit par
une inhibition de l'agglutination des globules rouges (voir Figure 12).
En diluant l'échantillon, on peut mesurer la quantité d'antigène
présente dans l'échantillon à tester par son titre. Ce test est
généralement utilisé pour quantifier les antigènes solubles et est
soumis aux mêmes considérations pratiques que le test d'agglutination.
|
 Figure 13
Figure 13 |
Tests de précipitation
Immunodiffusion radiale (test de
Mancini)
Dans l’immunodiffusion radiale, un anticorps est incorporé dans un
gel d’agarose lorsque celui-ci est coulé et différentes dilutions
d’antigènes sont placés dans des puits creusés dans l’agarose. Au
fur et à mesure que l’antigène diffuse passivement depuis le puits
dans lequel il est déposé, il réagit avec l’anticorps et, quand le
point d’équivalence est atteint (c’est à dire quand les
concentrations relatives en antigène et en anticorps permettent la
formation de complexes antigènes-anticorps suffisamment gros pour
précipiter), un arc de précipitation se forme comme illustré dans la
Figure 13.
Le diamètre de l’arc de précipitation formé est proportionnel au
logarithme de la concentration en antigène puisque la quantité
d’anticorps est constante. Ainsi, en testant différentes
concentrations d’un antigène utilisé comme standard on peut générer
une courbe étalon à partir de laquelle on peut déduire la
concentration en antigène dans l’échantillon à tester. C’est donc un
test quantitatif. Si plusieurs arcs de précipitation apparaissent,
cela traduit le faut qu’il y a eu davantage qu’une interaction
antigène/anticorps. Cela peut être dû à la présence d’un mélange
d’antigènes ou d’anticorps. Ce test est utilisé classiquement en
clinique pour déterminer les taux d’anticorps dans les échantillons
biologiques provenant de patients.
|
 Figure
14
Figure
14 |
Immunoélectrophorèse
Dans l’immunoélectrophorèse, un mélange complexe d’antigènes est placé
dans un puits creusé dans un gel d’agarose puis ce mélange est soumis à
une électrophorèse permettant une séparation des antigènes en fonction
de leur charge. Après l’électrophorèse, une rigole est creusée dans le
gel et les anticorps y sont placés. Au fur et à mesure que les anticorps
diffusent passivement dans le gel, des lignes de précipitation se
forment dans la zone d’équivalence indiquant que la réaction antigène/anticorps
a eu lieu (voir Figure 14).
Ces tests sont utilisés pour l’analyse qualitative de
mélanges complexes d’antigènes (une évaluation brute quantitative étant
accessible par la mesure de l’épaisseur de la ligne de précipitation
formée). Ces tests sont utilisés communément pour l’analyse des
composants d’un sérum de patient. Le sérum est placé dans le puits et
les anticorps dirigés contre le sérum sont placés dans la rigole. En
comparant les résultats obtenus avec un sérum témoin, il est possible de
déterminer s’il existe des déficiences dans un ou plusieurs composants
du sérum chez le patient testé ou encore s’il existe une surabondance de
certains des composants de ce sérum (par mesure de l’épaisseur de la
ligne de précipité formée). Ce test peut aussi être utilisé pour évaluer
la pureté de protéines isolées du sérum.
|
 Figure
15
Figure
15 |
Electrophorèse à contre-courant
Dans cet essai, l'antigène et l'anticorps sont placés dans des puits
creusés dans un gel d'agarose et l'antigène et l'anticorps sont soumis à
une électrophorèse de l’un vers l'autre, au cours de laquelle ils
forment une ligne de précipitation comme cela est illustré dans la
Figure 15. Ce test ne peut être mis en ouevre que si les conditions
permettant à l'antigène et à l'anticorps de migrer en sens opposé sont
trouvées (c’est à dire s’ils ont des charges opposées). Ce test est
avant tout qualitatif, bien que de l'épaisseur de l’arc de précipitation
soit indicatif de la quantité. Son principal avantage réside dans sa
rapidité de réalisation.
|
 Figure
16
Figure
16
 Figure
17
Figure
17 |
Tests radioimmunologiques (RIA)
ou Immunoenzymatiques (Enzyme Linked Immunosorbent Assay, ELISA)
Les essais radioimmunologiques (RIA) sont basés sur la mesure de la
radioactivité associée aux complexes immuns. Dans n’importe lequel de
ces tests, un marqueur radioactif peut être placé sur l’antigène ou sur
l’anticorps. Dans les tests immunoenzymatiques (ELISA), on mesure des
réactions enzymatiques associées aux complexes immuns. Dans n’importe
lequel de ces tests, l’enzyme peut être attaché sur l’antigène ou sur
l’anticorps.
Test RIA/ELISA compétitifs pour la
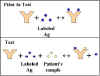
détection des antigènes
La méthode et le principe des tests RIA et ELISA pour la
quantification des antigènes sont illustrés dans la Figure 16. En
utilisant des quantités connues d’un antigène standard non-marqué,
on peut construire une courbe étalon de la radioactivité (cpm) ou de
l’activité enzymatique en fonction de la quantité d’antigène. A
partir de cette courbe étalon, on peut déterminer la quantité
d’antigène présente dans un échantillon donné.
La clé pour la réussite de ces tests est de pouvoir séparer les
complexes immuns des composants restants. Cela peut être réalisé de
différentes façons qui donnent souvent leur nom au test lui-même.
Précipitation au sulfate d’ammonium
Le sulfate d’ammonium (concentration finale 33 - 50%) pourra
précipiter les immunoglobulines mais pas la plupart des
antigènes. Cette méthode peut être utilisée pour séparer les
complexes immuns des antigènes libres. Cette méthode a aussi été
appelée test de Farr.
Anticorps anti-immunoglobuline
L’addition d’un anticorps secondaire dirigé contre le premier
anticorps ayant réagi avec l’antigène peut conduire à la
précipitation des complexes immuns formés et donc leur
séparation de l’antigène libre.
Immobilisation de l’anticorps
L’anticorps peut être immobilisé sur une bille de plastique ou
sur une plaque de plastique. Les complexes antigènes/anticorps
peuvent alors facilement être séparés des autres composants par
simple lavage des billes ou des plaques de plastique (Figure
17). C’est la méthode la plus usitée de nos jours : on l’appelle
RIA ou ELISA en phase solide. Dans les laboratoires d’analyse,
les tests compétitifs de RIA ou d‘ELISA sont communément
utilisés pour quantifier des protéines du sérum, des hormones,
des métabolites divers.
|
|
TUTORIEL
TEST ELIZA
HHMI
Requires Flash |
 Figure
18
Figure
18
 Figure
19
Figure
19 |
Tests RIA/ELISA
non-compétitifs pour la détection d’antigènes ou d‘anticorps
Des tests RIA et ELISA non-compétitifs
sont également utilisés pour la quantification des antigènes et des
anticorps. Comme montré dans la Figure 18, la bille de plastique
peut être recouverte d'antigène et est utilisée pour la détection
des anticorps dans un échantillon inconnu. La quantité du second
anticorps marqué lié à la bille est proportionnelle à la quantité
d'anticorps dans l'échantillon inconnu. Ce dosage est couramment
utilisé pour la quantification des anticorps de la classe IgE
dirigés contre des allergènes spécifiques en utilisant un allergène
connu comme source d'antigène et des anticorps anti-IgE comme
réactif marqué. C'est ce qu'on appelle le test RAST (RadioAllergoSorbent
Test). Comme indiqué dans la Figure 19, la bille de plastique peut
être recouverte d'anticorps et est utilisée pour mesurer un antigène
inconnu. La quantité du second anticorps marqué qui se lie est
proportionnelle à la quantité d'antigène liée au premier anticorps.
|
 Figure
20
Figure
20 |
Tests pour les
antigènes associés aux cellules
Immunofluorescence
L’immunofluorescence est une technique dans laquelle un anticorps
marqué par une molécule fluorescente (la fluorescéine ou la
rhodamine ou bien d’autres molécules fluorescentes encore) est
utilisé pour détecter la présence d’un antigène localisé dans ou sur
une cellule ou un tissu en mesurant la fluorescence émise par
l’anticorps lié.
Immunofluorescence
directe
En immunofluorescence directe, c’est l’anticorps spécifique de
l’antigène qui est directement marqué avec le fluorochrome
(Figure 20).
|
 Figure
21
Figure
21 |
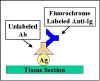
Immunofluorescence indirecte
Dans l’immunofluorescence indirecte, l’anticorps spécifique de
l’antigène n’est pas marqué mais c’est un anticorps secondaire
anti-immunoglobuline dirigé contre l’anticorps spécifique de
l’antigène qui est marqué avec le fluorochrome (Figure 21).
L’immunofluorescence indirecte est plus sensible que
l’immunofluorescence directe car il y a amplification du signal
de fluorescence.
|
 Figure
22
Figure
22 |
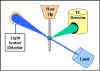
Cytométrie en flux
La cytométrie en flux est communément utilisée dans les laboratoires
d’analyse et de recherche pour identifier et énumérer les cellules
exprimant des antigènes particuliers. Les cellules en suspension sont
marquées avec un ou plusieurs anticorps fluorescents en suivant les
modes directs ou indirects comme pour l’immunofluorescence. Les cellules
sont alors analysées par un cytomètre en flux.
La Figure 22 illustre le principe de la cytométrie en
flux. Dans un cytomètre de flux, les cellules sortent une à une d’une
gaine d'écoulement et sont éclairées par un faisceau laser. La quantité
de lumière laser qui est réfléchie par les cellules alors qu’elles
passent devant le laser peut être mesurée, ce qui donne des informations
concernant la taille des cellules. En outre, le laser peut exciter le
fluorochrome fixé sur les cellules et la lumière fluorescente émise par
les cellules peut alors être mesurée par un ou plusieurs détecteurs.
|
 Figure
23
Figure
23 |
Le type de données qui est obtenu à
partir de la cytométrie en flux est représenté dans la Figure
23. Sur un histogramme d’analyse mono-paramétrique, l’intensité
de fluorescence (fluorescence verte par exemple) est représentée
sur l'axe des x et le nombre de cellules présentant la quantité
de fluorescence est reporté sur l'axe des y. Le pourcentage de
cellules fluorescentes peut être déterminé par l'intégration de
l'aire sous la courbe. Dans un histogramme bi-paramétrique,
l'axe x représente un paramètre de fluorescence (par exemple
fluorescence rouge) et l'axe des y est le second paramètre (par
exemple la fluorescence verte). Le nombre de cellules est
indiqué par le contour et l'intensité de la couleur.
|
 Figure
24
Figure
24
 PowerPoint animation of figure 24 of this figure
PowerPoint animation of figure 24 of this figure |
Réaction de
fixation du complément
Les complexes antigènes/anticorps peuvent également être
quantifiés par leur capacité à fixer le complément, car un complexe
antigène/anticorps va "consommer" le complément si celui-ci est ajouté à
la solution, alors que les antigènes ou des anticorps libres ne peuvent
consommer le complément. Les tests de détection des complexes antigènes/anticorps
basés sur la consommation du complément sont appelés « réactions de
fixation du complément » et sont utilisés pour quantifier indirectement
les réactions antigène/anticorps. Ces tests ne fonctionnent qu'avec les
anticorps ayant la propriété de fixer le complément (ce sont les IgG et
les IgM qui fixent le plus efficacement le complément).
Le principe du test de fixation du complément est
illustré dans la Figure 24. L’antigène est mélangé dans un tube avec le
sérum dans lequel on souhaite doser les anticorps et les complexes
antigènes/anticorps peuvent alors se former. Un tube témoin dans lequel
aucun antigène n’est ajouté est également préparé. Si aucun complexe
antigène/anticorps n’est formé dans le tube, le complément ajouté dans
le tube ne pourra être fixé et sera disponible sous forme libre. Par
contre, si des complexes antigène/anticorps sont formés, ils pourront
fixer le complément et ainsi réduire la quantité de complément libre
présente dans le tube. Après avoir laissé le temps aux complexes
antigène/anticorps de fixer le complément, une quantité standard de
globules rouges, préalablement recouverts d'anticorps anti-érythrocytaires,
est ajoutée. La quantité de globules rouges recouverts d’anticorps est
prédéterminée pour être juste suffisante pour utiliser tout le
complément ajouté initialement dans le tube. Si tout le complément est
encore présent (c'est à dire s’il n’y a pas de complexes antigènes/anticorps
formés entre l'antigène et l'anticorps en question), tous les globules
rouges seront alors lysés. Par contre, si des complexes antigènes/anticorps
sont formés entre l'antigène et l'anticorps en question, une partie du
complément sera consommée par ces complexes et, par conséquent, lorsque
les globules rouges recouverts d’anticorps seront ajoutés, il restera
moins de complément disponible pour conduire à la lyse des globules
rouges et moins de globules rouges seront lysés. En mesurant tout
simplement la quantité de globules rouges lysés (rce qui peut être
obtenu en dosant la libération de l'hémoglobine dans le milieu), on peut
quantifier indirectement la formation des complexes antigènes/anticorps
dans le tube. Les tests de fixation du complément sont le plus
couramment utilisés pour le dosage des anticorps dans un échantillon
biologique, mais ils peuvent aussi être adaptés pour quantifier
l'antigène.
|
| |
 Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
This page last changed on
Tuesday, November 27, 2012
Page maintained by
Richard Hunt
Please report any problems to
richard.hunt@uscmed.sc.edu
|
|


|
|

 Figure
6
Figure
6 Figure 8
Figure 8 Figure
12
Figure
12 Figure 13
Figure 13 Figure
16
Figure
16
 Figure
20
Figure
20 Figure
21
Figure
21 Figure
22
Figure
22 Figure
24
Figure
24




