|
x |
x |
|
 |
 |
|
|
BACTERIOLOGÍA |
INMUNOLOGÍA
|
MICOLOGÍA |
PARASITOLOGÍA |
VIROLOGÍA |
|
EN INGLÉS |
INMUNOLOGÍA – CAPÍTULO
2
COMPLEMENTO
Dr Gene Mayer
Traducido por:
Carla Cervantes
Camacho y Dr. Fernando Enríquez Rincón
Centro de Investigación y de Estudios Avanzados del IPN
|
|
VIDEOCONFERENCIA
EN INGLÉS |
|
CENTRO
DE INVESTIGACION Y DE ESTUDIOS AVANZADOS DEL IPN |
|
BUSCAR |
|
E-MAIL
DR FERNANDO ENRIQUEZ-RINCON |
|
Let us know what you think
FEEDBACK |
|
|
|
OBJETIVOS DE ENSEÑANZA
Entender las diferentes vías de activación del Complemento (C).
Conocer los mecanismos enzimáticos y no enzimáticos de la activación del
Complemento.
Conocer las propiedades biológicas de los productos de la activación del
complemento.
Conocer el significado del Complemento del huésped, en los mecanismos de
resistencia, inflamación y daño a si mismo.
Entender los mecanismos de regulación de la activación del Complemento y
de sus productos.
 Jules
Bordet (1870-1961), descubridor del complemento
National
Library of Medicine
Jules
Bordet (1870-1961), descubridor del complemento
National
Library of Medicine
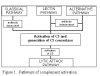 Figura 1
Figura 1
Vías de la activación del complemento |
FUNCIONES DEL COMPLEMENTO
Historicamente, el término complemento (C) fue usado para referirse a un
componente sérico termolábil capaz de lisar bacterias cuya actividad es
destruida (inactivada) al calentar el suero a 56 grados C durante 30 minutos.
Sin embargo, el complemento como lo conocemos ahora, contribuye a las defensas
del cuerpo también en otras formas. El complemento puede
opsonizar bacterias para favorecer la fagocitosis de las mismas; puede
reclutar y activar varias células incluyendo a las células polimorfonucleares (PMNs)
y macrófagos; puede participar en la regulación de las respuestas de anticuerpos
y puede ayudar a la eliminación de los complejos inmunes y células
apoptoticas . El complemento puede también tener efectos nocivos para el
organismo pues contribuye al proceso inflamatorio y al daño de los tejidos al
desencadenar la anafilaxia.
El complemento está compuesto, hasta donde se sabe actualmente, por más de 20
diferentes proteínas séricas (ver Tabla 1) que son producidas por una variedad
de células incluyendo a los hepatocitos, macrófagos y células del epitelio
gástrico. Algunas de las proteínas del complemento se unen las inmunoglobulinas
o a los componentes de la membrana de las células. Otras son
proenzimas que cuando son activadas, rompen a otras proteínas del
complemento. El rompimiento de estas proteínas del complemento produce
fragmentos que activan a algunas células, aumentan la permeabilidad vascular y
opsonizan bacterias.
|
Tabla 1. Proteínas
del Sistema del Complemento
|
|
Vía Clásica |
Vía de la Lectina |
Vía Alterna |
Lisis |
|
Proteinas de Activación:
C1qrs, C2, C3, C4
Proteins de Control:
C1-INH, C4-BP
|
Proteína de unión a manana (MBP),
serina proteasa asociada a manana (MASP, MASP2) |
C3, Factores B y D*, Properdina (P)
Factores I* y H, factor acelerador del decaimiento (DAF),
receptor del complemento 1 (CR1), etc. |
C5, C6, C7, C8, C9
Proteína S |
|
Los componentes subrayados adquieren actividad enzimática cuando
son activados.
Los componentes marcados con asterisco tienen actividad enzimática en su forma
nativa.
|
|
| |
VÍAS DE LA ACTIVACIÓN DEL COMPLEMENTO
La activación del complemento puede dividirse en cuatro vías (figura 1): la
vía clásica, la vía de la lectina, la vía alterna y la vía de ataque a la
membrana (v ía lítica). Tanto las vía clásica como la alterna conducen a la
activación de C5 convertasa y resultan en la producción de C5b que es esencial
para la activación de la vía de ataque a la membrana.
|
|
MOVIE
Complement Activation and Biological Functions
High Resolution
Quicktime
Low Resolution Quicktime
© Scott R. Barnum, University of Alabama, Birmingham, Ala., USA and
The
MicrobeLibrary
|
|
CGAP
More
detailed complement pathways from CGAP/Biocarta |
VÍA CLÁSICA (Figura 2)
Activación de C1
C1 es una proteína multi-subunitaria que contiene tres diferentes proteínas
(C1q, C1r y C1s), se une a la región Fc de las moléculas de anticuerpos IgG
e IgM que han reaccionado con el antígeno. El
enlace de C1 al anticuerpo no ocurre si no está formado el complejo
antígeno-anticuerpo, además el enlace de C1 al anticuerpo requiere de iones
de calcio y magnesio. (N.B. En algunos casos C1
puede enlazarse a agregados de inmunoglobulinas
[como IgG agregada] o a la superficie de ciertos
patógenos aún en ausencia de anticuerpos). La unión de C1 a los anticuerpos
es vía C1q la cual debe enlazar a por lo menos dos moléculas de anticuerpos
para permitir su fijación firme. La unión de C1q resulta en la activación
de C1r que a su vez activa C1s. El resultado es la formación de una “C1qrs”
activada, la cual es una enzima que rompe a C4 en los fragmentos C4a y C4b.
Activación de C4 y C2 (generación de
C3 convertasa)
El fragmento C4b se une a la membrana y el fragmento C4a se libera al medio
ambiente. La “C1qrs” activada también actúa sobre C2 y lo degrada a C2a y
C2b. C2a se une a la membrana en asociación con C4b, y C2b es liberado al
medio ambiente. El complejo C4bC2a resultante es una C3 convertasa, que
rompe a C3 en C3a y C3b.
Activación de C3 (generación de C5
convertasa)
El fragmento C3b se une a la membrana en asociación con C4b y C2a, y el C3a
es liberado al microambiente. El complejo C4bC2aC3b resultante es una C5
convertasa. La generación de C5 convertasa marca el final de la vía
clásica.
Muchos de los productos de la vía
clásica tienen actividades biológicas importantes que contribuyen a las
defensas del cuerpo. Algunos de estos productos pueden también tener efectos
dañinos si se producen de manera no regulada. La Tabla 2 resume las
actividades biológicas de los componentes de la vía clásica.
|
Tabla 2. Actividad
biológica de los productos de la vía clásica |
|
Componente |
Actividad
Biológica |
| C2b |
Procinina; es rota por la
plasmina para producir la cinina, lo cual lleva a la formación del
edema |
| C3a |
Anafilatoxina; puede
activar a los basófilos y a células cebadas produciendo su
degranulación la cual incrementa la permeabilidad vascular y la
contracción del músculo liso; todo esto puede producir anafilaxis |
| C3b |
Opsonina; promueve la fagocitosis al
unirse a los receptores del complemento
Activación de células fagocíticas |
| C4a |
Anafilatoxina; de actividad
similar a C3a pero más débil |
| C4b |
Opsonina; promueve la
fagocitosis por enlace a receptores de complemento |
Si la vía
clásica no fuera regulada, continuaría la producción e C2b, C3a y C4a. Por
tanto, debe haber alguna vía que regule la actividad de la vía clásica. La Tabla
3 resume las formas por las cuales la vía clásica es regulada.
|
Tabla 3. Regulación de la
vía clásica del complemento |
| Componente |
Regulación |
| Todos |
C1-INH; Disocia C1r y C1s
de C1q |
| C3a |
C3a inactivador
(C3a-INA;Carboxypeptidasa B); inactiva C3a |
| C3b |
Factors H and I; Factor H
facilitates the degradation of C3b by Factor I |
| C4a |
C3-INA |
| C4b |
Proteína de union a C4 (4-BP) y
Factor I; C4-BP facilita la degradación de C4b por el Factor I;
C4-BP también previene la asociación de C2a con C4b bloqueando por
lo tanto la formación de C3 convertasa |
La importancia de C1-INH en la
regulación de la vía clásica está demostrada por el resultado de una deficiencia
en este inhibidor. Las deficiencias de C1-INH están asociada con el desarrollo
del angioedema hereditario.
|

A.
Generación de C3 convertasa en la vía clásica
 B. Generación de C5 convertasa en la vía clásica
B. Generación de C5 convertasa en la vía clásica
 C. C.
Activación de C3 por la vía clásica
Figura 2
|
 Figura 3 Vía iniciada por la lectina
Figura 3 Vía iniciada por la lectina |
VÍA DE LA LECTINA
La vía de la lectina (figura 3) es
muy similar a la vía clásica. Se inicia por el enlace de la lectina de unión
de manosa (MBL) a la superficie de las bacterias que contiene polisacáridos
ricos en este carbohidrato. El enlace de la lectina al patógeno produce la
asociación de dos serinas proteasas, MASP-1 y MASP-2 (proteasas de serina
asociadas a MBL). MASP-1 y MASP-2 son similares a C1r y C1s, respectivamente
y MBL es similar a C1q. La formación del complejo trimolecular MBL/MASP-1/MASP-2
produce la activación de las MASPs y la subsecuente ruptura de C4 en C4a y
C4b. El fragmento C4b se enlaza a la membrana y el fragmento C4a es liberado
al medio. Las MASPs activadas también rompen C2 en C2a y en C2b. C2a se
enlaza a la membrana en asociación con la C4b, mientras que C2b es liberada
al microambiente. El complejo C4bC2a resultante es una C3 convertasa, la
cual rompe C3 en C3a y C3b. C3b se enlaza a la membrana en asociación con
C4b y C2a, mientras que C3a es liberado al microambiente. El complejo
resultante C4bC2aC3b es una C5 convertasa. Con la generación de C5
convertasa concluye la vía de la lectina.
Las actividades biológicas y las proteínas
reguladoras de la vía de la lectina son las mismas que las de la vía
clásica.
|
 Figura
4 Activación espontánea de C3 Figura
4 Activación espontánea de C3 |
VÍA ALTERNA
La vía alterna se inicia con la activación de C3 y requiere de los Factores
B y D y del catión Mg++, todos presentes en el suero normal.
Circuito de amplificación de la formación de C3b
(Figura 4)
En el suero hay un bajo nivel de hidrólisis
espontánea de C3 para producir C3i. El factor B enlaza a C3i
haciéndose susceptible a la acción del factor D, el cual rompe el
Factor B produciendo Bb. El complejo C3iBb actúa como una C3
convertasa y rompe C3 en C3a y C3b. En cuanto C3b es formado, el
factor B se enlazará a él, y será susceptible de ser roto por el
factor D. El complejo C3bBb resultante es una C3 convertasa que
continuará generando más C3b, produciéndose una amplificación de la
generación de C3b. si este proceso no para, el resultado podría ser
que se consuma todo el C3 del suero. De manera que la producción
espontánea de C3b está estrechamente controlada.
|

 Figura 5
Figura 5
Regulación de la activación de C3 por DAF
 Figura
6 Regulación de la activación de C3 por Cr1 Figura
6 Regulación de la activación de C3 por Cr1
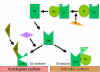 Figura
7 Estabilización de la C3 convertasa Figura
7 Estabilización de la C3 convertasa
 Figura 8
Figura 8
C5 convertasa estabilizada en la vía alterna |
Control de los circuitos de amplificación
(Figuras 5 y 6)
Como el
C3b producido espontáneamente se enlaza a las membranas autónomas del
huésped e interactúa con DAF (factor acelerador del decaimiento), el cual
bloquea la asociación del factor B con el C3b, consecuentemente, previene la
formación de la C3 convertasa. Adicionalmente, DAF acelera la disociación de
Bb de C3b en la C3 convertasa que ya se haya formado, lo que para la
producción de C3b adicional. Algunas células poseen receptor complementario
1 (CR1). El enlace de C3b y CR1 facilita la degradación enzimática de C3b
por el factor I. Adicionalmente, el enlace de la C3 convertasa C3bBb) a CR1
también disocia Bb del complejo. En células que poseen receptores de
complemento, CR1 también juega un papel en el control en el circuito de
amplificación. Finalmente, el factor H puede enlazar a C3b a una célula o en
la fase líquida y facilita la degradación enzimática de C3b por el factor I.
El circuito de amplificación está controlado tanto por el bloqueo de la
formación de la C3 convertasa como por la disociación de la C3 convertasa o
por la digestión enzimática de C3b. La importancia de controlar esta
amplificación está ilustrada en pacientes con deficiencia genética de factor
H o factor I. Estos pacientes tienen un déficit de C3 y esto incrementa su
susceptibilidad a ciertas infecciones.
Estabilización de la C convertasa por las
superficies activadoras (protectoras) (Figura 7)
Cuando se
enlaza un activador apropiado de la vía alterna, C3b enlazará al Factor b,
el cual será roto enzimáticamente por el Factor D para producir C3
convertasa (C3bBb). Sin embargo, C3b es resistente a la degradación por el
factor I y la C3 convertasa no es rápidamente degradada, sino que es
estabilizada por la superficie activadora. El complejo es estabilizado
posteriormente por la Properdina que enlaza a C3bBb. Los activadores de la
vía alterna son componentes que están sobre la superficie de los patógenos e
incluyen: lipopolisacáridos (LPS) en bacterias gram negativas y las paredes
celulares de algunas bacterias y levaduras. De esta manera, cuando C3b se
enlaza a la superficie activadora, la C3 convertasa formada, será estable y
continuará generando C3a adicional y C3b por ruptura de C3.
Generación de C5 convertasa
(Figura 10)
Algunas de
las C3b generadas por la C3 convertasa estabilizada cobre la superficie
activadora asociada con el complejo C3bBb par formar un complejo C3b BbC3b.
Este complejo es una C5 convertasa de la vía alterna. La generación de C5
convertasa es el final de la vía alterna. La vía alterna puede ser activada
por muchas bacterias gram negativas (las más significativas son: Neisseria
meningitidis y Neisseria gonorrhoea), ciertos virus y parásitos, resultando
en la lisis de estos organismos. De tal forma que la vía alterna por la
activación de C provee otra manera de protección contra ciertos patógenos
antes que una respuesta de anticuerpos sea montada. Una deficiencia en los
resultados de C3 es una incrementada susceptibilidad a estos organismo. La
vía alterna puede ser más primitiva que la vía clásica y la de la lectina,
que probablemente derivaron de ella. |
| |
|
| |
Recuerde que la vía alterna provee de un
mecanismo de resistencia no específico a las infecciones sin la participación de
anticuerpos, por lo tanto representa la primera línea de defensa contra un buen
número de agentes infecciosos.
Muchas bacterias
gram negativas y algunas
gram positivas, ciertos virus, parásitos, eritrocitos heterólogos,
inmunoglobulinas agregadas (particularmente IgA) y algunas otras proteínas (por
ej. proteasas, productos de la coagulación) pueden activar la vía alterna. Una
proteína, el factor veneno de cobra (CVF), ha sido ampliamente estudiado por su
habilidad para activar esta vía.
|
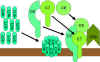 Figura
9
Figura
9
La vía lítica |
VÍA DEL ATAQUE A LA MEMBRANA (LÍTICA)
(Figura 9)
La C5
convertasa de la vía clásica (C4b2a3b), de la vía de la lectina (C4b2a3b) o de
la vía alterna (C3bBb3b) rompe C5 en C5a y c5b. C5a permanece en la fase líquida
y la C5b se asocia rápidamente con C6 y C7 y se inserta en la membrana.
Subsecuentemente C8 se enlaza, seguida de varias moléculas de C9. Las moléculas
de C9 forman un poro en la membrana a través del cual el contenido celular se
escapa y ocurre la lisis de la célula. La lisis no se da por un proceso
enzimático, sino que se da a través de un daño físico a la membrana. El complejo
consiste de C5bC6C7C8C9 y es referido como un complejo de ataque a la membrana (MAC).
El C5a
generado en la vía lítica tiene varias potentes actividades biológicas. La más
potente es la actividad de
anafilatoxin. Adicionalmente, es un factor
quimiotáctico para los neutrófilos y estimula el estallido respiratorio en ellos
y la producción de citocinas inflamatorias por macrofagos. Sus actividades son
controladas por la inactivación de carboxipeptidasa B (C3-INA).
Algunas de los
complejos C5b67 formados pueden disociarse de la membrana y pasar a la fase
fluida. Si esto llega a ocurrir, entonces este complejo se puede adherir a otra
célula cercana y producirle lisis. El daño a células circundantes propias, se
previene con la Proteina S (vitronectina). La proteína S se une a C5b67 soluble
para prevenir su adhesión a otras células.
|
 Figura
10 Regulación de C1rs (C4 convertasa) por C1-INH Figura
10 Regulación de C1rs (C4 convertasa) por C1-INH |
Productos de la activación del complemento con actividad biológica
La activación del complemento resulta en la
producción de varias moléculas biológicamente activas que contribuyen a la
resistencia,
anafilaxis e inflamación.
Producción de
Cinina
La molécula C2b generada durante la activación del C por la vía clásica es una
procinina que se activa después de ser modificada enzimáticamente por la
plasmina. La producción excesiva de C2b se previene al limitar la activación de
C2 por el inhibidor de C1q (C1-INH) también conocido como serpina el cual
desplaza a C1rs del complejo C1qrs (Figura 10). La deficiencia genética de
C1-INH resulta en una sobreproducción de C2b y es la causa del edema
angioneurótico hereditario. Esta condición puede ser tratada con
Danazol que promueve la producción de C1-INH o con ácido ε-amino capróico
que disminuye la actividad de la plasmina. |
|
|
Anafilatoxinas
C4a, C3a y C5a (en orden ascendente de actividad) son anafilatoxinas que causan
la desgranulación de los basófilos/células cebadas y la contracción de músculo
liso. Los efectos indeseables de estos péptidos son controlados la
carboxipeptidasa B(C3a-INA).
Factores quimiotácticos
C5a y MAC (C5b67) son ambos quimiotácticos. C5a también es un potente activador
de neutrófilos, basófilos y macrófagos e induce la adhesión de moléculas a las
células del endotelio vascular.
Opsoninas
C3b y C4b en la superficie de los microorganismos se unen al receptor C (CR1)
de las células fagocíticas y promueven la fagocitosis.
Otros productos de la activación de C
Los productos de la degradación de C3 (iC3b,
C3d y C3e) también se unen a diferentes células a través de distintos receptores
y modulan sus funciones.
En suma, el sistema del complemento
participa tanto en la resistencia específica como no-específica y genera
numerosos productos de importancia biológica y patofisiológica (Tabla 4).
Se conocen las deficiencias genéticas de la
mayoría de los componentes individuales del complemento, sin embargo, la
deficiencia de C3 es la más seria y fatal. Las deficiencias de complemento
también se presentan en enfermedades por complejos inmunes (por ej. el lupus
eritematoso sistémico) y en las infecciones bacterianas, virales y parasitarias
agudas y crónicas. |
|
|
|
|
|
| Tabla
4. Actividades de los productos de activación del complemento y
sus factores de control |
| Fragmento |
Actividad |
Efecto |
Factor (es) de Control |
| C2a |
Procinina, acumulación de
líquidos |
Edema |
C1-INH |
| C3a |
Desgranulación de basófilos y
células cebadas; aumento de permeabilidad vascular, contracción
de músculo liso |
Anafilaxia |
C3a-INA |
| C3b |
Opsonina, activación de
fagocitos |
Fagocitosis |
Factor H y Factor I |
| C4a |
Desgranulación de basófilos y
células cebadas; aumento de permeabilidad vascular, contracción
de músculo liso |
Anafilaxia
(menos potente) |
C3a-INA |
| C4b |
Opsonina |
Fagocitosis |
C4-BP y Factor I |
| C5a |
Desgranulación de basófilos y
células cebadas; aumento de permeabilidad vascular, contracción
de músculo liso |
Anafilaxia
(más potente)
|
C3a-INA |
| Quimiotaxis, estimulación del
estallido respiratorio, activación de fagocitos, estimulación de
citocinas inflamatorias |
Inflamación |
| C5bC6C7 |
Quimiotaxis |
Inflamación |
Proteína S (vitronectina) |
| Unión a otras membranas |
Daño de Tejidos |
|
|
Usted
deberá haber aprendido
Las
proteínas que conforman el sistema del complemento
Las
diferencias y semejanzas entre las diferenmtes vías de activación de C3
El
significado biológico de las diferentes vías en la inmunidad específica
y no-específica
El papel
de los diferentes productos de la activación del complemento en la
amplificación de la inmunidad específica y no-específica y en la
inflamación
|
| Tabla
5. Enfermedades por deficiencias de complemento |
| Vía/Componente |
Enfermedad |
Mecanismo |
| Vía Clásica |
|
| C1INH |
Angioedema hereditario |
Sobreproducción de C2b (procinina) |
| C1, C2, C4 |
Predisposición a Lupus
Eritematoso Sistémico (SLE) |
Opsonización de complejos
inmunes para mantenerlos solubles, su deficiencia resulta en la
acumulación de precipitados en los tejidos e incremento de la
inflamación |
| Vía de la lectina |
|
| MBL |
Susceptibilidad a infecciones
bacterianas en niños o en pacientes inmunodeprimidos |
Incapacidad para iniciar la
vía de la lectina |
| Vía Alterna |
|
| Factores B o D |
Susceptibilidad a infecciones
piógenas bacterianas (formadoras de pus) |
Insuficiente opsonización de
bacterias |
| C3 |
Susceptibilidad a la
infecciones por bacterias. |
Insuficiente opsonización e
incapacidad para utilizar la vía del ataque a membrana |
| C5, C6, C7, C8 y C9 |
Susceptibilidad a infecciones
por bacterias gram negativas |
Incapacidad de atacar la
membrana de las bacterias gram-negativas |
| Properdina (X-linked) |
Susceptibilidad a meningitis
meningocócica |
Insuficiente opsonización de
bacterias |
| Factores H o I |
Deficiencia de C3 y
susceptibilidad a infecciones bacterianas |
Activación descontrolada de la
vía C3 alterna provocando el consumo de C3 |
|
|
|
 Regreso a la sección de Inmunológica
Microbiología e Inmunología on line
Regreso a la sección de Inmunológica
Microbiología e Inmunología on line
|


 Figura 3 Vía iniciada por la lectina
Figura 3 Vía iniciada por la lectina
 Figura 5
Figura 5 Figura
10 Regulación de C1rs (C4 convertasa) por C1-INH
Figura
10 Regulación de C1rs (C4 convertasa) por C1-INH


