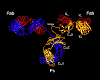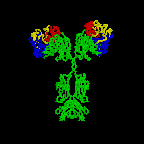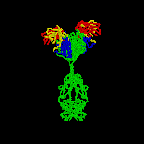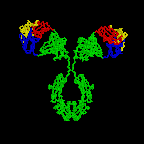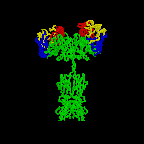|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
|
İMMÜNOLOJİ- BÖLÜM DÖRT
İMMÜNGLOBULİNLER- YAPI VE FONKSİYONLARI
Gene Mayer, Ph.D
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Çeviri:
Doç. Dr. Erkan Yula
İzmir, Katip Çelebi Üniversitesi, Tıp Fakültesi, Tıbbi Mikrobiyoloji
Anabilim Dalı
|
|
ENGLISH |
|
FRANCAIS |
|
PORTUGUES |
|
SHQIP |
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
| ÖĞRENİM
HEDEFLERİ
Tüm immüngloblunlerin genel özelliklerini anlatmak
İmmüngloblunlerin temel özelliklerini tanımlamak
immünglobulunlerin yapısı ile fonksiyonlarını ilişkilendirmek
aşırı değişken ve çatı bölgelerini tanımlamak
immünglobulin sınıf ve altsınıflarını, tip ve alt tiplerini tanımlamak
immünglobulin sınıflarının yapı ve özelliklerini tanımlamak
 Şekil 1 Serum proteinlerinin elektroforetik ayrıştırılması
Şekil 1 Serum proteinlerinin elektroforetik ayrıştırılması |
TANIM
İmmünglobulin (Ig)
İmmünglobulinler, immünojenlere cevap olarak plazma hücrelerinden
üretilen ve antikor olarak görev yapan glikoprotein yapısındaki
molekülleridir. İmmünglobulin ismi, antikor içeren serumaelektroforez
yapıldığında globüler proteinlerle birlikte göç etmesinden ileri
gelmektedir (Şekil 1).
İMMÜNGLOBULİNLERİN GENEL FONKSİYONLARI
Antijen bağlama
İmmünglobulinler spesifik olarak tek bir veya az sayıda yakın ilişkili
antijenlere bağlanır.Aslında her bir immünglobulin spesifik bir
antijenik bölgeye bağlanır.Antikorlar tarafından antijen bağlama,
antikorların primer fonksiyonudur ve konak savunmasına yarar.Bir
antikorun valansı (birleşme değeri) her bir antikor molekülünün
bağlayabileceğini antijenik determinantların sayısı ile belirlenir.Tüm
antikorlarınvalansı en az iki ve bazı durumlarda daha fazladır.
Etkin (efektör)
fonksiyonları
Genellikle bir antikorun antijenle bağlanması direkt bir biyolojik
etkiye sebep olmaz. Aksine, biyolojik etkiler antikorun sekonder efektör
fonksiyonlarının bir sonucudur. İmmünglobulinler çeşitli efektör
fonksiyonlara aracılık eder.Genellikle belirli bir efektör fonksiyonu
gerçekleştirmesi için antikorun antijenine bağlanması gerekir. Her
immünglobulin tüm efektör fonksiyonları yerine getiremez.
Bu efektör
fonksiyonlar
-
Kompleman fiksasyonu- hücrelerin lizisiyle ve
biyolojik aktif moleküllerin salınımıyla sonuçlanır(bölüm ikiye
bakınız.
-
Çeşitli hücrelere bağlanma- Fagositler, lenfositler,
trombositler, mast hücreleri ve bazofiller immünglobulinlere
bağlanabilecek reseptörlere sahiptir.Bu bağlanma hücrelerin bazı
fonksiyonları yerine getirmesini indükler.Bazı immünglobulinler
ayrıca plasental trofoblastlardaki reseptörlere bağlanarak
immünglobulinlerin plasentadan fetusa transferine neden olur. Sonuç
olarak yenidoğan ve fetüste maternal antikor transferi immüniteyi
destekler.
|
|
ANAHTAR KELİMELER
Immünglobulin
Valans
Ağır zincir
Hafif zincir
Değişken bölge
Sabit Bölge
Menteşe Bölgesi
Aşırı değişken bölge
Framework (çatı) bölgesi
Gruplar & alt gruplar
Fab & Fc, F(ab')2
Tip & subtip
Sınıf & altsınıf
Opsonin
J zinciri
Salgısal komponent
 Şekil 2A immunoglobulinleri
Şekil 2A immunoglobulinleri
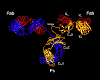 Şekil 2C Antikor yapısının 3 boyutlu
animasyonu (Ribbon drawing of the first intact antibody (IgG2A) every
crystallized.
Şekil 2C Antikor yapısının 3 boyutlu
animasyonu (Ribbon drawing of the first intact antibody (IgG2A) every
crystallized.
Harris, L. J., Larson, S. B., Hasel, K. W., Day, J.,
Greenwood, A., McPherson, A. Nature 1992, 360, 369-372. © 2000 Antibody
Resource Page
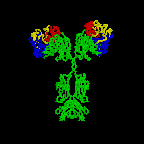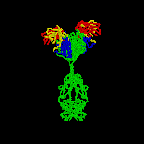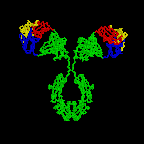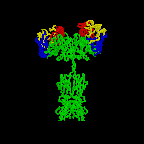
Şekil 2D
Antikor yapısının 3 boyutlu animasyonu
Rotating antibody Jose Saldanha, Humanization by Design ©
2000, Antibody Resource Page
|
İMMÜNGLOBULİNLERİN TEMEL
YAPISI
İmmünglobulinlerin yapısı Şekil 2de resmedilmiştir. Her ne
kadar immünglobulinler birbirinden farklı yapılara sahip olsalar da, aslında
hepsi benzer ana yapı üzerine kurulmuştur.
Hafif ve ağır zincir
Tümimmünglobulinlerintemel yapıları dört zincirden oluşmaktadır. İki eş
hafif zincir (23kD) ve iki eş ağır zincirden (50-70kD) oluşur.
Disülfit bağlantılar
Zincirler arası disülfit
bağları
Hafif ve ağır zincirler ve iki ağır zincir, zincirler arası disülfit
bağları ve non kovalent bağlarla birbirine bağlanırlar. Zincirler arası
disülfit bağlarının sayısı immünglobulinler arasında farklılık gösterir.
Zincir içi disülfit bağları
Polipeptid zincirleri arasında disülfit bağları olduğu gibi ayrıca
zincir içinde de vardır.
Değişken (V) ve sabit(C) bölgeler
Birbirinden farklı hafif ve ağır zincirlerin aminoasit sekansı
karşılaştırıldığında, hafif ve ağır zincirin her ikisi de bu sekanslardaki
farklılığa göre iki bölgeye ayrılabilir.
Bunlar:
Hafif zincir- VL (110 amino asit) ve CL (110 amino asit)
Ağır zincir- VH (110 amino asit) ve CH (330-440 amino asit)
Menteşe bölgesi
Bu kısım antikorun kollarının Y gibi olduğu bölgedir. Burası menteşe
bölgesi olarak adlandırılır çünkü antikor bu alanda esneklik kazanır.
Domain bölgeleri
İmmünglobulin molekülünün üç boyutlu yapısı göstermektedir ki Şekil2Ada
resmedildiği gibi dümdüz değildir.Bunun yerine, her biri zincir içi disülfit
bağlarını içeren globüler bölgelerden katlanmıştır (Şekil 2B-D).Bu bölgeler
domain olarak adlandırılır.
Hafif zincir domain- VL ve CL
Ağır zincir domain- VH, CH1 - CH3 (veya CH4)
Oligosakkaritler
Çoğu immünglobulinde karbonhidratlar CH2 domainine eklenmiştir. Fakat bazı
durumlarda karbonhidratlar başka bölgelere de bağlanabilir.
DEĞİŞKEN BÖLGENİN YAPISI
İmmünglobulinlerin değişken bölgelerinin aminoasit
sekansları kıyaslandığında şekil 3 te gösterildiği gibi çoğu değişken
kısımların hiper variable/aşırı değişken bölge veya tamamlayıcılık
belirleyen bölgeler (CDR) olarak adladırılan bölgede olduğu gösterilmiştir.
Farklı özellikleri olan antikorlar (örn; farklı birleşme bölgeleribe sahip)
farklı tamamlayıcı bölgelere sahipken aynı özgüllüğe sahip antikorların
tamamlayıcı bölgeleri de birebir aynıdır (örneğin CDR antikor bağlanma
bölgesidir). Tamamlayıcı bölgeler hem H hem de L zincirinde bulunur.
Çatı bölgeleri
Değişken bölgedeki tamamlayıcı alanlar (CDR) çatı (framework) bölgesi olarak
adlandırılır (Şekil 3). Çatı bölgelerindeki benzerlik ve farklılıklara
dayanarak immunglobulinlerin ağır ve hafif zincirlerinin değişken bölgeleri
grup ve alt gruplara ayrılabilir. Bu durum farklı değişken bölge genlerin
olduğunu göstermektedir.
|
 Şekil 3
Şekil 3
Değişken ve framework (çatı) bölgelerinin yapısı
|
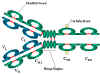
İMMÜNGLOBULİN FRAGMANLARI: YAPI
/ FONKSİYON İLİŞKİSİ Proteolitik sindirim sonucu oluşan
immünglobulin parçaları immünglobulinlerin yapı/fonksiyon ilişkisini
açıklamak açısından yararlı olmuştur.
Fab
Papainle muamele sonucu immünglobulin molekülleri zincir içi H-H
disülfit bağlarından önce menteşe bölgesinden kırılır (Şekil 4). Bu
durum hafif zinciri ve ağır zincirin Vh ve Ch1 domainini içeren iki eş
fragman oluşumuyla sonuçlanır.
Antijen bağlama- Bunlar Fab fragmanı olarak adlandırılır çünkü
antikor için antijen bağlama bölgesi içerir. Her bir Fab fragmanı
monovalendir fakat orijinal molekül divalandır. Antikorun ortak
kısmı hem VH, hem de VL tarafından oluşturulur. Bir antikor belli
bir antijenik determinanta bağlanma eğilimindedir çünkü VH ve VL
özgün kombinasyonlara sahiptir. VH ve VL nin farklı kombinasyonları
antikorun farklı antijenik determinantlara bağlanabilmesini sağlar.
Fc
Papainle sindirim sonucu ayrıca CH2 ve CH3 domaini içeren iki ağır
zincir oluşur. Bu fragman Fc olarak adlandırılır çünkü kolaylıkla
kristalleşebilir.
|
 Şekil 4
Şekil 4
İmmünoglobulin fragmanları: Yapı/fonksiyon ilişkisi |
Efektör fonksiyonlar- İmmünglobulinlerin efektör fonksiyonu
molekülün bu parçasıyla gerçekleştirilir. Bu fragmanın farklı
domainleriyle farklı fonksiyonlar yapılır (Şekil 5). Normal olarak
antikorun efektör fonksiyonunu gösterebilmesi için önce antijene
bağlanması gerekir; ancak istisnalar da mevcuttur.
|
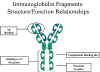 Şekil 5
Şekil 5
İmmünoglobulin fragmanları: Yapı/fonksiyon ilişkisi |
F(ab')2
İmmünglobulinin pepsinle muamelesi sonucu ağır zincir H-H zincirler
arası disülfit bağları çözülür; her iki antijen bağlama bölgesini de
içeren bir parça ortaya çıkar (Şekil 6). Bu parça F(ab')2 olarak
adlandırılır çünkü divalandır. Bu molekülün Fc parçası pepsin
tarafından küçük peptid parçalarına bölünür. F(ab')2 antijene
bağlanır fakat antikorun efektör fonksiyonlarını yürütmez.
|
 Şekil 6
Şekil 6
İmmünoglobulin fragmanları: Yapı/fonksiyon ilişkisi |
İNSAN İMMÜNGLOBULİN SINIFLARI,
ALTSINIFLARI, TİP VE SUBTİPLERİ
İmmünglobuin sınıfları
İmmünglobulinler ağır zincirlerindeki sabit bölgelerindeki aminoasit
sekanslarına göre beş farklı sınıfa ayrılır. Bir sınıftaki tüm
immünglobulinlerin ağır zincirlerinin sabit bölgeleri birbirine benzerdir.
Bu farklılıklar sekans çalışmaları veya daha yaygın olarak serolojik
çalışmalarla ortaya çıkarılabilir.
- IgG - Gama ağır zincir
- IgM - Mu ağır zincir
- IgA - Alfa ağır zincir
- IgD - Delta ağır zincir
- IgE - Epsilon ağır zincir
İmmünglobulin altsınıfları
İmmünglobulin sınıfları ağır zincirlerin sabit bölgelerinin aminoasit
sekanslarındaki küçük farklılıklara dayanılarak altsınıflara ayrılabilir.
Aynı alt sınıflardaki tüm immünglobulinlerin ağır zincirler sabit
bölgelerinin aminoasit sekansları birbirine çok benzerdir. Bu
farklılıklar serolojik yöntemlerle tespit edilebilir.
IgG altsınıfları
- IgG1 - Gama 1 ağır zincir
- IgG2 - Gama 2 ağır zincir
- IgG3 - Gama 3 ağır zincir
- IgG4 - Gama 4 ağır zincir
IgA altsınıfları
- IgA1 - Alfa 1 ağır zincir
- IgA2 - Alfa 2 ağır zincir
|
| |
İmmünglobulin tipleri
İmmünglobulinler ayrıca sahip oldukları hafif zincirlerine göre de
sınıflandırılabilir. Hafif zincirler, zincirin sabit bölgesindeki aminoasit
sekanslarındaki farklılıklara dayanılarak tiplendirilir. Bu farklılıklar
serolojik yöntemlerle tespit edilir.
Kappa hafif zincir
Lambda hafif zincir
İmmünglobulin
alttipleri
Hazfif zincirler aynı zamanda hafif zincirin sabit bölgesindeki aminoasit
sekanslarındaki farklılığa dayanılarak da subtiplere ayrılabilir.
Lambda Subtipleri
-
Lambda 1
-
Lambda 2
-
Lambda 3
-
Lambda 4
Terminoloji
İmmunoglobulinler, ağır zincirlerin sınıf ve altsınıfına göre; hafif
zincirin tip ve alttiplerine göre isimlendirilirler. Kesin olarak
belirtilmedikçe, tüm altsınıf, tip ve alttiplerin var olduğunu anlamak
gerekir. Örneğin IgG, tüm altsınıf ve tipleri anlatmaktadır.
Heterojenite
İmmünglobulinler oldukça heterojen molekül toplulukları olarak bilinir çünkü
farklı sınıf ve altsınıflardan ve her biri farklı tip ve alttipleri olan
hafif zincirlerden oluşmuştur. Dahası, farklı immünglobulin molekülleri
birbirlerinden farklı antijen bağlama özellikleri sergiler çünkü VH ve VL
bölgeleri de farklıdır.
|
 Şekil 7
Şekil 7
IgG Yapısı |
IG SINIF VE ALTSINIFLARININ
YAPI VE GENEL ÖZELLİKLERİ
IgG
Yapı
IgG altsınıflarının yapısı Şekil 7'de çizilmiştir. Tüm
IgGler monomerik (7S immunoglobulin) yapıdadır. Altsınıflar menteşe
bölgesi uzunluğu ve disülfit bağlarının sayısı açısından birbirinden
farklıdır.
Özellikler
IgG en işlevsel immünglobulindir çünkü immünglobulinlere ait tüm
fonksiyonları yerine getirebilme kapasitesine sahiptir.
- IgG serumda en bol bulunan immünglobulindir Serum Ignin
%75ini oluşturur.
- IgG ekstravasküler bölgleredeki majör immünglobulindir.
- Plasental transfer IgG plasentadan geçebilen tek
immünglobulindir. Plasental hücrelerin IgGnin Fc bölgesi için
reseptör taşımaları sayesinde plasental transfer
gerçekleşmektedir. Altsınıfların hepsi aynı oranda geçiş yapamaz;
örneğin IgG2 plasentadan iyi geçemez.
- Kompleman fiksasyonu Tüm altsınıflar eşit derecede
yepmamaktadır; örn IgG4 kompleman fiksasyonu yapamaz.
- Hücrelere bağlanma Makrofaj, monosit, nötrofil ve bazı
lenfositler, IgGnin Fc bölgesi için Fc reseptörü taşırlar. Tüm
altsınıflar eşit derecede bağlanamaz; IgG2 ve IgG4 Fc
reseptörlerine bağlanmaz. Polimorfo Nüveli Lökositlerin (PMN),
monosit ve makrofajlar Fc reseptörlerine bağlanması sonucu, bu
hücreler antijeni daha iyi özümseyebilirler. Antikor, fagositik
hücrelerin için antijeni fagosite etmelerine yardımcı olmaktadır.
Opsonin terimi, fagositozu arttıran maddeler için kullanılır.
IgG iyi bir opsonindir. IgGnin diğer hücre yüzeylerindeki Fc
reseptörlerine bağlanması ile diğer fonksiyonları aktivasyonuna
yol açar.
|
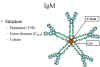 Şekil 8
Şekil 8
Pentamerik serum IgM yapısı
 Şekil 9
Şekil 9
Hücre yüzeyi IgM yapısı
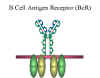 Şekil 10
Şekil 10
B hücre antig-jen reseptörü (BcR) |
IgM
Yapısı
IgM yapısı Şekil 8de gösterilmiştir. IgM normalde pentamer
yapıdadır (19S immunglobulin) fakat monomer halde de bulunabilir.
Pentamer formda tüm ağır zincirler ve hafif zincirler birbiriyle
aynıdır. Bu nedenle, teorik olarak valansı 10dur. IgMin mü
zincirinde(CH4) ekstra bir domaini vardır ve S-S zinciri ile
kovalent olarak bağlanan ve J zinciri olarak adlandırılan başka
bir proteine daha sahiptir. Bu zincirin fonksiyonu molekülü
pentamer hale polimerize etmektir.
Özellikler
- IgM serumda en çok bulunan üçüncü immünglobulindir.
- IgM fetüste ilk yapılan immünglobulindir ve antijen
tarafından stimüle edildiğinde B hücrelerinden salınan ilk
immünglobulindir.
- Pentamerik yapıda olmasının sonucu olarak IgM iyi
kompleman fiksasyonu yapan immünglobindir. Bu nedenle IgM
tipi antikorlar mikroorganizmaların lizisinde oldukça
etkindir.
- IgMler yapısal özelliklerinin bir sonucu olarak etkin
aglütinasyon yapan immüngloblundir. Böylelikle
mikroorganizmanın kümeler haline getrilmesi ve sonrasında
vücuttan elimine edilmesi konusunda oldukça başarılıdır.
- IgM, Fc reseptörleri üzerinden bazı hücrelere
bağlanabilir.
- B lenfosit yüzey immünglobulinidir
B lenfosit yüzeyinde IgM monomerikdir ve J zinciri içermez
fakat membrana bağlanan C terminalinde molekülü
sağlamlaştıran ekstra 20 aminoasit dizisi içermektedir (Şekil
9). B lenfosit yüzeyindeki IgM, antijenler için reseptör
fonksiyonu görür. Yüzey IgM B lenfosit membranında Ig alfa
ve Ig beta olarak adlandırılan iki ek protein ile
nonkovalent bir bağlantı içindedir (şekil 10). İmmunglobulin
molekülünün sitoplazmik bölümü sinyal iletimi için çok kısa
olduğundan, bu ek proteinler sinyal iletim molekülleri
olarak görev yapamaktadır. Sinyal Ig alfa ve Ig betaya
iletilmeden önce yüzey immünglobulini ile antijen
bağlanmalıdır. T-bağımsız antijen söz konusu olduğunda,
antijen ile yüzey immüngloblunin teması B hücrelerinin
aktive edilmesi ve antikor sekrete eden plazma hücrelerine
dönüşümü için yeterlidir. Fakat T lenfosit bağımlı
antijenler için B lenfosit aktive olmadan önce, yardımcı T
lenfositler tarafından sağlanan ikinci bir sinyal
gerekmektedir.
|
 Şekil
11 Şekil
11
IgA yapısı
 Şekil 12
Şekil 12
Salgısal IgAnın kaynağı |
IgA
Yapısı
Serum IgA bir monomerdir fakat sekresyonlarda Şekil 11de
gösterildiği gibi dimer halde bulunur. IgA dimer haldeyken J zinciri
içerir. Sekretuar IgA, sekretuar parça veya T parçası olarak
adlandırılan bir diğer protein ile birliktedir; sIgA, 11S
immünglobulin olarak da adlandırılır. Plazma hücrelerince üretilen
IgAnın aksine, sekretuar parça, epitelyal hücrelerce yapılır ve IgA
sekresyona geçerken Ig molekülene eklenir (Şekil 12). Sekretuar
parça IgA nın mukozadan transportuna yardım eder ve sekresyon içinde
degrade olmasını önler.
Özellikler
- IgA serumda en bol bulunan ikinci immünglobulindir.
- IgA sekresyonlardaki majör immünglobulindir- gözyaşı, tükrük,
kolostrum, mukus. Sekresyonlarda sekretuar IgA nın bulunması
mukozal immünite açısından önemlidir.
- Kümelenme (agrege) olmadıkça IgA komplemanı fikse etmez.
- IgA bazı hücrelere bağlanabilir- PMN hücrelere ve bazı
lenfositlere bağlanabilir.
|
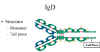 Şekil 13
Şekil 13
IgD yapısı |
IgD
Yapısı
IgDnin yapısı Şekil 13de gösterilmektedir. IgD, sadece monomer
olarak bulunur.
Özellikler
-
Serumda düşük seviye bulunur, IgD nin serumdaki
rolü tam bilinmemektedir.
-
IgD, birincil olarak B lenfosit yüzeyinde
bulunur ve antijenler için reseptör görevi görür. B lenfosit
yüzeyindeki IgD membrana bağlanabilmek için C terminalinde ek
aminoasit dizileri içerir. Ayrıca Ig alfa ve Ig beta
zincirleriyle de bağlantılıdır.
-
IgD komplemanı bağlayamaz.
|
 Şekil 14
Şekil 14
IgE yapısı |
IgE
Yapısı
IgEnin yapısı şekil 14de gösterilmiştir. IgE monomer olarak bulunur
ve sabit bölgesinde ekstra bir domain içerir.
Özellikleri
-
IgE bazofil ve mast hücrelerindeki Fc
reseptörlerine antijenle etkileşime girmeden önce bile sıkıca
bağlandığı için serumda en az bulunan immünglobulindir.
-
Allerjik reaksiyonlarda görev alır- Bazofil ve
mast hücrelerine bağlanabilmesinin bir sonucu olarak alerjik
reaksiyonlara rol oynamaktadır. IgEye allerjenin bağlanması
alerjik semptomlarla yol açan birçok mediatörün salınımına neden
olmaktadır.
-
IgE ayrıca parazitik helmint hastalıklarında da
rol oynar. Parazitik hastalıklarda IgE seviyelerinin artmasından
dolayı, IgE ölçümü bu hastalıkların tanısına faydalıdır.
Eozinofiller IgE için Fc reseptörlerine sahiptir ve eozinofilin
IgE kaplı helmintlere bağlanması parazitin ölümüne neden olur.
-
IgE komplemanı fikse edemez.
|
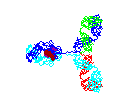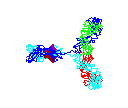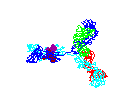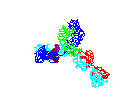 Şekil 15 Şekil 15
Dönen antikor animasyonu
© 2000 Antibody Resource Page Antibody Concepts
|
İMMÜNGLOBULİN SINIFLARININ KLİNİK
ÖNEMİ F.T. Fischbach "A Manual of Laboratory Diagnostic
Tests," 2nd Ed., J.B. Lippincott Co., Philadelphia, PA, 1984.adlı kaynaktan
uyarlanmıştır.
IgG
Şu Durumlarda Artar
- Kronik granülomatöz enfeksiyonlar
- Enfeksiyonlar
- Hiperimmünizasyon
- Karaciğer hastalığı
- Ciddi malnutrisyon
- Disproteinemi
- Hipersensitivite granülomları, dermatolojik hastalıklar ve IgG
myeloma
- Romatoid artrit
Şu Durumlarda Azalır
- Agamaglobulinemi
- Lenfoid aplazi
- Selektif IgA ve IgG eksikliği
- IgA myeloma
- Bence Jones proteinemisi
- Kronik lenfoblastik lenfoma
IgM
Yetişkinde şu durumlarda artar
- Waldenström makroglobulinemisi
- Tripanosomiaz
- Aktinomikozis
- Carrion hastalığı (bartonelloz)
- Malarya
- Enfeksiyöz mononükleoz
- Sistemik lupus eritematozus
- Romatoid artrit
- Disgamaglobulinemi
Not: Yenidoğanda 20ng/dl üzeri IgM
düzeyi in utero immün sistemin indüklendiğinin
bir göstergesidir ve rubella, CMV, sifiliz veya
toksoplazma maruziyetini gösterir.
Azaldığı Durumlar
- Agamaglobulinemi
- Lenfoproliferatif hastalıklar (bazı vakalar)
- Lenfoid aplazi
- IgA ve IgG myelomu
- Disgamaglobulinemi
- Kronik lenfoblastik lösemi
IgA
Arttığı Durumlar
- Wiskott Aldrich sendromu
- Karaciğer sirozu (birçok vakada)
- RA ve SLE gibi kollajen ve otoimmün
hastalıklar
- İmmünyetmezlikle ilişkili olmayan kronik
enfeksiyonlar
- IgA myeloma
Azaldığı Durumlar
- Ataksi talenjektazi
- İmmünyetmezlik durumları (disgamaglobulinemi,
konjenital ve kazanılmış
agamaglobulinemi, hipogamaglobulinemi)
- Malabsorbsiyon sendromları
- Lenfoid aplazi
- IgG myeloma
- Akut lenfoblastik lösemi
- Kronik lenfoblastik lösemi
IgD
Şu
Durumlarda Artar
- Kronik enfeksiyonlar
- IgD myeloma
IgE
Arttığı Durumlar
- Atopik cilt
hastalıkları (egzema
vb.)
- Ateş
- Astım
- Anaflaktik şok
- IgE myeloma
Azaldığı Durumlar
- Konjenital
agamaglobulinemi
- Metabolizma
bozukluklarına bağlı
hipogamaglobulinemi
veya immünglobulin
sentez bozuklukları
|
|

 |
 Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
This page last changed on
Saturday, March 26, 2016
Page maintained by
Richard Hunt
|

 Şekil 3
Şekil 3 Şekil 4
Şekil 4 Şekil 5
Şekil 5 Şekil 6
Şekil 6 Şekil 7
Şekil 7  Şekil 8
Şekil 8 Şekil
11
Şekil
11  Şekil 13
Şekil 13 Şekil 14
Şekil 14  Şekil 15
Şekil 15