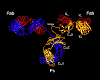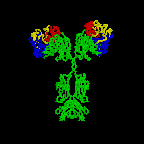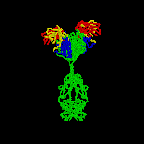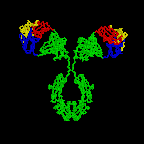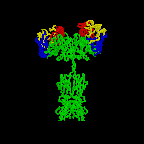|
|
|
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
|
IMUNOLOGIA – CAPÍTULO QUATRO
IMUNOGLOBULINAS – ESTRUTURA E FUNÇÃO
Dr. Gene Mayer
Professor Emeritus
University of South Carolina School of Medine
Tradução:
PhD. Myres Hopkins
|
|
EM INGLÊS
|
|
EM ESPANHOL |
|
SHQIP - ALBANIAN |
Dê a
sua opinião
CONTATO |
|
BUSCA |
E-MAIL
DR MYRES HOPKINS |
|
ESCOLA DE MEDICINA DA
UNIVERSIDADE DA CAROLINA DO SUL |

 |
|
|
|
OBJETIVOS
Discutir as propriedades gerais de todas as imunoglobulinas
Descrever a estrutura básica das imunoglobulinas
Relacionar a estrutura de imunoglobulina com a função
Definir as regiões hipervariáveis e framework
Definir as classes e subclasses, tipos e subtipos das
imunoglobulinas
Descrever as estruturas e propriedades das classes de
imunoglobulinas
 Figura 1 Separação eletroforética de proteínas séricas Figura 1 Separação eletroforética de proteínas séricas |
DEFINIÇÃO
Imunoglobulinas (Ig)
Moléculas de glicoproteína que são produzidas pelos plasmócitos em resposta
a um imunógeno e que funcionam como anticorpos. As imunoglobulinas derivam
seu nome da descoberta de que elas migram com as proteínas globulares quando
soro contendo anticorpos é colocado em um campo elétrico (Figura 1).
FUNÇÕES
GERAIS DAS IMUNOGLOBULINAS
Ligação a antígeno
Imunoglobulinas se ligam especificamente a um ou a alguns antígenos
proximamente relacionados. Cada imunoglobulina na verdade liga-se a um
determinante antigênico específico. Ligação a antígeno pelos anticorpos é a
função primária dos anticorpos e pode resultar em proteção do hospedeiro. A
valência do anticorpo refere-se ao número de determinantes antigênicos que
uma molécula individual de anticorpo pode se ligar. A valência de todos os
anticorpos é pelo menos duas e em alguns casos mais.
Funções Efetoras
Freqüentemente a ligação de um anticorpo a um antígeno não tem efeito
biológico direto. Ao invés disso, os efeitos biológicos significantes são
uma conseqüência de “funções efetoras” secundárias de anticorpos. As
imunoglobulinas mediam uma variedade dessas funções efetoras. Usualmente a
habilidade de carrear uma função efetora particular requer que o anticorpo
se ligue a seu antígeno. Nem todas as imunoglobulinas irão mediar todas as
funções efetoras. Tais funções efetoras incluem:
-
Fixação ao complemento – Isso resulta na lise de células e liberação de
moléculas biologicamente ativas (ver
capítulo dois)
-
Ligação a vários tipos celulares – Células fagocitárias, linfócitos,
plaquetas, células master, e basófilos têm receptores que se ligam a
imunoglobulinas. Essa ligação pode ativar as células que passam a
realizar algumas funções. Algumas imunoglobulinas também se ligam a
receptores em trofoblastos placentários, o que resulta na transferência
da imunoglobulina através da placenta. Como resultado, os anticorpos
maternos transferidos provêem imunidade ao feto e ao recém-nascido.
|
|
PALAVRAS-CHAVE
Imunoglobulina
Valência
Cadeia pesada
Cadeia leve
Região variável
Região constante
Região de dobradiça
Domínio
Região hipervariável
Região framework
Grupos & subgrupos
Fab & Fc, F(ab')2
Tipo & subtipo
Classe & subclasse
Opsonina
Cadeia J
Componente secretor
 Figura 2A
A estrutura básica das imunoglobulinas
Figura 2A
A estrutura básica das imunoglobulinas
 Figure 2B
Figure 2B
Clique na imagem à esquerda para um tutorial com animação da estrutura
do anticorpo
Requer Plug-In Chime. Obtenha Chime
aqui.
Desenvolvido por
Eric Martz.
Empreendimento apoiado pela “Divisão de Educação Universitária da
Fundação Nacional de Ciências”.
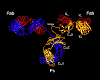 Figura 2C
Modelo em fita do primeiro anticorpo intacto a ser cristalizado (IgG2A).
Harris, L. J., Larson, S. B., Hasel, K. W., Day, J., Greenwood, A.,
McPherson, A. Nature 1992, 360, 369-372. © 2000,
Antibody Resource Page
Figura 2C
Modelo em fita do primeiro anticorpo intacto a ser cristalizado (IgG2A).
Harris, L. J., Larson, S. B., Hasel, K. W., Day, J., Greenwood, A.,
McPherson, A. Nature 1992, 360, 369-372. © 2000,
Antibody Resource Page
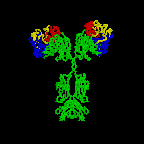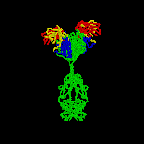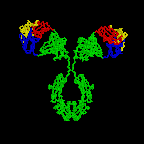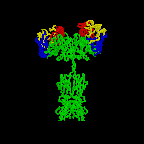 Figura 2D
Figura 2D
Anticorpo em rotação
Jose Saldanha, Humanization by Design © 2000,
Antibody Resource Page |
ESTRUTURA
BÁSICA DAS IMUNOGLOBULINAS
A estrutura
básica das imunoglobulinas é ilustrada na Figura 2. Embora diferentes
imunoglobulinas possam diferir estruturalmente elas são todas construidas a
partir das mesmas unidades básicas.
Cadeias leves e Pesadas
Todas as imunoglobulinas têm uma estrutura de quatro cadeias como
unidade básica. Elas são compostas de duas cadeias leves idênticas
(23kD) e duas cadeias pesadas idênticas (50-70kD).
Pontes dissulfeto
-
Pontes dissulfeto intercadeia – As cadeias pesada e leve e as
duas cadeias pesadas são mantidas juntas por pontes dissulfeto
intercadeia e por interações não covalentes. O número de pontes
dissulfeto varia entre as diferentes moléculas de imunoglobulinas.
-
Pontes dissulfeto intracadeia – Dentro de cada uma das cadeias
polipeptídicas há também pontes dissulfeto intracadeia.
Regiões Variáveis (V) e Constantes (C)
Depois que as sequências de aminoácidos de muitas cadeias pesadas e
leves diferentes foram comparadas, ficou claro que ambas as cadeias
pesadas e leves poderiam ser divididas em duas regiões baseando-se na
variabilidade da seqüência de aminoácidos. Elas são:
1. Cadeia leve - VL (110 aminoácidos) e CL
(110 aminoácidos)
2. Cadeia Pesada - VH (110 aminoácidos) e CH
(330-440 aminoácidos)
Região da dobradiça
Esta é a região com a qual os braços da molécula de anticorpo formam um
Y. É chamada de região da dobradiça porque há uma flexibilidade na
molécula nesse ponto.
Domínios
Imagens tridimensionais da molécula de imunoglobulina mostram que ela
não é reta como mostrado na Figura 2A. Ao contrário, ela é dobrada em
regiões globulares, cada uma das quais contém uma ponte dissulfeto
intracadeia (figura 2B-D). Essas regiões são chamadas domínios.
-
Domínios de Cadeia Leve - VL e CL
-
Domínios de Cadeia Pesada - VH, CH1 - CH3
(ou CH4)
Oligosacarídeos
Carboidratos são acoplados ao domínio CH2 na maioria das
imunoglobulinas. Entretanto, em alguns casos carboidratos podem também
serem acoplados em outros locais.
ESTRUTURA DA REGIÃO VARIÁVEL
Regiões hipervariáveis (HVR) ou regiões determinadoras de
complementaridade (CDR)
Comparações entre as seqüências de aminoácidos das regiões variáveis das
imunoglobulinas mostram que a maioria das variações reside em três
regiões chamadas de regiões hipervariáveis ou regiões determinadoras de
complementaridade, como ilustrado na Figura 3. Anticorpos com
especificidades diferentes (i.e. diferentes sítios de combinação)
têm diferentes regiões determinadoras de complementariedade, enquanto
que anticorpos de exatamente mesma especificidade têm regiões
determinadoras de complementariedade idênticas (i.e. CDR é o
sítio de combinação do anticorpo). Regiões determinadoras de
complementariedade são encontradas em ambas as cadeias H e L.
Regiões framework
As
regiões entre as regiões determinadoras de complementariedade na região
variável são chamadas regiões framework (Figura 3). Com base nas
similaridades e diferenças nas regiões framework as regiões variáveis da
cadeia pesada e leve da imunoglobulina podem ser divididas em grupos e
subgrupos. Estes representam os produtos de diferentes genes de região
variável.
|
 Figura 3
Estrutura das regiões variável e framework
Figura 3
Estrutura das regiões variável e framework
 Clique na imagem à esquerda para ver a estrutura molecular de um
fragmento Fab ligado a um peptídeo de hemaglutinina da influenza.
Requer Plug-In Chime. Obtenha Chime
aqui.
Clique na imagem à esquerda para ver a estrutura molecular de um
fragmento Fab ligado a um peptídeo de hemaglutinina da influenza.
Requer Plug-In Chime. Obtenha Chime
aqui.
 Clique na imagem à esquerda para ver detalhes da interação de um
anticorpo monoclonal de camundongo interagindo com lisozima de clara de
ovo de galinha.
Requer Plug-In Chime. Obtenha Chime
aqui.
Clique na imagem à esquerda para ver detalhes da interação de um
anticorpo monoclonal de camundongo interagindo com lisozima de clara de
ovo de galinha.
Requer Plug-In Chime. Obtenha Chime
aqui. |
FRAGMENTOS
DE IMUNOGLOBULINA: RELAÇÕES ESTRUTURA/FUNÇÃO
Fragmentos de imunoglobulinas produzidos por digestão proteolítica
têm-se mostrado úteis na elucidação das relações de estrutura e função
em imunoglobulinas.
Fab
Digestão com papaína quebra a molécula de imunoglobulina na região
da dobradiça antes da ponte dissulfeto intercadeia Figura 4. Isso
resulta na formação de dois fragmentos idênticos que contém a cadeia
leve e os domínios VH e CH1 da cadeia pesada.
Ligação a antígeno – Esses fragmentos foram chamados de
fragmentos Fab porque eles continham o sítio de ligação a
antígenos do anticorpo. Cada fragmento Fab é monovalente
enquanto que a molécula original era divalente. O sítio de
combinação do anticorpo é criado tanto por VH e VL.
Um anticorpo é capaz de se ligar a um determinante antigênico
particular porque ele tem uma combinação particular de VH
e VL. Combinações diferentes de VH e VL
resultam em anticorpos capazes de se ligar a determinantes
antigênicos diferentes.
Fc
Digestão com papaína também produz um fragmento que contém o
restante das duas cadeias pesadas, cada uma contendo um domínio CH2
e CH3. Esse fragmento foi chamado Fc porque é facilmente
cristalizado.
|
 Figura 4 Fragmentos de
Imunoglobulina: Relações estrutura/função
Figura 4 Fragmentos de
Imunoglobulina: Relações estrutura/função |
Funções efetoras – As funções efetoras das imunoglobulinas são
mediadas por esta parte da molécula. Diferentes funções são mediadas
por diferentes domínios nesse fragmento (Figura 5). Normalmente a
habilidade de um anticorpo exercer uma função efetora requer a
ligação prévia a um antígeno; entretanto, há exceções a essa regra.
|
 Figura 5 Fragmentos de
Imunoglobulina: Relações estrutura/função
Figura 5 Fragmentos de
Imunoglobulina: Relações estrutura/função |
F(ab')2
Tratamento de imunoglobulinas com pepsina resulta na clivagem da
cadeia pesada depois das pontes dissulfeto H-H intercadeia,
resultando em um fagmento que contém ambos os sítios de ligação a
antígenos (Figure 6). Esse fragmento foi chamado F(ab')2
porque é divalente. A região Fc da molécula é digerida a pequenos
peptídeos pela pepsina. O F(ab')2 liga-se a antígeno mas
não media as funções efetoras dos anticorpos.
|
 Figura 6 Fragmentos de
Imunoglobulina: Relações estrutura/função
Figura 6 Fragmentos de
Imunoglobulina: Relações estrutura/função |
CLASSES DE
IMUNOGLOBULINAS HUMANAS, SUBCLASSES, TIPOS E SUBTIPOS
Classes de imunoglobulinas
As imunoglobulinas podem ser divididas em cinco classes diferentes, com base
nas diferenças em seqüências de aminoácidos na região constante das cadeias
pesadas. Todas a imunoglobulinas de uma mesma classe tem regiões constantes
de cadeia pesada muito similares. Essas diferenças podem ser detectadas por
estudos de seqüências ou mais comumente por meios sorológicos (i.e.
pelo uso de anticorpos dirigidos a essas diferenças).
-
IgG – Cadeias pesadas gama
-
IgM - Cadeias pesadas mu
-
IgA - Cadeias pesadas alfa
-
IgD - Cadeias pesadas delta
-
IgE - Cadeias pesadas épsilon
Subclasses de imunoglobulinas
As classes de imunoglobulinas podem ser divididas em subclasses baseadas em
pequenas diferenças nas seqüências de aminoácidos na região constante das
cadeias pesadas. Todas as imunoglobulinas de uma subclasse têm seqüências de
aminoácidos de região constante de cadeia pesada muito similares. Novamente
essas diferenças são mais comumente detectadas por meios sorológicos.
IgG1 – Cadeias pesadas gama 1
IgG2 - Cadeias pesadas gama 2
IgG3 - Cadeias pesadas gama 3
IgG4 - Cadeias pesadas gama 4
IgA1 - Cadeias pesadas alfa 1
IgA2 - Cadeias pesadas alfa 2
|
| |
Tipos de imunoglobulinas
Imunoglogulinas podem ser também classificadas pelo tipo de cadeia leve que
possuem. Tipos de cadeia leve são baseados na diferença de sequência de
aminoácidos na região constante da cadeia leve. Essas diferenças são
detectadas por meios sorológicos.
-
Cadeias leves kappa
-
Cadeias leves lambda
Subtipos de imunoglobulina
As cadeias leves podem ser também divididas em subtipos baseados nas
diferenças de sequência de aminoácidos da região constante de cadeia leve.
Lambda 1
Lambda 2
Lambda 3
Lambda 4
Nomenclatura
Imunoglobulinas são nomeadas com base na classe, ou na cubclasse de cadeia
pesada e tipo ou subtipo de cadeia leve. A menos que seja precisamente
declarado você deve assumir que todas as subclasses, tipos e subtipos estão
presentes. IgG significa que todas as subclasses e tipos estão presentes.
Heterogeneidade
Imunoglobulinas consideradas como uma população de moléculas são normalmente
muito heterogêneas porque elas são compostas de diferentes classes e
subclasses cada uma com diferentes tipos e subtipos de cadeias leves. Além
disso, diferentes moléculas de imunoglobulinas podem ter diferentes
propriedades de ligação a antígenos devido às diferentes regiões VH
e VL.
|
 Figura 7 Estrutura da
IgG
Figura 7 Estrutura da
IgG |
ESTRUTURA
E ALGUMAS PROPRIEDADES DE CLASSES E SUBCLASSES DE IG
IgG
Estrutura
As estruturas de subclasses de IgG estão apresentadas na Figura
7. Todas IgG's são monômeros (imunoglobulina 7S). As subclasses
diferem no número de pontes dissulfeto e comprimento da região
da dobradiça.
Propriedades
A mais versátil imunoglobulina porque é capaz de realizar todas
as funções das moléculas de imunoglobulinas.
a) IgG é a principal Ig no soro - 75% das Ig do soro são IgG
b) IgG é a principal Ig em espaços extra vasculares
c) Transferência placentária - IgG é a única classe de Ig
que atravessa a placenta. A transferência é mediada pelo
receptor da região Fc do IgG nas células placentárias. Nem
todas as subclasses atravessam com a mesma eficiência; IgG2
não atravessa bem.
d) Fixação do complemento – Nem todas as subclasses fixam
com a mesma eficiência; IgG4 não fixa complemento.
e) Ligação a células – Macrófagos, monócitos, PMN's e alguns
linfócitos têm receptores para a região Fc da IgG. Nem todas
as subclasses se ligam com a mesma eficiência; IgG2 e IgG4
não se ligam a receptores de Fc. Uma consequência da ligação
a receptores de Fc em PMN's, monócitos e macrófagos é que a
célula pode então internalizar o antígeno melhor. O
anticorpo preparou o antígeno para ser comido pelas células
fagocitárias. O termo opsonina é usado para descrever
substâncias que aumentam a fagocitose. IgG é uma boa
opsonina. Ligação de IgG a receptores de Fc em outros tipos
de células resulta na ativação de outras funções.
|
 Figura 8
Estrutura da IgM pentamérica do soro
Figura 8
Estrutura da IgM pentamérica do soro
 Figura 9
Estrutura da IgM de superfície celular
Figura 9
Estrutura da IgM de superfície celular
 Figura 10
Receptor de antígeno de célula B (BcR)
Figura 10
Receptor de antígeno de célula B (BcR) |
IgM
Estrutura
A estrutura da IgM está apresentada na Figura 8. IgM normalmente
existe como um pentâmero (imunoglobulina 19S) mas ela pode
também existir como um monômero. Na forma pentamérica todas as
cadeias pesadas são idênticas e todas as cadeias leves são
idênticas. Assim, a valência é teoricamente 10. IgM tem um
domínio extra na cadeia mu (CH4) e ela tem outra
proteína covalentemente ligada via uma ponde S-S chamada cadeia
J. Esta cadeia funciona em polimerização da molécula a um
pentâmero.
Propiedades
a) IgM é a terceira Ig mais comum no soro.
b) IgM é a primeira Ig a ser feita pelo feto e a primeira Ig
a ser feita por uma célula B virgem quando é estimulada pelo
antígeno.
c) Como consequência da sua estrutura pentamérica, IgM é uma
boa Ig fixadora do complemento. Assim, anticorpos IgM são
muito eficientes em levar à lise de microrganismos.
d) Como consequência da sua estrutura, IgM também é uma boa
Ig aglutinadora. Assim, anticorpos IgM são muito boas em
agregar microrganismos para eliminação eventual para fora do
corpo.
e) IgM liga-se a algumas células via receptores de Fc.
f) Ig de superfície de célula B
IgM de superfície existe como um monômero e não tem cadeia J
mas tem 20 aminoácidos extras na região C-terminal para se
ancorar na membrana (Figura 9). IgM de superfície celular
funcionam como um receptor para antígeno ou células B. IgM
de superfície é associada não covalentemente com duas
proteínas adicionais na membrana da célula B chamadas
Ig-alfa e Ig-beta como indicado na Figura 10. Essas
proteínas adicionais agem como moléculas de transdução de
sinal uma vez que a cauda citoplasmática da molécula de Ig
por si mesma é muito curta para transduzir um sinal. O
contato entre a superfície da imunoglobulina e um antígeno é
necessário antes de um sinal ser transduzido pelas cadeias
Ig-alfa e Ig-beta. No caso dos antígenos T-independentes,
contato entre o antígeno e a superfície da imunoglobulina é
suficiente para ativar as células B a se diferenciarem em
plasmócitos secretores de anticorpos. Entretanto, para
antígenos T-dependentes, um segundo sinal fornecido pelas
células T auxiliares é necessário para ativar as células B.
|

Figura 11
Estrutura de IgA

Figura 12
Origem da IgA solúvel |
IgA
Estrutura
A IgA do soro é um monômero mas a IgA encontrada em secreções é
um dímero como apresentado na Figura 11. Quando IgA sai do
dímero, uma cadeia J se associa a ela.
Quando IgA é encontrada em secreções também tem outra proteína
associada a ela chamada de peça secretora T; sIgA é às vezes
referida como imunoglobulina 11S. Ao contrário do resto da IgA
que é feito no plasmócito, a peça secretora é feita nas células
epiteliais e é adicionada à IgA à medida que esta passa através
das secreções (Figura 12). A peça secretora ajuda a IgA a ser
transportada através da mucosa e também a protege da degradação
nas secreções.
Propriedades
a) IgA é a 2a Ig mais comum no soro.
b) IgA é a principal classe de Ig em secreções – lágrimas,
saliva, colostro, muco. Uma vez que é encontrada em
secreções IgA secretora é importante na imunidade local (de
mucosa).
c) Normalmente IgA não fixa complemento, a menos que esteja
agregada.
d) IgA pode se ligar a algumas células - PMN's e alguns
linfócitos.
|
 Figura 13
Estrutura da IgD
Figura 13
Estrutura da IgD |
IgD
Estrutura
A estrutura da IgD está apresentada na Figura 13. IgD existe
somente como um monômero.
Propriedades
a) IgD é encontrada em baixos níveis no soro; seu papel no
soro é duvidoso.
b) IgD primariamente encontrada em superfícies de célula B
onde funciona como um receptor para antígeno. IgD na
superfície de células B tem aminoácidos extras na região
C-terminal para ancoramento à membrana. Ela também se
associa com as cadeias beta de Ig-alfa e Ig-beta.
c) IgD liga complemento.
|
 Figura 14
Estrutura da IgE
Figura 14
Estrutura da IgE |
IgE
Estrutura
A estrutura do IgE está apresentada na Figura 14. IgE existe como um
monômero e tem um domínio extra na região constante.
Propriedades
a) IgE é a Ig sérica menos comum uma vez que se liga fortemente com
receptores de Fc em basófilos e mastócitos mesmo antes da interação
com o antígeno.
b) Envolvida em reações alérgicas – Como consequência da sua ligação
a basófilos e mastócitos, IgE é envolvida em reações alérgicas.
Ligação do alergeno à IGe nas células resulta na liberação de vários
mediadores farmacológicos que resulta em sintomas alérgicos.
c) IgE também participa em doenças parasitárias por helmintos. Uma
vez que os níveis sorológicos de IgE aumentam em doenças
parasitárias, a quantificação dos níveis de IgE auxilia no
diagnóstico de infecções parasitárias. Eosinófilos têm receptores de
Fc para IgE e a ligação de eosinófilos a helmintos cobertos por IgE
resulta na morte do parasita.
d) IgE não fixa complemento.
|
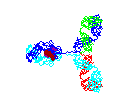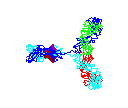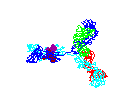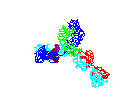 Figura 15
Anticorpo em rotação
© 2000
Antibody Resource Page
Figura 15
Anticorpo em rotação
© 2000
Antibody Resource Page
Antibody Concepts |
IMPLICAÇÕES CLÍNICAS DAS CLASSES DE IMUNOGLOBULINAS HUMANAS
Adaptado de:F.T. Fischbach in "A Manual of Laboratory
Diagnostic Tests," 2nd Ed., J.B. Lippincott Co., Philadelphia, PA, 1984.
IgG
Aumenta em:
a)
Infecções granulomatosas crônicas
b) Infecções de todos os tipos
c) Hiperimunização
d) Doenças hepáticas
e) Desnutrição (severa)
f) Disproteinemia
g) Doenças associadas com hipersensibilidade granulomas, desordens
dermatológicas, e mieloma de IgG.
h) Artrite reumatóide
Diminui em:
a)
Agamaglobulinemia
b) Aplasia linfóide
c) Deficiência seletiva IgG, IgA
d) Mieloma de IgA
e) Proteinemia de Bence Jones
f) Leucemia linfoblástica crônica
IgM
Aumenta (em adultos) em:
a)
Macroglobulinemia de Waldenström
b) Tripanosomíase
c) Actinomicose
d) Doença de Carrión (bartonelose)
e) Malária
f) Mononucleose infecciosa
g) Lúpus eritematoso
h) Artrite reumatóide
I) Disgamaglobulinemia (certos casos)
Nota:
No recém nascido, um nível de IgM superior a 20 ng./dl é uma indicação
de estimulação do sistema imune in utero e estimulação pelo
vírus da rubéola, citomegalovírus, sífilis, ou toxoplasmose.
Diminui em:
a)
Agamaglobulinemia
b) Desordens linfoproliferativas (certos casos)
c) Aplasia linfóide
d) Mieloma de IgG e IgA
e) Disgamaglobulinemia
f) Leucemia linfoblástica crônica
IgA
Aumenta em:
a)
Síndrome de Wiskott-Aldrich
b) Cirrose hepática (na maioria dos casos)
c) Certos estágios de desordens autoimunes do colágeno e outras, tais
como artrite reumatóide e lúpus eritematoso
d) Infecções crônicas não baseadas em deficiências imunológicas
e) Mieloma de IgA
Diminui em:
a)
Ataxia telangiectasia hereditária
b) Estados de deficiência imunológica (ex. disgamaglobulinemia,
agamaglobulinemia congênita e adquirida, e hipogamaglobulinemia)
c) Síndromes de mal absorção
d) Aplasia linfóide
e) Mieloma de IgG
f) Leucemia linfoblástica aguda
g) Leucemia linfoblástica crônica
IgD
Aumenta em:
a)
Infecções crônicas
b) Mielomas de IgD
IgE
Aumenta em:
a)
Doenças de pele atópicas tais como eczema
b) Febre do feno
c) Asthma
d) Choque anafilático
e) Mieloma de IgE
Diminui em:
a)
Agamaglobulinemia congênita
b) Hipogamaglobulinemia por defeito no metabolismo ou na síntese de
imunoglobulinas
|
|


|
 Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Esta página foi modificada em
Página mantida por
Richard Hunt
|

 Figura 8
Estrutura da IgM pentamérica do soro
Figura 8
Estrutura da IgM pentamérica do soro
 Figura 15
Anticorpo em rotação
© 2000
Antibody Resource Page
Figura 15
Anticorpo em rotação
© 2000
Antibody Resource Page