|
|
|
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
|
IMUNOLOGIA – CAPÍTULO DOIS
COMPLEMENTO
Dr. Gene Mayer
Professor Emeritus
University of South Carolina School of Medine
Tradução:
PhD. Myres Hopkins
|
|
EM INGLÊS
|
|
EM ESPANHOL |
|
SHQIP -
ALBANÊS |
|
Dê a
sua opinião
CONTATO |
|
BUSCA |
|
E-MAIL
DR MYRES HOPKINS |
|
ESCOLA DE MEDICINA DA
UNIVERSIDADE DA CAROLINA DO SUL |
|

 |
|
|
|
OBJETIVOS
Compreender os diferentes caminhos da
ativação do complemento (C).
Conhecer os mecanismos enzimáticos e não
enzimáticos da ativação do complemento
Conhecer as propriedades biológicas dos
produtos da ativação do complemento
Conhecer o significado do sistema C na
resistência do hospedeiro, inflamação e danos ao próprio
Compreender os mecanismos de regulação da ativação do complemento e seus
produtos
 Jules Bordet (1870-1961), descobridor do complemento
Biblioteca Nacional de Medicina
Jules Bordet (1870-1961), descobridor do complemento
Biblioteca Nacional de Medicina
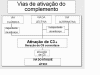 Figura 1
Figura 1
Etapas da ativação do complemento
|
FUNÇÕES DO
COMPLEMENTO
Historicamente, o
termo complemento (C) era usado para se referir a um componente termo lábil do
soro que era capaz de lisar bactéria (atividade destruída (inativada) pelo
aquecimento do soro a 56 graus C por 30 minutos). Entretanto, o complemento é
hoje conhecido por contribuir para as defesas do hospedeiro também de outras
maneiras. O complemento pode
opsonizar bactéria para uma melhor fagocitose; pode recrutar e ativar várias
células incluindo células polimorfonucleares (PMNs) e macrófagos; pode
participar na regulação de respostas de anticorpos e pode auxiliar na eliminação
de complexos imunológicos e células
apoptóticas. Complemento também tem efeitos detrimentais para o hospedeiro;
contribui para inflamação e danos tissulares e pode disparar
anafilaxia.
O complemento compreende mais de 20 proteínas séricas diferentes (ver Tabela 1)
que são produzidas por uma variedade de células incluindo, hepatócitos,
macrófagos e células epiteliais do intestino. Algumas proteínas do complemento
ligam-se a imunoglobulinas ou a componentes de membrana das células. Outras são
proenzimas que, quando ativadas, clivam uma ou mais outras proteínas do
complemento. Com a clivagem algumas das proteínas do complemento liberam
fragmentos que ativam células, aumentam a permeabilidade vascular ou opsonizam
bactéria.
|
Tabela 1. Proteínas do sistema Complemento
|
|
Via Clássica |
Via da Lectina |
Via Alternativa |
Via Lítica |
Proteínas
de ativação:
C1qrs, C2, C3, C4
Proteínas de Controle:
C1-INH, C4-BP
|
Proteína de ligação à manana (MBP), protease manana-associada a serina
(MASP, MASP2) |
C3,
Fatores B & D*, Properdina (P)
Fatores I* & H, fator acelerador de decaimento (DAF),
Receptor de complemento 1(CR1), etc.
|
C5, C6, C7, C8, C9
Proteína S |
|
Componentes
sublinhados adquirem atividade enzimática quando ativados.
Componentes marcados com um asterisco têm atividade enzimática na sua forma
inativa. |
|
| |
VIAS DE ATIVAÇÃO DO
COMPLEMENTO
A ativação do complemento pode ser dividida em quatro vias (figura 1): a via
clássica, a via da lectina, a via alternativa e a via do ataque à membrana (ou
via lítica). Ambas as vias clássica e alternativa levam à ativação da C5
convertase e resulta na produção de C5b que é essencial para a ativação da via
do ataque à membrana.
|
|
FILME
Ativação do Complemento e Funções Biológicas
Alta
Resolução Quicktime
Baixa Resolução Quicktime
© Scott R. Barnum, Universidade do Alabama, Birmingham, Ala., USA and
The
MicrobeLibrary
|
|
CGAP
Vias do complemento com mais detalhes da
CGAP/Biocarta |
VIA CLÁSSICA (Figura 2)
Ativação de C1
C1, uma proteína multi-subunitária contendo três
proteínas diferentes (C1q, C1r e C1s), liga à região Fc das moléculas de
anticorpo IgG e IgM que interagiram com antígeno. A ligação de C1 não ocorre a
anticorpos que não se complexaram com antígeno e a ligação requer íons cálcio e
magnésio. (N.B. Em alguns casos C1 pode ligar a imunoglobulinas
agregadas [ex. agregados de IgG] ou a certas superfícies em patógenos na
ausência de anticorpo). A ligação de C1 a anticorpo é via C1q e esta proteína
deve realizar ligação cruzada com pelo menos duas moléculas de anticorpo para
ser firmemente fixada. A ligação de C1q leva à ativação de C1r que por sua vez
ativa C1s. O resultado é a formação de uma “C1qrs” ativada, que é uma enzima
que cliva C4 em dois fragmentos C4a e C4b.
Ativação de C4 e
C2 (geração de C3 convertase)
O fragmento C4b liga-se à membrana e o fragmento
C4a é liberado no microambiente. “C1qrs” ativada também cliva C2 em C2a e C2b.
C2a liga-se à membrana em associação com C4b, e C2b é liberada no microambiente.
O complexo resultante C4bC2a é uma C3 convertase, que cliva C3 em C3a e C3b.
Ativação de C3
(geração de C5 convertase)
C3b liga-se à membrana em associação com C4b e
C2a, e C3a é liberada no microambiente. O C4bC2aC3b resultante é uma C5
convertase. A geração de C5 convertase é o fim da via clássica.
Alguns dos produtos da via clássica têm atividades
biológicas potentes que contribuem para as defesas do hospedeiro. Alguns desses
produtos também têm efeitos detrimentais se produzidos de maneira não regulada.
Tabela 2 sumariza as atividades biológicas dos componentes da via clássica.
|
Tabela
2. Atividade Biológica dos produtos da via clássica |
|
Componente |
Atividade Biológica |
| C2b |
Procinina; clivada pela
plasmina para liberar cinina, que resulta em edema |
| C3a |
Anafilotoxina;
pode ativar basófilos e mastócitos induzindo sua degranulação
resultando no aumento da permeabilidade vascular e contração das
células da musculatura lisa, levando à anafilaxia |
| C3b |
Opsonina;
promove fagocitose pela ligação a receptores do complemento
Ativação
de células fagocitárias |
| C4a |
Anafilotoxina
(mais fraca que C3a) |
| C4b |
Opsonina;
promove fagocitose pela ligação a receptores do complemento |
Se a via clássica não for regulada poderá haver produção contínua de C2b, C3a, e
C4a. Desse forma, deve haver uma maneira de regular a atividade da via clássica.
Tabela 3 sumariza as maneiras pelas quais a via clássica é regulada.
|
Tabela
3. Regulação da Via Clássica |
| Componente |
Regulação |
| Todos |
C1-INH;
dissocia C1r e C1s de C1q |
| C3a |
CInativador
C3a (C3a-INA;
Carboxipeptidase B); inactiva C3a |
| C3b |
Fatores H
e I;
Fator H
facilita a degradação de C3b pelo Fator I |
| C4a |
C3-INA |
| C4b |
Proteína
ligadora de C4 (C4-BP) e Fator I;
C4-BP facilita a degradação de C4b pelo Fator I; C4-BP também
previne a associação de C2a com C4b bloqueando assim a formação da
C3 convertase |
A importância de C1-INH na regulação da via clássica é demonstrada pelo
resultado de uma deficiência neste inibidor. Deficiências de C1-INH estão
associadas com o desenvolvimento de angioedema hereditário.
|
 A. Geração da C3
convertase na via clássica
A. Geração da C3
convertase na via clássica
 B Geração da C5 convertase na via clássica
B Geração da C5 convertase na via clássica
 C C
Ativação de C3 pela via clássica
Figura 2
|
 Figura 3 Via iniciada pela lectina
Figura 3 Via iniciada pela lectina |
VIA DA
LECTINA
A via da lectina (figura 3) é muito similar à via clássica. Ela é iniciada
pela ligação da lectina ligadora a manose (MBL) a superfícies bacterianas
com polissacarídeos (mananas) contendo manose. A ligação de MBL a um
patógeno resulta na associação de duas proteases de serina, MASP-1 e MASP-2
(MBL-proteases associadas a serina). MASP-1 e MASP-2 são similares a C1r e
C1s, respectivamente e MBL é similar a C1q. A formação do complexo
tri-molecular MBL/MASP-1/MASP-2 resulta na ativação das MASPs e subseqüente
clivagem de C4 em C4a e C4b. O fragmento C4b liga à membrana e o fragmento
C4a é liberado no microambiente. MASPs ativadas também clivam C2 em C2a e
C2b. C2a liga à membrana em associação com C4b e C2b é liberada no
microambiente. O complexo C4bC2a resultante é a C3 convertase, que cliva C3
em C3a e C3b. C3b liga-se à membrana em associação com C4b e C2a e C3a é
liberada no microambiente. O C4bC2aC3b resultante é a C5 convertase. A
geração da C5 convertase é o fim da via da lectina.
As atividades biológicas e proteínas reguladoras da via da lectina são as
mesmas da via clássica.
|
 Figura
4 Ativação espontânea de C3 Figura
4 Ativação espontânea de C3 |
VIA AlternativA
A via alternativa começa com a ativação de C3 e requer Fatores B e D e
cátions Mg++ , todos presentes no soro normal.
Circuito de amplificação da formação de C3b (Figura 4)
No soro há um baixo nível de hidrólise espontânea de C3 para produzir
C3i. O fator B liga-se a C3i e se torna susceptível ao Fator D, que
cliva o Fator B em Bb. O complexo C3iBb age como uma C3 convertase e
cliva C3 em C3a e C3b. Uma vez formado C3b, o Fator B ligar-se-á a ele e
tornar-se-á susceptível à clivagem pelo Fator D. O complexo C3bBb
resultante é uma C3 convertase que continuará a gerar mais C3b,
amplificando assim a produção de C3b. Se este processo continuar sem
parar, o resultado seria o consumo de todo o C3 do soro. Dessa forma, a
produção espontânea de C3b está estreitamente controlada.
|

 Figura 5
Figura 5
Regulação de C3 ativada pelo DAF
 Figura
6 Regulação de C3 ativada pelo Cr1
Figura
6 Regulação de C3 ativada pelo Cr1
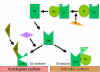 Figura
7 Estabilização da C3 convertase Figura
7 Estabilização da C3 convertase
 Figura 8
Figura 8
C5 convertase etabilizada pela via alternativa
|
Controle do circuito de amplificação (Figuras
5 e 6)
Como C3b espontaneamente produzida liga-se a membranas hospedeiras
autólogas, este interage com DAF (fator de aceleração de decaimento),
que bloqueia a associação do Fator B com C3b prevenindo dessa maneira a
formação de C3 convertase adicional. Além disso, DAF acelera a
dissociação de Bb de C3b na C3 convertase que foi formada, parando dessa
maneira a produção de C3b adicional. Algumas células possuem o receptor
de complemento 1 (CR1). A ligação de C3b a CR1 facilita a degradação
enzimática de C3b pelo Fator I. Além disso, a ligação da C3 convertase
(C3bBb) a CR1 também dissocia Bb Fo complexo. Dessa maneira, em células
possuidoras de receptores do complemento, CR1 também exerce papel no
controle do circuito de amplificação. Finalmente, Fator H pode ligar a
C3b ligado a uma célula ou na fase fluida e facilita a degradação
enzimática de C3b pelo Fator I. Dessa forma, o circuito de amplificação
é controlado pelo bloqueio da formação da C3 convertase, dissociação da
C3 convertase, ou pela digestão enzimática de C3b. A importância do
controle desse circuito de amplificação é ilustrada em pacientes com
deficiências genéticas do Fator H ou I. Esses pacientes têm uma
deficiência de C3 e elevada susceptibilidade a certas infecções.
Estabilização da C convertase por superfícies ativadoras (protetoras)
(Figura 7)
Quando ligado ao ativador apropriado da via alternativa, C3b liga-se ao
Fator B, que é clivado enzimaticamente pelo Fator D para produzir C3
convertase (C3bBb). Entretanto, C3b é resistente à degradação pelo Fator
I e a C3 convertase não é rapidamente degradada, uma vez que é
estabilizada pela superfície ativadora. O complexo é subseqüentemente
estabilizado pela ligação da properdina a C3bBb. Ativadores da via
alternativa são componentes na superfície de patógenos e incluem: LPS de
bactéria Gram-negativa e as paredes celulares de algumas bactérias e
leveduras. Dessa forma, quando C3b liga-se a uma superfície ativadora, a
C3 convertase formada torna-se estável e continua a gerar mais C3a e C3b
pela clivagem de C3.
Geração da C5 convertase (Figura 10)
Algumas das C3b geradas pela C3 convertase estabilizada na superfície
ativadora se associam com o complexo C3bBb para formar um complexo
C3bBbC3b. Este é a C5 convertase da via alternativa. A geração de C5
convertase é o fim da via alternativa. A via alternativa pode ser
ativada por muitas bactérias Gram-negativas (sendo as mais
significativas a Neisseria meningitidis e N. gonorrhoea), algumas Gram-positivas
e certos vírus e parasitas, e resulta na lise desses organismos. Dessa
forma, a via alternativa de ativação do C proporciona outro meio de
proteção contra certos patógenos antes da montagem de uma resposta por
anticorpo. A deficiência de C3 resulta em uma susceptibilidade aumentada
a esses organismos. A via alternativa deve ser uma via mais primitiva e
as vias clássica e da lectina provavelmente teriam se desenvolvido a
partir da via alternativa.
|
| |
|
| |
Lembrem-se de
que a via alternativa proporciona um meio de resistência não específica contra
infecção sem a participação de anticorpos e, portanto fornece a primeira linha
de defesa contra uma variedade de agentes infecciosos.
Muitas bactérias
gram negativas
e algumas
gram positivas,
certos vírus, parasitas, células vermelhas heterólogas, agregados de
imunoglobulinas (particularmente IgA) e algumas outras proteínas (ex. proteases,
produtos da via de coagulação) pode ativar a via alternativa. Uma proteína, o
fator do veneno da cobra (CVF), tem sido extensivamente estudada pela sua
habilidade de ativar esta via.
|
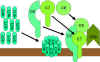 Figura
9 Via lítica
Figura
9 Via lítica |
VIA DO ATAQUE À MEMBRANA (LÍTICA)
(figura 9)
A C5 convertase das
vias clássica (C4b2a3b), da lectina (C4b2a3b) ou alternativa (C3bBb3b) cliva C5
em C5a e C5b. C5a permanece na fase fluida e C5b se associa rapidamente com C6 e
C7 e se insere na membrana. Subsequentemente C8 liga-se, seguido por algumas
moléculas a C9. As moléculas C9 formam um poro na membrana através do qual os
conteúdos celulares vazam e ocorre a lise. A lise não é um processo enzimático;
acredita-se que seja devido ao dano físico à membrana. O complexo consistindo em
C5bC6C7C8C9 é referido como complexo de ataque à membrana (MAC).
C5a gerado na via lítica tem várias e potentes atividades biológicas. É a mais
potente
anafilotoxina. Além disso, é um fator quimiotáctico para neutrófilos e
estimula a queima respiratória neles e estimula a produção de citocina
inflamatória pelos macrófagos. Sua atividade é controlada pela inativação pela
carboxipeptidase B (C3-INA).
Alguns dos complexos C5b67 formados podem se dissociar da membrana e entrar na
fase fluida. Se for isso o que acontece então ele pode se ligar a outras células
vizinhas e provocar sua lise. A lesão a células das vizinhanças é impedida pela
Proteína S (vitronectina). Proteína S liga-se ao C5b67 solúvel e impede sua
ligação a outras células.
|
 Figura
10 Regulação de C1rs (C4 convertase) pelo C1-INH Figura
10 Regulação de C1rs (C4 convertase) pelo C1-INH |
PRODUTOS BIOLOGICAMENTE ATIVOS DA
ATIVAÇÃO DO COMPLEMENTO
Ativação do
complemento resulta na produção de várias moléculas biologicamente ativas que
contribuem para a resistência,
anafilaxia
e inflamação.
Produção de
Cinina
C2b gerada durante a via clássica da ativação do C é uma procinina que torna-se
biologicamente ativa após alteração enzimática pela plasmina. A produção
excessiva de C2b é impedida pela ativação limitada de C2 pelo inibidor C1
(C1-INH) também conhecido como serpina que desacopla C1rs do complexo C1qrs
(Figura 10). Uma deficiência genética de C1-INH leva à superprodução de C2b e é
a causa do edema angioneurótico. Esta condição pode ser tratada com
Danazol
que promove a produção de C1-INH ou com ácido ε-amino capróico que diminui a
atividade da plasmina.
|
|
|
Anafilotoxinas
C4a, C3a e C5a (em ordem crescente de atividade) são todas as anafilotoxinas que
causam degranulação celular de basófilos/mastócitos e contração de células da
musculatura lisa. Efeitos indesejáveis desses peptídios são controlados pela
carboxipeptidase B (C3a-INA).
Fatores
Quimiotácticos
C5a e
MAC (C5b67) são ambos quimiotácticos. C5a é também um potente ativador de
neutrófilos, basófilos e macrófagos e causam indução de moléculas de adesão nas
células endoteliais vasculares.
Opsoninas
C3b e
C4b na superfície de microrganismos se encaixam no receptor do C (CR1) em
células fagocitárias e promovem fagocitose.
Outros
produtos biologicamente ativos da ativação do C
Os
produtos de degradação de C3 (iC3b, C3d e C3e) também se ligam a células
diferentes através de receptores distintos e modulam suas funções.
Em resumo, o
sistema do complemento toma parte na resistência específica e não específica e
gera uma variedade de produtos de significância biológica e patofisiológica
(Tabela 4).
Há
deficiências genéticas conhecidas para a maioria dos componentes individuais do
complemento, mas a deficiência de C3 é mais séria e fatal. Deficiências do
complemento podem ocorrer em doenças imunes complexas como o lúpus eritematoso
sistêmico (SLE) e infecções bacterianas, virais e parasitárias agudas e
crônicas.
|
|
|
|
|
|
|
Tabela 4. Atividades dos Produtos de Ativação do Complemento e
seus Fatores de Controle |
|
Fragmento |
Atividade |
Efeito |
Fator
(ES) de Controle |
| C2a |
Procinina, acúmulo de fluidos |
Edema |
C1-INH |
| C3a |
Degranulação de basófilos e mastócitos; aumento da
permeabilidade vascular, contração da musculatura lisa |
Anafilaxia |
C3a-INA |
| C3b |
Opsonina, ativação de célula fagocitária |
Fagocitose |
Factores H e I |
| C4a |
Degranulação de basófilo e mastócito; aumento da permeabilidade
vascular, contração da musculatura lisa |
Anafilaxia
(menos potente) |
C3a-INA |
| C4b |
Opsonina |
Fagocitose |
C4-BP
e Fator I |
| C5a |
Degranulação de basófilo e mastócito; aumento da permeabilidade
vascular, contração da musculatura lisa |
Anaphylaxis
(most potent) |
C3a-INA |
|
Quimiotaxia, estimulação da queima respiratória, ativação de
células fagocitárias, estimulação de citocinas inflamatórias |
Inflamação |
| C5bC6C7 |
Quimiotaxia |
Inflamação |
Proteína S (vitronectina) |
|
Liga-se a outras membranas |
Danos
de tecido |
|
|
Você aprendeu
As proteínas do sistema complemento
As diferenças e semelhanças entre as
diferentes vias de ativação de C3
O significado das diferentes vias na
imunidade específica e não específica
O papel dos diferentes produtos de
ativação do complemento na amplificação da imunidade não específica e
específica e na inflamação
|
|
Tabela 5. Deficiências do complemento e doença |
|
Via/Componente |
Doença |
Mecanismo |
|
Via
Clássica |
|
| C1INH |
Angioedema hereditário |
Superprodução de C2b (procinina) |
| C1, C2, C4 |
Predisposição ao SLE |
Opsonização de complexos imunes ajuda a mantê-los solúveis, a
deficiência resulta no aumento da precipitação em tecidos e
inflamação |
|
Via da
Lectina |
|
| MBL |
Susceptibilidade a infecções bacterianas em bebês ou
imunodeprimidos |
Inabilidade de iniciar a via da lectina |
|
Via
Alternativa |
|
|
Fatores B ou D |
Susceptibilidade a infecções bacterianas piogênicas (formadoras
de pus) |
Insuficiência de opsonização da bactéria |
| C3 |
Susceptibilidade a infecções bacterianas |
Ausência de opsonização e inabilidade de utilizar a via do
ataque à membrana |
| C5, C6, C7 C8, e C9 |
Susceptibilidade a infecções Gram-negativas |
Incapacidade de atacar a membrana externa de bactéria
Gram-negativa |
|
Properdina (ligada ao X) |
Susceptibilidade a meningite meningocócica |
Ausência de opsonização da bactéria |
|
Fatores H ou I |
Deficiência de C3 e susceptibilidade a infecções bacterianas |
Ativação descontrolada de C3 pela via alternativa em depleção de
C3 |
|
|


|
 Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Esta página foi modificada em
Página mantida por
Richard Hunt
|

 A. Geração da C3
convertase na via clássica
A. Geração da C3
convertase na via clássica Figura 3 Via iniciada pela lectina
Figura 3 Via iniciada pela lectina
 Figura
10 Regulação de C1rs (C4 convertase) pelo C1-INH
Figura
10 Regulação de C1rs (C4 convertase) pelo C1-INH




