|
xx |
xx |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VİROLOJİ |
|
DNA tümör virüsleri ayrı bir sayfaya taşındı
İzleyin Önceki aşağıda
|
VIROLOJİ - BÖLÜM ALTI
KISIM İKİ
ONKOJENIK VIRUSLAR
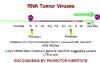
RNA Tümör Virusları
Retroviruslar
Dr Richard Hunt
Professor
Department of Pathology, Microbiology and Immunology
University of South Carolina School of Medicine
Çeviren. Prof. Dr.
Selçuk Kaya
İzmir Katip Çelebi Üniversitesi, Tıp Fakültesi
|
|
ENGLISH |
|
EN
FRANCAIS |
|
En
Español |
|
NË SHQIPTARE |
|
|
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|

 |
|
|
|
|
|
Şekil 10
 Retrovirus
replikasyonu Retrovirus
replikasyonu
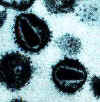 Human immunodeficiency virus
Human immunodeficiency virus
Copyright Department of Microbiology, University of Otaga, New Zealand.
 Şekil 11
Şekil 11
Retrovirusların yapısı: (virüs, human immunodeficiency virus-1da
gösterildi)
From the Harvard AIDS Institute Library of Images,
courtesy of Critical Path AIDS Project, Philadelphia.
|
RNA tümör virüsleri DNA genomlarının RNA
olması bakımından DNA tümör virüslerinden farklıdır ancak genomlarının
konak genomuna entegre olması bakımından birçok DNA tümör virüslerine
benzemektedirler.
RNA olgun virüs partikülünün genomunu
oluşturduğundan konak hücre kromozomuna entegre olmadan cDNAya
çevrilmesi gerekir. Bu yaşam stili (şekil 10) DNAnın RNAya
kopyalandığı santral dogmanın tersine gitmektedir.
RNA tümör virüsleri veya onkornavirüsler
retrovirüs ailesinin üyeleridir.
Retrovirus yapısı
Dış zarf konak hücre plazma
membranından gelir (Şekil 11).
Kılıf proteinleri (yüzey antijenleri) env (zarf) geni tarafından
kodlanır ve glikozillenir. Bir primer gen ürünü oluşur ancak bu
kesiktir. Bu yüzden olgun bir virüste birden fazla yüzey
glikoproteini bulunmaktadır (kesim konak enzimiyle golgi aygıtında
gerçekleşir). Primer protein (kesimden önce) endoplasmik retikuluma
bağlı ribozomlar üzerinde yapılır ve bu bir transmembran (tip1)
proteindir.
Membranın iç kısmı gag genleri (Grup-spesifik
AntiGen) tarafından kodlanan proteinleri içeren ikozahedral
kapsiddir. Gag tarafından kodlanan proteinler aynı zamanda genomik
RNAyı da kaplar. Tekrar burada bir perimer gen ürünü bulunur. Bu,
viral olarak kodlanmış proteaz ile (pol geninden) kesilir.
Her virüs partikülünün 5cap ve 3 poli A sekanslarının bulunduğu
iki molekül genomik RNAsı vardır. Bu yüzden virüs diploiddir. RNA
pozitif anlamlıdır (mRNA ile aynı anlamlı).
Olgun virüste reverse transkriptazın
yaklaşık 10 kopyası bulunur. Bunlar pol genleridir.
Pol geni birçok fonksiyonu kodlar (tekrar, gag ve envde olduğu gibi,
daha sonradan kesilen bir poliprotein)
|
 Şekil 12
Şekil 12
RSV proteaz yapısı HIV ayrılma sitesinin bir peptit analoğuna bağlı
Requires Chime plug-in.
|
Pol gen ürünleri şunlardır:
a) Reverse transkriptaz (RNAyı DNAya
kopyalayan polimeraz)
b) İntegraz (viral genomu konak genomuna entegre eder)
c) RNAse H (DNA transkribe edilirken RNAyı keser ki reverse
transkriptaz DNAnın ikinci komplementer ipliğini yapsın)
d) Proteaz (gag geni ve pol geninin kendilerinden eksprese edilmiş
mRNAlardan transle edilen poliproteinleri keser). Bu viral olarak
kodlanmış proteaz anti-viral ilaçların yeni jenerasyonunun hedefidir
(şekil 12).
|
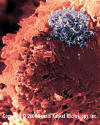 Şekil 13
Şekil 13
HTLV-1 ile İnsan T lenfosit infeksyionu (RNA virus, Retroviridae Ailesi).
Virüs köşedeki büyük bir yığındır.
© Dennis Kunkel Microscopy, Inc. Used with permission
|
RETROVIRUS GRUPLARI
Oncovirinae
Bunlar tümör virüsleridir ve morfolojileri benzerdir. Bu
grubun ilk keşfedilen üyesi Rous Sarkoma Virüsüdür (RSV). Tavuklarda
yavaş neoplazmiye sebep olur.
Bu gruptaki insanlarda tümörlere sebep olan virüsler:
HTLV-1 (insan T-hücre lenfotropik virüs-1, şekil 13) yetişkin T-hücre
lösemisine (Sezary T-hücre Lösemisi) sebep olur. Bu hastalık bazı
Japon adalarında, Karayipler, Latin Amerika ve Afrikada
bulunmaktadır. HTLV-1 cinsel yolla bulaşmaktadır.
HTLV-2 (insan T-hücre lenfotropik virüsü-2) Tüylü Hücre Lösemisine
sebep olur. Bu virüs Amerikadaki çok spesifik bölgelerde özellikle
yerli Amerikan popülasyonlarında endemiktir.
Lentivirinae
Hastalık oluşmadan önce uzun bir latent enfeksiyon periyoduna
sahiptirler. Temelde toynaklı hayvan hastalıklarıyla ilişkilidir
(ör; visna virüs) ancak AIDSe sebep olan HIV (önceden HTLV-III) bu
gruba dahildir. Bazı Lentivirinae üyelerine Onkovirinae ailesindeki
HTLV-I ve HTLV-II den daha yakındır.
Spumavirinae
Bu virüslerin patolojik etkilerine yönelik bir kanıt
bulunmamaktadır. Birçok hayvan türünde inatçı enfeksiyonlara sebep
olur. Primatlar (insanları içeren), sığır, kedi, hamster ve deniz
aslanından izole edilmişlerdir. Spumavirüslerle enfekte olan
hücreler köpüklü bir görüntüye sahiptir (sayısız vakuollerden
dolayı) ve sıklıkla devasa çok nükleuslu hücrelerden sinsisya
oluşturur. Şempaze (simian) köpüklü virüsü tip türüdür. İnsan
köpüklü virüsü simian köpüklü virüsün bir varyantıdır ve genellikle
maymun ısırmasından bulaşır.
|
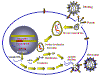 Şekil 14
Şekil 14
Retrovirusun bir hücredeki prodüktif infeksiyon aşamaları
|
BİR HÜCRENİN RETROVİRÜS
TARAFINDAN ENFEKTE OLMASI VE TRANSFORMASYONU
Aşağıdaki basamaklar enfeksiyon prosesinde gerçekleşir (şekil 14):
- Spesifik hücre yüzey reseptörüne bağlanma
- Endositoz veya plazma membranına direkt füzyonla alımı. Bazıları
(ör; HIV) plazma membranına direkt olarak füze olabilirken bu
virüsün, füzyon oluşmadan önce düşük pH endozoma girmesi gerekebilir.
- RNA (pozitif anlamlı) negatif anlamlı DNAya reverse
transkriptaz ile kopya edilir. Burada polimeraz RNA-bağımlı DNA
polimeraz olarak rol oynar. Reverse transkriptaz bir DNA polimeraz
olduğundan bir primere ihtiyacı vardır. Bu, önceki konak hücreden
virüs partikülüne katılan ir tRNAdır.
- RNA yer değiştirir ve virüsle kodlanan Rnaz H aktivitesiyle
parçalanır. Artık reverse transkriptaz DNA-bağımlı DNA polimeraz
gibi davranır ve yeni DNAyı çift iplikli DNA olacak şekilde
kopyalar. Virüsün bu DNA formu provirüs olarak bilinir.
- Çift iplikli DNA halkasaldır ve viral olarak kodlanan integraz
enzimiyle konak hücre DNAsına entegre olur (aşağıya bakınız). Bu
DNA hücresel DNA her kopyalandığında kopyalanır. Bu yüzden, bu
aşamadaki provirüssadece normal hüce geni gibidir.
- Tam uzunluktaki genomik RNA,konak RNA polimeraz II tarafından
entegre DNAdan kopyalanır. Bu enzim normalde geni mRNAya kopyalar.
Aynı mRNAda olduğu gibi genomik RNAya başlık eklenir ve poli
adenillenir.
Tam uzunluktaki genomik RNA mesajla aynı anlamlı olduğundan aynı
zamanda GAG ve POL poliproteinleri için mRNA olarak rol oynar.
Genomik RNA, ENV gibi diğer proteinler için mRNA vermek amacıyla
konak nüklear enzimleri tarafından işlenir. HTLV-1 ve HIV gibi daha
kompleks bazı retrovirüslerin RNAları çoklu splicing geçirir (bölüm
7ye bakınız, HIV).
mRNAnın genomik RNAnın işlenmesinden oluşur veya genomik RNAdır.
Sonuç olarak, hem mRNA hem de genomik RNA aynı anlamlı olamk
zorundadır. mRNA pozitif anlamlı olduğundan bütün retrovirüslerin
genomik RNAları da pozitif anlamlı olmalıdır.
Bu tip bir replikasyonun avantajı, sadece konak hücre polimerazı
virüs tarafından alıkonduğunanbütün hücrelerde bulunan RNA polimeraz
II olduğundan dolayı farklılaşmış hücrelerde büyümeyi sağlar.
|
| |
VIRAL GENOM REPLIKASYON
MEKANİZMASI
Eğer konağın RNA polimeraz IIsi DNAdan
tekrar RNA kopyalamak için kullnılırsa, DNA provirüsüne sahip olmakla
ancak olgun virüs partikülünde RNA genomuna sahip olmakla büyük
problemler oluşur.
Bu problemler şunları içerir:
- RNA polimeraz II genlerin upstream
ve down stream kontrol sekanslarını kopyalamaz. Sadece bir
protein yapmak için gerekli bilgileri kopyalar.
- RNA polimeraz II ile proof
readingin olmaması
Bütün geni kopyalamak için
RNA polimeraz IInin yetersizliği
Problem, genlerin transkribe edilirken
RNA polimeraz IInin transkripsiyon başlangıç bölgesinin up
streaminde bulunan kontrol ve tanıma bölgelerine ihtiyaç duymasıdır.
Polimeraz molekülünün upstreamde bağlandığı bölge PROMOTORdur.
Promotorların kendileri bir proteinin translasyonunda görev
almadıkları için mRNAya kopyalanmazlar. Promotora bağlandıktan
sonra polimeraz, RNA başlangıç bölgesi olan downstream bölgesinde
transkripsiyona başlar. Polimeraz sonlandırma/poliadenilasyon
sinyaline ulaşıncaya kadar DNAyı RNAya transkribe eetmeye devam
eder. Bu sinyal, protein yapımında herhangi bir fonksiyonu olmayan
kopyalanmayan bölgedir. Bunun ötesinde, transkribe olan bölgenin hem
up hem de down streami genlerin transkripsiyonunu düzenleyen kontrol
sekanslarıdır. Bunlara ARTTIRICI denir. Bunlar herhangi bir genin
önemli kısımlarıdır ve RNA polimerazın iş görmesi için bulunması
gereklidir ancak bunlar RNAya kopyalanmaz. Çünkü konak hücredeki
RNA polimeraz II nin translasyondan sonra dağılan mesajcı RNA yapma
fonksiyonu vardır. Bir protein yapmak için gerçek mRNA molekülünün
orjinal genin kontrol sekanslarına ihtiyacı yoktur. Bu yüzden
konağın RNA polimeraz IIsini kullanması orjinal genomdaki kontrol
sekanslarının progeni virionların RNA genomlarına girmesi gerektiği
anlamına gelir.
Bu, ya viral RNA genom virüsünün DNA
kopyasıkonak durdurma bölgelerinden (gerçekten uzun bir sipariş!)
konak promotor ve upstreaminden konak DNA downstreamine entegre
olmak zorundadır ya da kendi kontrol sekanslarını sağlamanın bir
yolunu bulmak zorundadur (daha önce söylediğimiz gibi progeni
genomuna kopyalanmayan kontrol sekansları). İkinci yolu daha
kompleks bir şekilde yapar.
|
Şekil 15
A
 Olgun retrovirus RNA genomunun yapısı
Olgun retrovirus RNA genomunun yapısı
B
 Retrovirus DNA proviral formunun genom yapısı
Retrovirus DNA proviral formunun genom yapısı
|
Bir retrovirüs, DNA
provirüsü genomik RNA formuna kopyalandığında transkribe
edilmediğinde kendi kontrol promotorları ve arttırıcılarını nasıl
sağlar?
Bir retrovirüsün bunu nasıl yaptığının özeti (tamamlanmamış) şu
şekildedir:
- Viral RNA üç bölgeden oluşur. Her bir uç tekrarları içerir (bunlara
terminal tekrarlar denir). Tekrarlayan sekanslar (R) (şekil
15de yeşşile gösterilmiştir) proteinleri kodlamaz. İki tekrar
arasında tek bir bölge vardır (tekrarlanmayan). Bu bölgede,
proteinleri kodlayan viral genleri (GAG, POL, ENV) ve her iki
ucunda yine protein kodlamayan diğer tekrarlanmayan sekanslar
bulunur. RNA genomunun 5 ucunun yanında U5 bölgesi bulunur ve
3 ucunun yanında da U3 bölgesi bulunur. PBS (şekil 15de)
primer bağlanma bölgesidir. tRNA, reverse transkriptaz RNAyı
kopyalamaya başladığında buraya bağlanır. PPT polipürin
sistemidir.
- Entegre formunda (DNA transkribe olduğunda ve konak hücre
kromozomuna entegre olduğunda) provirüs daha komplike haldedir.
RNA genomun 3 tekrarlanmayan bölgesinin br kısmı (U3)
kopyalandığını ve genomun zıt ucuna gönderildiğini buluruz. Buna
karşın, tekrarlamayan bölgenin (U5) 5 ucunun ir kısmı
kopyalanmıştır ve diğer uca gönderilmiştir. Bu, entegre DN
yapısını şekil 15Bde gösterildiği şekilde verir. Kolaylık için
DNAnın sadece bir zinciri gösterilmiştir.
|
|
VIDEO
LTR formasyonu
Flash gerektirir |
Günümüzde tabi ki, U3 ve U5 de tekrarlandığından dolayı daha büyük
terminal tekrarlar bulunmaktadır. U3-R*U5 bölgeleri uzun terminal
tekrarlar veya LTRler olarak bilinmektedir. U3 bölgesi promotor
bilgisinin hepsini içerir. Bu bilgi R bölgesinin (tekrar) başlangıcında
RNA transkripsiyonunu başlatmak için gereklidir. U5 bölgesi ise diğer R
bölgesinden sonra durdurma için gerelidir. Buna ek olarak, LTRler üç
retroviral genin (arttırıcı bölgeler) transkripsiyon seviyesini arttıran
bilgiyi içerir. Bu arttırıcılar genlerin protein kodlayan kısımlarının
upstreami veya downstreami olabilir.
|
| |
 Şekil 16
Şekil 16
RNA polimeraz II tarafından LTRs ile retroviral DNA transkripsiyonu
LTRs'lerin kaybına yol açar
Animated version
here |
Konak RNA polimeraz IIsi proviüs DNAyı genomik RNAya kopya eder.
Daha sonra da mRNAya transkribe edilir. Polimeraz, transkripsiyon
başlangıç bölgesinde promotordan (U3de) sonra başladığından dolayı tam
olarak R bölgesinden başlar (şekil 16). Bu yüzden de hücreye giren doğru
RNA kopyasını elde ederiz (neredeyse). Sonlandırma sekansları ve poli A
sinyalleri U5tedir ve kopya edilmezler.
Bu mekanizmadan dolayı üç viral gen için sadece bir promotor bölgesi
(U3den) bulunabilir bu yüzden hepsinin birlikte transkribe edilmesi gerekir.
Konak hücre nüklear işleme makinesinden elde edilen işleme enzimleri gerekli
olduğu yerde bireysel mRNAları oluşturmak için primer transkripi keser (Bölüm
7yi inceleyiniz. Burada HIV iyi anlatılmıştır). DNA tümör virüslerinin
olduğu durumdan farklı olarak erken/geç fonksiyonların arasında bir
farklılık yoktur.
U5 durdurma ve poliadenilasyon bölgeleri içeriyorsa transkriptin neden
LTRnin sadece ilk R bölgesinin uunu durdurmadığını ve yapısal genlere neden
hiçbir zaman katılmadığını sorabilirsiniz. İlk U5deki sonlandırma bölgesi
genellikle kompleks sekonder yapı mekanizmasıyla baskılanır. Bazı
retrovirüslerde gag geninde bir sekans bulunmaktadır. Bu sekans, ilk U5in
sonlandırma akivitesini baskılamak için şartları sağlar. Açıkçası, ikinci
U5in bunu izleyen bir gag geni yoktur.
Viral RNAnın DNAya kopyalandığı (reverse transkriptaz ile) daha sonra
da mRNAnın ve proteinin oluştuğu virüs replikasyonunun bu stratejisi virüs
için diğer bir probleme sahiptir. İlk basamak (RNAdan DNAya) normal
hücrede olmayan viral enzimle gerçekleşir. Bundan dolayı bu transkripsiyon
basamağı mRNA transkripsiyonu veya protein translasyonu oluşmadan öne
gerçekleşmelidir. Bu problem virüsün kendisiyle birlikte hücreye giren 10
kopya reverse transkriptaz proteinin içeren virüsle çözülür. Bunlar, virüs
öneki konak hürede bir araya geldiğinde paketlenir. Teoride, hücreye giren
viral genomik RNA mRNA gibi davranabilir ancak böyle davranmak için çok
fazla proteinle kaplıdır. Bu yüzden, reverse transkriptaz sentezine ihtiyaç
duyan yeni mRNA yapılmalıdır.
|
| |
|
 Şekil 17
Şekil 17
Tipik retrovirus yapısı ve bir onkogen ile bir retrovirusun yapısı (Rous
Sarcoma Virus)
|
RETROVIRUSLARDA ONKOGENLER
Şekil 15Ada ve şekil 17nin üst kısmında gösterilen yapı üç yapısal genleri
(gag, pol ve env) içeren tipik retrovirüstür ancak bu genlerin hiçbirisi
onkojenik değildir. Eğer virüs bir hücreyi transforme etmesi için, hücresel DNA
sentezini değiştiren sekanslara ve transforme hücrenin tipik diğer
fonksiyonlarına sahip olmalıdır. Bunlar gag/pol/env genomlarına ek olarak
bulunur.Bu yüzden aynı zamanda neoplazi için hücreleri transforme eden birçok
retrovirüsün viral genomunda ONKOGEN (onc) bulduk (şekil 17). RNA tümör
virüslerindeki onkogenin viral replikasyon için gerekli olmadığı unutulmamalıdır.
Bu da virüse konak hüreye transformasyon kabiliyetini kazandıran ek bir gendir.
Viral olarak uyarılan transformasyonun tanımı: bir hücrenin biyolojik
fonksiyonunda ve antijenik spesifitesindeki değişikliklerdir. Bu, viral genetik
sekansların hücresel genoma entegrasyonuyla gerçekleşir ve neoplazinin belirli
özelliklerine sahip enfekte hücrede görülmektedir. Ancak transformasyonun
virüsler dışındaki faktörlerle de, ör; karsinojenler gibi, uyarılabileceği
unutulmamalıdır.
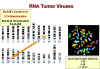
Retrovirüslerdeki onkojenik genler
nelerdir?
Retrovirüslerde bunlar Rous sarkoma virüs (RSV)deki ekstra gen olarak ilk
keşfedilen genlerdir (şekil 17). Bu gen src (sarkoma için) olarak
adlandırılmaktadır. Src viral replikasyon için gerekli değildir. Virüsün
devam eden üremesi için gerekli olan (gag/pol/env) genlere ek olan ekstra
bir gendir. RSVnin tam bir gag/pol/env genomu vardır. Srcdeki delesyonlar/mutasyonlar
transformasyon ve tümör başlangıcını durdurur ancak virüs hala daha diğer
fonksiyonları yapabilir durumdadır. RSV gag/pol/env bakımından tam olan
genomunu devam ettirme yeteneğinden dolayı olağan dışıdır.
|
| |
RSVnin aksine birçok retrovirüs bir
onkogen içermek için kendi genomlarının belirli bir kısmını kayberler (şekil
18). Bunun iki sonucu vardır:
- Onkogen tarafından kodlanan protein
genellikle diğer viral olarak kodlanmış amino asitlerle bağlı füzyon
proteinlerinin belli bir kısmıdır
- Virüs kendisini tamamen çoğaltamıyorsa
sıkıntıda demektir. Konak hücreden replike olup hücreden ayrılması için
yardımcı virüs denen başka bir virüse ihtiyaç duyar.
Günümüzde yaklaşık kırk onkogen tanımlanmıştır.
Bunların üç harfli kodlanarak isimlendirildiğini unutmayın (ör; src, myc).
Genellikle ilk olarak izole edildikleri virüsü yansıtırlar. Bazı virüsler
birden fazla onkogen içerebilir (Ör; erbA, erbB). Bunlar viral onkogenler
olduklarından dolayı bu üç harfli kodun önüne v harfini koyduk. En çok
çalışılanlardan bazıları şunlardır:
|
Virus |
Onkogen |
|
Rous sarcoma virus |
v-src |
|
Simian sarcoma virus |
v-sis |
|
Avian erythroblastosis virus |
v-erbA or v-erbB |
|
Kirsten murine sarcoma virus |
v-kras |
|
Moloney murine sarcoma virus |
v-mos |
|
MC29 avian myelocytoma virus |
v-myc |
|
| |
HÜCRELER PROTO-ONKOGENLERE
SAHİPTİR Retroviral onkogenler keşfedildiğinde süpriz bir
gözlem yapıldı: gerçek viral genler olan DNA virüs onkogenleriyle olan
durumların aksine retrovirüsle enfekte olmamış hücrelerde bütün retrovirüs
onkogenlerinin homologları bulunmaktadır. Bu hücresel homologlar sıklıkla büyüme
kontrolünde ve gelişim/farklılaşmada (beklenildiği gibi) yer alırlar ve hücrede
önemli transforming olmayan fonksiyonları vardır. Belirli durumlarda bazıları
kansere sebep olabilir ve doğru koşullar altında kansere sebep olabilme
yeteneklerinin olduğu gösterilmemiştir.viral onkogenlerin hücresel homologlarına
proto-onkogenler denir. Viral onkogenleri hücresel proto-onkogenlerden ayırt
etmek için sırasıyla v-onc ve onc olarak isimlendirilmektedirler. C-onclerin
v-onclerin aynısı olmadığı unutulmamalıdır. Virüs bir hücresel büyüme kontrolü
yapan veya farklılaşma genini aldığında mutasyon oalrak adlandırılmaktadır.
Proto-onkogenin tanımı: Virüsteki onkogene homolog olan konak genidir ancak
değiştikten sonra transformasyonu indükleyebilir (yüksek oranda aktif olan
promotorun kontrolünde gelen şartların değişmesi veya mutasyon). Genellikle
organizmanın normal gelişiminin bazı basamaklarında DNA replikasyonu veya büyüme
kontrolünde fonksiyon gösteren bir protein kodlar.
Hücresel proto-onkogenlerin
özellikleri
- Bunlar tipik kontrol sekanslarıyla tipik hücresel genlerdir. Çoğu
ökaryotik genlerle birlikte olduğu gibi intronları içerir (retroviral
onkogenler-v-oncler içermez)
- Normal Mendelian kalıtımı gösterirler çünkü normal genlerdir ve
hürenin fonksioyonları için önemlidirler.
- Bütün ökaryotik genomlarda olduğu gibi genomada her zaman aynı
yerdedirler (daha önceden endojen retrovirüslerden beklenen zamanla
hücresel genoma katıldılar)
- LTR sekansları yoktur (v-oncler her zaman LTR şartlarındadır)
- Viral onkogenler çoğunlukla hayvan formu olan c-onc gibidir. Burada
virüsün geni aldığı düşünülür. Bu yüzden, RSVnin v-srcsi insan
srcsinden çok tavuk srcsine benzer. V-oncnin önceki konak hücrenin
genomundan virüsle kazayla çok önceden aldığı unutulmamalıdır.
- Hücresel onkogenler hücre yaşamının bazı dönemlerinde hücre
tarafından eksprese edilir. Genellikle de normal bir şekilde büyüme,
replikasyon ve farklılaşma esnasında gerçekleşir. Genellikle büyüme
kontrolünde yer alan proteinlerdir.
- Hüresel onkogenler çok korunmuştur
v-onc ve c-onc çok benzerse virüs tarafından sunulan v-onc hücrede
neden hasara sebep olur? Bu, genlerdeki farklılıklardan ve bir kere
virüs tarafından alınmış gende oluşan mutasyonlardan kaynaklanır. Bu tip
değişiklikler şunlardır:
- Değişmiş translasyon ürünlerinin oluştuğu amino asit değişimleri
veya delesyonları
- Birçok v-onc proteinleri c-onc ve bir viral genden oluşan bir
hibrid gen olan v-oncden eksprese edilen füzyon proteinleridir.
- V-oncler LTRler ile konak genomuna katılır. LTRler
protmotorları ve arttırıcıları içerir. Bu, bir genin çok fazla
ekspresyonuyla sonuçlanır. Bu genin büyük olasılıkla DNA
transkripsiyonu ve replikasyonunu kontrolünde yer aldığını biliyoruz.
|
 Şekil 18
Şekil 18
Normal genleri yerine bir onkogen alan bazı retroviruslar
|
Kronik olarak transforme
olan retrovirüsler v-oncye sahip değildir
RSV gibi akut olarak transforme olan virüsün onkogen adı verilen
ekstra geni olması bu virüslerin yüksek neoplastik potansiyeli
olduğunu gösterir ancak buna karşın kronik olarak trasnforme olan
retrovirüsler sadece tümörleri yavaşça üretirler ve v-oncye eşit
olan hiçbir gen içermezler. En iyi halle bu virüsler üç genel viral
genleri (gag/pol/env) içerirler. Buna bir örnek avian lökozis virüsü
(ALV)dür (şekil 18).
Kronik olarak transforme olan virüsler onkogenleri yoksa nasıl
bir tümörü uyarabilirler?
Çığır açıcı bir gözlem yapıdı: diğer bütün retrovirüslerin
yaptığı gibi ALV de birçok bölgeden hücre genomuna entegre olabilir
ancak ALV ile uyarılmış tümörlerde virüs HER ZAMAN benzer pozisyonda
bulunur (çok önemli!). Bu, önemli transforming olayının nadir olması
gerektiği ve tümörü oluşturan hücrelerin de bir klon (bütün her yere
bulunan akut transformerları kıyaslayın) olduğu anlamına gelir. ALV
ile uyarılmış tümör vakalarının hepsinde viral genom c-myc adı
verilen hücresel genin kenarına eklenir. Bu, hücresel proto-onkogendir.
Farklı bir form da olup (ör; v-onc) bazı akut transforme olan
retrovirüslerde bulunur (ör; karsinomaya, saarkomalara ve lösemilere
sebep olan avian miyelositoma virüs). Ayrıca, c-mycnin
ALV-transforme hücredeki translasyon seviyesi enfekte olmamış
hücrelerdekinden çok daha fazladır. Bu yüzden ALVnin veya diğer
kronik transforme edici retrovirüslerin genomunun c-oncnin yanına
eklenmesi v-onc taşınmasıyla aynı etkiyi gösterecektir.
|
 Şekil 19
Şekil 19
Promotor eklenmesi ile onkogenez
 Şekil 20
Şekil 20
Arttırıcı eklenmesi ile onkogenez
|
Bu yüzden eklenme esnasında virüs c-mycden upstreame gelir. Daha sonra
güçlü LTR promotorlarının etkisinin altına girer. Bu da c-mycnin aşırı
ekspresyonuna sebep olur. Buna promotor insersiyonuyla onkogenez adı verilir
(şekil 19).
Ancak bazı tümörlerde virüs c-myc geninin downstreamindedir. Ayrıca
LTRlerin aynı zamanda promotorlara ek olarak arttırıcı olduğunu da gördük.
Arttırıcı sekansların etkilerini gösterebilmeleri için upstream veya
downstream olmaları gerektiğini de biliyoruz. Buna arttırıcı insersiyonuyla
onkogenez adı verilmektedir (şekil 20).
c-mycnin kenarına inseriyon neden bu kadar önemli? Bu genle kodlanan
protein normal hücrelerin nükleusunda bulunur ve DNA sentezinin kontrolünde
rol oynar. C-mycnin aşırı ekspresyonunun hızlı DNA replikasyona sebe olduğu
gösterilebilir.
|
|
 Şekil 21A
Şekil 21A
Birçok gen kromozom üzerindeki sitelere atanabilir
 Şekil 21B Kromozomlarda birçok kırılma siteleri hücresel proto
onkogen çok yakın
Şekil 21B Kromozomlarda birçok kırılma siteleri hücresel proto
onkogen çok yakın
Şekil 21
|
Hüresel onkogenler viral
olarak uyarılmamış kanserlerde yer alabilir mi?
Virüslerin tümör oluşturmak için ya bir onkogeni hücreye
getirdiği ya da hücresel proto-onkogenin kontrolünü alabilecekleri
gösterildiğinde hücresel proto-onkogenin retroviral enfeksiyon
yokluğunda tümörlere sebep olup olmayacağı sorusu ortaya çıkmıştır.
Cevap evettir! Diğer kromozomal düzenlemeler yanlış promotor/arttırıcı
kontrolünde bir c-onc getirebilir (şekil 21). Alternatif olarak c-onc
belirli bir şekilde mutasyon geçirebilirdi böylece aşırı miktarda
eksprese edebilirdi veya değişmiş fonksiyonlu mutant proteini
kodalayabilirdi.
Kromozomal haritalama bir genin belirli bir kromozomdaki
bulunduğu yerin belirlenmesini sağlar ve birçok kanser türü
kromozomlardaki değişikliklerle, özellikle de translokalsyonlarla
ilişkilidir (bir kromozomun kırılması böylece iki kısım başka bir
kromozomun iki kısmıyla etkileşime girer).
Tümör hürelerinde birçok kırılma bölgesi bilinen c-oncye çok
yakındır. Bunun şans eseri olması akıl çelicidir ancak muhtemel
değildir!
| Hastalık |
C-onc |
translokasyon |
Burkitt's lenfoma * |
myc |
8 to 14 |
Akut miyeloblastik lösemi |
mos |
8 to 21 |
Kronik miyelogenous lösemi |
abl |
9 to 22 |
Akut promiyelocytic lösemi |
fes |
15 to 17 |
Akut lenfositik lösemi |
myb |
6 deletion |
Over kanseri |
myb |
6 to 14 |
*Burkitts lenfomada 8. Kromozomun üzerindeki c-myc
14. Kromozomda immunoglobulin ağır zincir geninin yakınındaki bir
bölgeye alınır. Bu proto-onkogen bu yüzden immunoglobulin
promotorunun kontrolüne girebilir gibi görünmektedir. Bu promotor, B
lenfositlerde oldukça aktiftir. Bu, bu tümörün B hücrelerde neden
oluştuğunu açıklar. Diğer lenfomalarda bir c-onc immünoglobulinin
hafif zincir gen bölgesinin yanına alınır. Bunlar da B hücre
lenfomalarıdır.
Epstein-Barr virüsü muhtemelen Burkitts lenfoma
sebebidir. Bu bir herpes virüsüdür ve herpes virüsleri yaygın olarak
kromozomal kırılmalara sebep olurlar. Bu tip bir kırılma 8:14
translokasyonuna sebep olursa hücrenin myc geni hücrenin
immünoglobulin promotorunun yakınına gelir ve c-myc ekspresyonu bu
promotorun aktif olduğu hücrelerde artar.
|
| |
Mutasyonların
hücresel onkogenlerde de transformasyonla sonuçlanabileceğine
ilişkin kanıt var mıdır?
En iyi kanıt, mürin sarkoma virüsünün Harvey
zincirinde (v-onc HaRas olarak isimlendirilmektedir) bulunan viral
onkogenin homoloğu olan hücresel onkogenden gelmektedir. Bu c-onc
mesane kanserlerinden izole edilmiştir ve normal c-onc proto-onkogenleriyle
karşılaştırılmıştır. Birçok tümör hücresinde proteinin amino asit
sekansında sadee bir değişim bulunmuştur. 12. Pozisyondaki glisin
amino asidi valine değişmiştir. 12. Pozisyonda sadece glisin ve
prolin normal büyüme vermiştir. Bu pozisyondaki diğer bütün amino
asitler transforme hücrenin oluşmasına sebep olur. Akciğer
karsinomasında transfom olan DNA aynı zamanda c-HaRas içermiştir,
61. pozisyonda tekrar bir nokta mutasyonu bulunmuştur.
|
| |
Onkogenlerin normal
fonksiyonu nedir?
Yukarıda bahsedildiği üzere, c-oncler hücre döngüsünün bazı
basamaklarında eksprese edilen ve fonksiyon gösteren normal
genlerdir. DNA sentezinde veya belki de proliferasyona sebep olan
sinyal yolaklarında yer aldığını düşünelim. 40tan fazla onkogen
tanımlanmıştır ve muhtemelen birkaç tane keşfedilmemiş olanları
vardır.
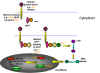
Hücresel onkogenleri nüklear proteinleri kodlayan ve ekstra
nüklear proteinelri kodlayanlar olmak üzere alt bölümlere
ayırabiliriz. İkincisi çoğunlukla hücrenin plazma membranıyla
ilişkilidir (şekil 22 ve 23).
- Nüklear proteinler olan onkogen ürünleri: ör; myc, myb.
Bunlar gen ekspresyonu (transkripsiyonun
regülasyonu-transkripsiyon faktörleridir) veya DNA replikasyonu
kontrolünde yer alırlar. Neoplazi onkogenin yüksek
transkripsiyonuyla ilişkilidir ancak güçlü ekspresyonu her zaman
gerekli değildir. Bunun yerine genin normal regülatör
proseslerin kontrolünden ziyade temel olarak aktif hale gelemesi
gerekir.
- Sitoplazmik veya membran-ilişkili protienler olan onkogen
ürünleri: ör; abl, src, ras. Bu tip değişmiş ekspresyon
göstermez ancak proto-onkogeni mutasyonla onkogene çeviriyor
gibi görünmektedir. Bu yüzden, src ile uyarılan tümörlerde
onkogenin aşırı ekspresyonunun etkisi yoktur.
|
 Şekil 22
Şekil 22
Proto onkogenlerin değişmiş olan yolları hücre transformasyonu neden
olabilir
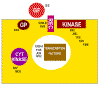 Şekil 23
Şekil 23
Hücresel proto-onkogen ürünlerin sınıfları
GF = büyüme faktorü
REC = membran reseptörü
GP = G-protein transducers sinyali
KINASE = membrana bağlı tirozin kinaz
CYT KINASE = sitoplazmik protein kinaz
|
|
PROTO-ONKOGEN- İLE KODLANAN
PROTEİNLERİN FONKSİYONU |
ÖRNEK |
|
DNA transkripsiyonunun kontrolü (nükleusta bulunur) |
myc |
|
Tirozin kinaz gibi hormone/büyüme faktörü sinyali
|
src membrana
bağlı tyr kinazdır |
| Bir yüzey
reseptöründen nükleusa sinyal transdüksiyonunda yer alan GTP-bağlayan
proteinler |
ras |
|
Büyüme faktörleri |
sis
trombosit kökenli büyüme faktörü B zincirinin değişmiş formudur |
|
Büyüme faktörü reseptörleri |
erb-B epidermal
büyüme faktör reseptörünün bir homoloğudur (bu da tirozin kinazdır).
fms makrofaj koloni-uyarıcı faktör reseptörünün homoloğudur (M-CSF)
|
Bu vakaların her birinde mutasyon baskındır. Bu yüzden, örneğin
bir erb-B alleli (EGF reseptör homoloğu) mutasyon geçirdiğinde aktif
hale gelir (ör; tirozin kinazı aktive etmek için bağlanmak amacıyla
epidermal büyüme faktörüne ihtiyaç duymaz), sonrasında diğer allel
normal olmasına rağmen sinyal oluşur.
|
 Şekil 24A
Şekil 24A
Dominant mutasyonlar, fonksiyon kazanılması
|
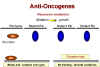
ANTI-ONKOGENLER
(TUMOR SUPRESÖR GENLERİ)
DNA tümör virüslerinin tümörlere sebep olmaları
bilinmeden önce retrovirüslerin onkogenlerle tümör oluşumuna sebe
oldukları yol belirtilmişti. Belirgin bir şekilde DNA tümör virüsleri
onkogenleri taşır (ör; SV40 T-antijeni) ancak hücresel homologları
olmadan gerçek viral genlerde kodlanan bu proteinler tümör oluşumuna
neden olur mu?
Çoğu tümörün baskın mutasyonların sonucu olduğu uzun
zamandan beri bilinmektedir. Buna örnek olarak; olmaması gereken zamanda
hücre büyümesi için fonksiyon özelliği kazanması verilebilir (şekil 24).
Örneğin, yukarıda bahsediildiği üzere, bir büyüme faktörüne
bağlandığında tirozin kinaz aktivitesini başlatarak bir sinyal gönderen
reseptörümüz olursa ve o reseptör mutant hale gelip onun tirozin kinazı
aktive olursa, hücre heterozigotta bile aşırı derecede fazla büyüme
sinyali alır. Bu yüzden mutant allel normal allelden daha baskındır.
|
 Şekil 24B
Şekil 24B
Resesif mutasyonlar fonksiyon kaybıdır
|
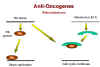
Retinoblastom: Bir
resesif tümör
Mutant onkogenin normal tipe göre daha baskın olduğu normal
özelliklerle uyuşmayan önemli bir tümör sınıfı bulunmaktadır.
Retinoblastomada resesif bir lezyon olduğu görülmektedir.
Burada fonksiyon kaybına sebep olan kanser oluşumuna neden olan mutasyondur
(şekil 24). (Bu resesiftir çünkü diploid bir organizmada iki gen
bulunmaktadır. Bir allel mutant olursa çalışmaz. Diğeri ise hala normal
proteini kodlayabilir ve fonksiyonu devam eder. Fonksiyonunu kaybetmesi için
ve protein oluşmaması için her iki geninde mutant olması gerekmektedir.
Örneğin resesif mutasyona sahip olduğumuzda). Bu yüzden,
retinoblastoma (Rb) geninden kodlanan proteinin büyüme baskılayıcısı olduğu
görülmektedir. Rb geninde homozigot bir mutasyon gerçekleşirse herhangi bir
Rb geni ürünü oluşmaz ve hücre anormal şekilde çoğalmaya başlar çünkü artık
büyümeyi baskılayıcı yoktur. Rb geninin ürünü tanımlanmıştır ve 105
kdaltonluk nükleusta yer alan bir protein olduğu gösterilmiştir.
Rb alleli heterozigot olan bir birey hala normal Rbye
sahiptir ve tümörler hala daha baskılanabilir ancak homozigotlarda
fonksiyonel Rb yoktur ve tümörler baskılanamazlar.
|
 Şekil 25
Şekil 25
Rb ve adenovirus E1A
|
Yukarıda adenovirüs E1A (erken fonksiyonu) proteininin bir şekilde
tümörojenezde yer aldığını belirtmiştik. Transforme adenovirüsle
enfekte hücrede E1A proteinin 105 kD proteinle kompleks oluşturduğu
bulunmuştur! Bu, Rb gen ürününü ortaya çıkarmıştır (şekil 25). Bu
yüzden, adenovirüs normal fonksiyonu büyüme inhibisyonu olan
hücresel proteinle kompleks yaparak (ve bu sayede inaktive ederek)
hücrenin anormal bir şekilde büyümesine sebep oluyor gibi
görünmektedir.
|
| |
p53 ve insan kanseri
Son yirmi yıldır 1979da keşfedildiğinden beri p53 geni
olarak bilinen (kodlanan proteinin büyüklüğünden sonra) bir gen kalıtsal
olan birçok kanserle ilişkiledirilmiştir. Bu kalıtsal kanserlerde p53
geninin mutant olduğu ortaya konmuştur. Bu proteindeki değişimler çoğu insan
kanserlerinin temeli olduğu (direkt veya indirekt) görülmektedir. Totalde,
insan kanserlerinin %60ı p53ü içerir. Kolon kanserlerinin %80i p53 genini
içerir.
|
p53 içeren insan kanserleri
|
|
serviks |
karaciğer |
meme
|
akciğer |
|
mesane |
deri |
|
prostat |
kolon |
|
| |
Başlangıç olarak, p53 gen ürününün kanserlere sebep olduğu
düşünülmekteydi ancak daha sonraki araştırmalar tam tersini göstermiştir.
p53 aynı retinoblastoma gen ürünü gibi bir tümör baskılayıcısıdır. p53
proteini DNA hasar kontrol sisteminin çoklu bileşenlerini regüle ettiğinden
dolayı Genom Gardiyanı olarak isimlendirilmektedir.
Fonksiyonel bir hücrede p53 nasıl fonksiyon gösterir?
Normalde, sağlıklı bir hücrede sadece birkaç tane baskılayıcı p53 molekülü
bulunur ve bunlar sürekli azalır. Ancak DNA hasara uğradığında (radyasyon
veya kimyasal mutajenler olabilir) ve DNA replikasyonu gerçekleştiğinde p53
azalması durur. P53 artışı DNA replikasyonunu durdurur.
P53 bir transkripsiyon faktörüdür. Oluştuğunda kromozom
üzerindeki spesifik bölgesine bağlanır ve diğer genleri aktive eder ve bu da
mitozu durdurur. Aynı zamanda p53 başka bir şekilde de davranır: oluştuğunda
apoptoz yolunda hücreyi hazırlayabilir. P53 tersinir büyümenin durudurulması
veya apoptozuna sebep olması veya olmaması hüresel aktivasyon durumuna
bağlıdır. Örneğin, çok fazla tamir edilmemiş DNA hasarı sürekli p53
üretimine sebep olabilir böylelikle hücre apoptoza gider. Kalıtsal
kanserlerde p53 geninde mutasyon vardır. Sıklıkla tek nokta mutasyonudur ve
protein daha fazla DNAdaki doğru yerine bağlanamaz ve bu yüzden de DNA
replikasyonnu durduramaz.
Rb geni gibi ürün ikini normal p53 allelinin fonksiyonel
proteini yapması ve normalde olduğu gibi DNA replikasyonunu durdurması
gerektiğinden p53 etkisinin resesif olmasını beklersiniz. Ancak, bu mutasyon
için heterozigotsanız tabi ki karsinojenezden bir mutasyon uzaktasınızdır.
Peki o zaman p53 mutasyonu için heterozigot olan hücrelerin neden problemi
vardır? Ne yazık ki, p53 proteini kurdeleye benzer şekilde tetramerler
oluşturur ve böylece p53 proteininin yarısı mutantsa her bir tetramerin bir
mutant p53 molekülüne sahip olması için iyi bir fırsattır ve bu tetrameri
inaktive eder. Buna baskın-negatif etki denir.
|
 Şekil 26
Şekil 26
p53, hepatit C ve papilloma virus
|
P53 mutasyonu kalıtsal olarak var olan ailelerden birçok şey öğrenmemize
rağmen çoğ p53 mutaysonlarının kalıtsal olmayan çevresel faktörlerden
kaynaklandığı açıktır: nokta mutasyonlarına sebep olan karsinojenler (sigaradaki
benzopiren, fındık ve mısırlardaki küflerin ürettiği aflatoksin, UV ışığı).
Aynı zamanda çok agresif tümörlere sebep olan p53 mutasyonu fonksiyonu
kazancı da vardır. Bunlar DNA replikasyon genlerini aktive eder. Bunun DNA
tümör virüsleyile ne yapması gerekir? Retinoblastoma gen ürünüyle olduğu
gibi virüs varlığı mutasyonu taklit edebilir ve DNAdaki spesifik bölgesine
bağlanamayan inaktif fomuyla kompleks oluşturarak tümör baskılayıcıyı
durdurur. Hepatoselüler karsinomaya sebep olan hepatit Cnin olma sebebi
budur. İnsan papilloma virüsle enfekte hücrede p53 E6 proteini ile bağlanır
ve p53de kesim bölgesini tanıyan bir proteaza yönlenir ve parçalanır (şekil
26). Buna ek olarak, E7 proteini bağlanır ve Rb proteinini inaktive eder.
Sağlıklı p53 genlerinin tümör büyümesini durdurmak için hücrelere verilip
verilmeyeceğini göremk için günümüzde birçok çalışma yapılmaktadır. Bu
yüzden retrovirüslerin nasıl kansere sebep olduğuna ilişkin bilgimiz DNA
tümör virüslerinin ayı şekilde yaptığı gibi önceki kriptik yolun
anlaşılmasını sağlamıştır.
|
|


|
 Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
This page last changed on
Sunday, June 05, 2016
Page maintained by
Richard Hunt
|

 Şekil 12
Şekil 12 Şekil 13
Şekil 13 Şekil 14
Şekil 14 Şekil 16
Şekil 16 Şekil 17
Şekil 17 Şekil 18
Şekil 18 Şekil 19
Şekil 19 Şekil 22
Şekil 22 Şekil 24A
Şekil 24A Şekil 24B
Şekil 24B Şekil 25
Şekil 25 Şekil 26
Şekil 26






