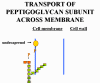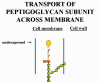|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGIE |
IMMUNOLOGIE |
MYCOLOGY |
PARASITOLOGY |
VIROLOGIE |
|
VIDEO LECTURE |
BACTERIOLOGIE – CHAPITRE CINQ
ANTIBIOTIQUES AFFECTANT L’ENVELOPPE CELLULAIRE
Alvin Fox, PhD
University of South Carolina School of Medicine
Columbia SC
USA
Emilie Camberlein, PhD
Maître de conférence en Biochimie
Universite de Nantes
Faculte des Sciences et des Techniques
|
|
ANGLAIS |
|
ESPAGNOL |
|
PORTUGAIS |
|
ALBANAIS |
|
FARSI |
|
|
Let us know what you think
FEEDBACK |
|
SEARCH |

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
Suggested reading: Murray,
6th edition
Chapter 20 |
|
KEY WORDS
Sterilization/disinfection/
antisepsis
Antibiotic
Selective toxicity
Bactericidal
Bacteriostatic
Minimal inhibitory concentration
(MIC)
Susceptibility testing
Penicillin binding proteins (PBP)
Autolysins
Cycloserine
Bacitracin
Vancomycin
Beta lactam
Penicillins
Cephalosporins
Monobactam
Clavulinic acid
Penicillinase/beta lactamase
Polymyxin B
Resistance |
STERILISATION
Le fait de stériliser fait référence à tuer (ou
retirer) TOUTES les bactéries d’une manière non sélective. Par exemple,
autoclaver implique le chauffage de liquides (ex : des milieux de culture)
ou des solides à 121°C sous haute pression et en présence de vapeur. Le
matériel doit être résistant à la chaleur. L’éthylène oxyde est parfois
utilisé dans les hôpitaux pour les équipements qui ne peuvent pas être
chauffés. Les membranes de filtres possèdent des pores qui piègent les
bactéries mais permettent aux drogues et aux petites molécules chimiques de
passer à travers ; ainsi des filtres pré-stérilisés peuvent être utilisés
pour stériliser des solutions fragiles. La lumière UV utilisée pour diminuer
le niveau de bactéries sur les surfaces comme dans les salles d’opération ;
ne sont cependant pas totalement efficaces. Les radiations ionisantes sont
plus efficaces et peuvent être utilisées pour stériliser les instruments ou
la nourriture.
Les désinfectants (ex : à base de phénol)
peuvent être utilisés pour tuer de nombreuses bactéries sur certain
instruments, mais ne peuvent pas être utilisés pour la consommation ou sur
la peau. Les antiseptiques (ex : iodine ou alcool à 70%) sont utilisés
localement (ex : à la surface de la peau) pour réduire la charge bactérienne.
ANTIBIOTIQUES
Par contraste, les antibiotiques sont des
agents qui sont « sélectivement » toxiques pour les bactéries (soit les tue
[bactéricide] soit inhibe leur croissance [bactériostatique]) sans affecter
le patient. Ils peuvent ainsi être ingérés. Par définition, ces composés
doivent agir sur des structures retrouvées chez les bactéries mais pas chez
l’hôte. Les antibiotiques fonctionnent plus efficacement en conjonction avec
un système immunitaire actif pour tuer les bactéries infectant l’hôte. Après
isolement de colonies pures (voir Bactériologie chapitre 2), la susceptibilité des isolats bactériens pour divers antibiotiques peut être
testée. La concentration minimale d’inhibition (MIC) représente la
concentration la plus faible d’antibiotiques qui arrête la croissance
visible. Plus simplement, la zone d’inhibition autour du disque imprégné
d’antibiotique (Kirby-Bauer) est une autre mesure de l’activité des
antibiotiques.
INHIBITEURS DE LA SYNTHESE DE
LA PAROI
Une classe majeure d’antibiotiques inhibe la
synthèse du peptidoglycane (figure 1). Une fois que la synthèse de la paroi
(impliquant des protéines liant la pénicilline) est inhibée, l’autolyse
enzymatique de la paroi peut avoir lieu. Sans le maintien de la paroi, la
forte pression osmotique dans la cellule fait éclater les membranes internes
et/ou externes des bactéries. Ainsi, ces antibiotiques sont généralement
bactéricides. Plusieurs mécanismes sont impliqués dans l’inhibition de la
synthèse du peptidoglycane :
(1) Les deux acides aminés terminaux de la
chaine latérale peptidique du peptidoglycane sont des acides aminés
inhabituels (D-alanine au lieu de son isomère la L-alanine).
L’antibiotique cyclosérine est un analogue de la D-alanine et interfère
avec la conversion enzymatique de la L-alanine en D-alanine dans le
cytoplasme. Ainsi, la synthèse ultérieure de peptidoglycane ne peut plus
se produire.
(2) La sous-unité du peptidoglycane (contenant
une chaine latérale et un peptide attaché utilisés dans la réticulation)
est transportée à travers la membrane cytoplasmique et liée à
l’undécaprénol diphosphate. Après que le monomère de peptidoglycane
naissant quitte le transporteur en atteignant la paroi cellulaire,
l’undécaprénol diphosphate est déphosphorylé en sa forme monophosphate.
La bacitracine inhibe la réaction de déphosphorylation et en l’absence
de transporteur monophosphorylé la synthèse de sous-unités du
peptidoglycane cesse.
|
|
TUTORIAL
Antibiotic Attack
HHMI
Requires Flash |
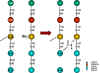 Figure1 : Réticulation du peptidoglycane.
Figure1 : Réticulation du peptidoglycane.
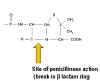 Figure 2 : Structure de la pénicilline.
Figure 2 : Structure de la pénicilline. |
(3) L’étape finale de la synthèse de peptidoglycane implique la
liaison de la portion sucre de la sous-unité de peptidoglycane au
squelette de glycane du polymère de la paroi préexistant. La
réticulation de la portion peptidique de la sous-unité à un peptide dans
la paroi a ensuite lieu. Pendant ce processus, la D-alanine est excisée
de l’extrémité de la chaine peptidique latérale préexistante lui
permettant d’être réticulée (par un nouveau pont peptidique) à la
sous-unité de peptidoglycane nouvellement synthétisée. La vancomycine se
lie à la D-alanine-D-alanine inhibant ainsi stériquement la
transpeptidation (réticulation).
(4) Les antibiotiques β-lactame incluent les pénicillines (ex :
ampicilline), les céphalosporines et les monobactames. Ils se lient et
inhibent les enzymes (protéines liant la pénicilline) impliquées dans la
transpeptidation (réticulation) du peptidoglycane. Ces antibiotiques ont
en commun le cycle lactame à quatre membres. Attaché au lactame, les
pénicillines possèdent un cycle supplémentaire à cinq membres et les
céphalosporines un cycle à six membres. Les monobactames consistent en
un cycle lactame seul et présentent une activité antibiotique.
|
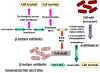 Figure 3 : Résistance aux bêta-lactames – Bactéries Gram négatives.
Figure 3 : Résistance aux bêta-lactames – Bactéries Gram négatives.
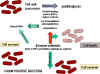 Figure 4 : Résistance aux bêta-lactames –
Bactéries Gram positive
Figure 4 : Résistance aux bêta-lactames –
Bactéries Gram positive |
PENICILLINE
La pénicilline est produite par la moisissure
Penicillium chrysogenum. Durant la fermentation, la moisissure forme de
l’acide 6-aminopecillinique qui présente un cycle thiazolidine et un cycle
béta-lactame fusionnés (Figure 2). Celui-ci, cependant, est labile en
condition acide et sujet à la dégradation par les enzymes bactériennes. Des
dérivés plus stables sont produits biochimiquement pour qu’en plus d’une
stabilité accrue, ils soient mieux absorbés à partir du tractus
gastro-intestinal et qu’ils présentent un spectre d’effets bactéricides plus
large.
Des chaines latérales variables ont été synthétiquement ajoutées à la
structure du cycle, produisant une armée d’antibiotiques avec différentes
activités chez l’hôte. De nombreuses pénicillines (Figure 2) présentent peu
d’activité contre les bactéries à Gram négatif, puisqu’elles ne traversent
pas la membrane externe. Les céphalosporines et d’autres nouvelles
pénicillines sont actives contre les bactéries à Gram négatif, puisqu’elles
peuvent traverser la membrane externe. D’autres pénicillines chimiquement
modifiées ont des taux d’élimination plus faibles chez le patient ;
diminuant ainsi la fréquence d’administration de ces drogues.
Les pénicillines peuvent être détruites par les
bêta-lactamases (pénicillinase) produites par les souches bactériennes
résistantes (Figure 3). L’acide clavulinique, possède également un composant
bêta-lactame qui se lie fortement à la bêta-lactamases inhibant son activité.
Ceci est utilisé en conjonction avec certaines pénicillines permettant ainsi
leur utilisation contre des bactéries autrement résistantes. Une autre forme
de résistance implique un changement dans la structure des protéines liant
la pénicilline faisant que l’antibiotique ne se fixe pas efficacement
(Figure 4). Dans le cas de bactéries à Gram négatif, les pénicillines
passent à travers la membrane externe en utilisant des porines. Une
résistance peut se développer suite à des mutations conduisant à des porines
modifiées.
|
|
|

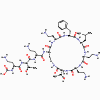 Figure 5 : Structure de la polymyxine
Figure 5 : Structure de la polymyxine |
POLYMYXINE B
La Polymyxine B (Figure 5) se lie à la portion lipide A du
lipopolysaccharide et également aux phospholipides. Cependant, elle se lie
préférentiellement au lipide A. Ceci perturbe la membrane externe des
bactéries à Gram négatif. Puisque la membrane cellulaire n’est pas exposée
dans les bactéries à Gram positif, la Polymyxine a peu d’activité contre
elles. Cette drogues est toxique pour les cellules humaines, puisqu’elle
peut aussi lyser les membranes eucaryotes ; ceci explique son utilisation
clinique limitée.
|
 Figure 5A : Vancomycine
Figure 5A : Vancomycine |
VANCOMYCINE
La Vancomycine est une drogue de dernier ressort contre les bactéries à
Gram positif. C’est un glycopeptide (Figure 5A) produit par les espèces
Acinobacter. L’émergence de la résistance à la vancomycine a rendu cet
antibiotique moins utile.
Elle est très hydrophyle et forme des liaisons hydrogène avec les parties
D-alanie-D-alanine terminales des sous-unités NAM/NAG et stoppe la
polymérisation des sous-unités formant de longues chaînes. Elle prévient
également la réticulation les polymères.
La Vancomycine est souvent remplacée par la Daptomycine.
|
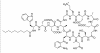 Figure 6 : Daptomycine (Cubicine)
Figure 6 : Daptomycine (Cubicine) |
DAPTOMYCIN
La Daptomycine (Cubicine-Figure 6) est un lipopeptide naturel utilisé
pour traiter les infections à bactéries Gram positif multi-résistantes.
C’est un produit naturel provenant du champignon du sol Streptomyces
roseosporus. La portion lipidique de la molécule se lie à la membrane
cellulaire ce qui résulte en sa dépolarisation (perte du potentiel
membranaire). Elle peut être utilisée pour traiter :
- Les entérocoques (dont les Entérocoques résistants au glycopeptide
(GRE))
- Les staphylocoques (dont les Staphylococcus aureus méthicilline
résistants)
- Les streptocoques
- Les corynébactéries
Elle est utilisée aux Etats Unis contre les infections cutanées à Gram
positifs, les bactériémies et l’endocardite du cœur droit dues à
Staphylococcus aureus. La Daptomycine ne peut pas être utilisée pour traiter
les pneumonies car elle se lie au surfactant pulmonaire.
La Daptomycine peut être responsable de pneumonies éosinophiliques
mortelles chez les personnes de plus de 60 ans.
|
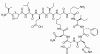 Figure 7 : Bacitracine
Figure 7 : Bacitracine |
BACITRACINE
La bacitracine est un polypeptide cyclique produit par Bacillus subtilis
var Tracy. Elle est utilisée localement contre les bactéries à Gram positif
causant des infections des yeux et de la peau mais n’est pas utilisée
systématiquement. La Bacitracine inhibe la déphosphorylation du
C55-isoprényl pyrophosphate qui transporte les composants du peptidoglycane
des parois des cellules bactériennes en dehors de la membrane interne.
|
| |
Transporte des composants du peptidoglycane des parois des cellules
bactériennes en dehors de la membrane interne
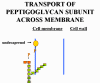 Figure 8A : Undécaprénol phosphate et sous–unité du peptidoglycane phosphorylés.
Figure 8A : Undécaprénol phosphate et sous–unité du peptidoglycane phosphorylés.
 Figure 8B : Un lien pyrophosphate est formé entre l’undécaprénol et la
sous-unité
Figure 8B : Un lien pyrophosphate est formé entre l’undécaprénol et la
sous-unité
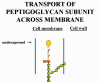
 Figure 8C : La sous-unité est transférée de la membrane à la paroi.
Figure 8C : La sous-unité est transférée de la membrane à la paroi.
 Figure 8D : La sous-unité est libérée et le pyrophosphate clivé en l’absence de
bacitracine
Figure 8D : La sous-unité est libérée et le pyrophosphate clivé en l’absence de
bacitracine
 Figure 8E : En présence de bacitracine, le pyrophosphate n’est pas clivé.
Figure 8E : En présence de bacitracine, le pyrophosphate n’est pas clivé.
|
|

 |
 Retourner à la section d'bacteriologie de Microbiologie et Immunologie On-line
Retourner à la section d'bacteriologie de Microbiologie et Immunologie On-line
This page last changed on
Wednesday, September 04, 2013
Page maintained by
Richard Hunt
Please report any problems to
richard.hunt@uscmed.sc.edu
|

 Figure1 : Réticulation du peptidoglycane.
Figure1 : Réticulation du peptidoglycane.
 Figure 3 : Résistance aux bêta-lactames – Bactéries Gram négatives.
Figure 3 : Résistance aux bêta-lactames – Bactéries Gram négatives. Figure 4 : Résistance aux bêta-lactames –
Bactéries Gram positive
Figure 4 : Résistance aux bêta-lactames –
Bactéries Gram positive
 Figure 5A : Vancomycine
Figure 5A : Vancomycine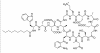 Figure 6 : Daptomycine (Cubicine)
Figure 6 : Daptomycine (Cubicine)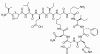 Figure 7 : Bacitracine
Figure 7 : Bacitracine