|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGIE |
IMMUNOLOGIE |
MYCOLOGY |
PARASITOLOGY |
VIROLOGIE |
|
VIDEO LECTURE |
BACTERIOLOGY - CHAPITRE
SIX
ANTIBIOTIQUES – SYNTHESE DES PROTEINES, SYNTHESE D’ACIDE NUCLEIQUE ET
METABOLISME
Gene Mayer, PhD
University of South Carolina School of Medicine
Columbia SC
USA
Emilie Camberlein, PhD
Maître de conférence en Biochimie
Universite de Nantes
Faculte des Sciences et des Techniques
|
|
ANGLAIS |
|
ESPAGNOL |
|
ALBANAIS |
|
FARSI |
|
|
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
MOTS CLES
Sélectivité
Index thérapeutique
Bactéricide
Bactériostatique
MIC
MBC
Antibiogramme
Synergie d’antibiotiques
Antagonisme d’antibiotiques
Antimicrobien
Résistance croisée
Résistance multiple
|
PRINCIPES MAJEURS ET DEFINITIONS
A. La Selectivite Les
agents antibactériens cliniquement efficaces présentent tous une toxicité
sélective vis-à-vis des bactéries plutôt que vis-à-vis de l’hôte. C’est
cette caractéristique qui distingue les antibiotiques des désinfectants. La
base de la sélectivité va dépendre de chaque antibiotique. Quand la
sélectivité est forte, les antibiotiques ne sont normalement pas toxiques.
Cependant, même les antibiotiques très sélectifs peuvent avoir des effets
secondaires. B. L’index
Therapeutique L’index thérapeutique est défini comme le ratio
entre la dose toxique pour l’hôte et la dose thérapeutique efficace. Plus
l’index est fort, meilleur est l’antibiotique.
C. Categories d'antibiotiques
Les antibiotiques sont catégorisés comme bactéricides si ils tuent les
bactéries sensibles ou bactériostatiques si ils inhibent de manière
réversible la croissance bactérienne. En général, l’utilisation
d’antibiotiques bactéricides est préférée mais de nombreux facteurs peuvent
dicter l’utilisation d’antibiotiques bactériostatiques. Quand un
antibiotique bactériostatique est utilisé, la durée du traitement doit être
suffisante pour permettre aux mécanismes de défense cellulaires et humoraux
d’éradiquer les bactéries. Si possible, les antibiotiques bactéricides
doivent être utilisés pour traiter des infections de l’endocarde et des
méninges. Les défenses de l’hôte sont relativement peu efficaces sur ces
sites et les dangers encourus par ces infections nécessitent une rapide
éradication des organismes. D. Tests
de Sensibilities aux Antibiotiques Les mesures quantitatives
basiques de l’activité in vitro des antibiotiques sont la concentration
minimum d’inhibition (MIC) et la concentration bactéricide minimum (MBC). La
MIC est la concentration la plus faible d’antibiotique qui résulte en
l’inhibition de la croissance visible (c'est-à-dire l’observation de
colonies sur une boîte ou la turbidité en bouillon de culture) dans les
conditions standards. La MBC est la concentration la plus faible
d’antibiotique qui tue 99,9% de l’inoculum de départ dans un temps donné. La
figure 1 illustre comment déterminer la MIC d’un antibiotique.
|
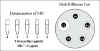 Figure 1 : Test de susceptibilité aux antibiotiques.
Figure 1 : Test de susceptibilité aux antibiotiques. |
| |
Pour qu’un antibiotique soit efficace il faut que la MIC
ou la MBC puissent être atteintes sur le site de l’infection. L’absorption
et la distribution pharmacologiques de l’antibiotique vont influencer la
dose, la voie et la fréquence d’administration de l’antibiotique dans le but
d’atteindre une dose efficace sur le site de l’infection.
Dans les laboratoires cliniques, un test commun pour la
susceptibilité aux antibiotiques est l’antibiogramme (figure 1). Dans ce
test, l’isolat bactérien est inoculé uniformément sur toute la surface d’une
boîte d’agar. Un disque de papier filtre imbibé avec une dose standard d’un
antibiotique est appliqué à la surface de la boîte et l’antibiotique peut
ainsi diffuser dans le milieu environnant. Le résultat est un gradient de
l’antibiotique autour du disque. Après incubation, un tapis de bactéries
apparait sur la boîte. Des zones d’inhibition de la croissance bactérienne
peuvent être présentes autour du disque d’antibiotique. La taille de la zone
d’inhibition dépend du taux de diffusion de l’antibiotique, du degré de
sensibilité du microorganisme et du taux de croissance de la bactérie. La
zone d’inhibition dans le test de l’antibiogramme est inversement
proportionnelle à la MIC.
Le test est réalisé dans des conditions standards et des
zones standards d’inhibition qui ont été établies pour chaque antibiotique.
Si la zone d’inhibition est égale ou supérieure au standard, l’organisme est
considéré sensible à l’antibiotique. Si la zone d’inhibition est inférieure
au standard, l’organisme est considéré résistant. La figure 1 illustre
également comment l’antibiogramme est réalisé et la figure 2 illustre
quelques zones d’inhibition standard pour plusieurs antibiotiques.
E. Therapie
Combinee
La thérapie combinée avec deux antibiotiques ou plus est
utilisée dans des cas spéciaux :
-
Pour éviter l’émergence de souches résistantes.
-
Pour traiter des cas en urgence pendant la période où
le diagnostique étiologique est toujours en cours.
-
Pour tirer partie de la synergie entre antibiotiques.
La synergie entre antibiotiques a lieu quand les effets
de la combinaison d’antibiotiques sont meilleurs que la somme des effets
individuels des antibiotiques. L’antagonisme entre antibiotiques a lieu
quand un antibiotique, généralement celui avec le moins d’effet, interfère
avec les effets d’un autre antibiotique.
F. Antibiotiques et
agents chimiotherapeutiques
Le terme antibiotique fait strictement référence aux
substances d’origine biologique alors que le terme d’agent
chimiothérapeutiques fait référence à des produits chimiques synthétiques.
La distinction entre ces termes est devenue floue car beaucoup des nouveaux
« antibiotiques » sont en réalité des produits biologiques chimiquement
modifiés ou même des produits biologiques synthétisés chimiquement. Les
termes génériques pour faire référence soit aux antibiotiques soit aux
agents chimiothérapeutiques sont antimicrobique ou agents antimicrobiens.
Cependant, le terme antimicrobique est souvent utilisé pour faire référence
à tous les agents antimicrobiens.
|
| |
|
Figure
2
Standards d’interprétation des diamètres des zones et des MIC approximatives
correspondantes utilisés pour définir les catégories. |
|
Agent antimicrobien
(quantité par disque)
et organisme
|
Diamètre de zone (arrondi au millimètre) pour
chaque catégorie d’interprétation |
|
MIC approximative (micro gm/ml) pour:
|
|
R |
I |
MS |
S |
|
R |
S |
|
Ampicilline (10 micro gm) |
|
|
|
|
|
|
|
Enterobacteriaceae
|
<11 |
12-13 |
|
>14 |
|
>32 |
<8 |
Staphylococcus
spp.
|
<28 |
|
|
>29 |
|
beta-Lactamase |
<0.25 |
Haemophilus
spp.
|
<19 |
|
|
>20 |
|
>4 |
<2 |
Enterococci
|
<16 |
|
>17 |
|
|
>16 |
|
Autres streptocoques
|
<21 |
|
22-29 |
>30 |
|
>4 |
<0.12 |
|
Chloramphénicole (30 micro gm) |
<12 |
13-17 |
|
>18 |
|
>25 |
<12.5 |
|
Erythromycine (15 micro gm) |
<13 |
14-17 |
|
>18 |
|
>8 |
<2 |
|
Acide nalidixique (30 micro gm) |
<13 |
14-18 |
|
>19 |
|
>32 |
<12 |
|
Streptomycine (10 micro gm |
<11 |
12-14 |
|
>15 |
|
|
|
|
Tétracycline (30 micro gm) |
<14 |
15-18 |
|
>19 |
|
>16 |
<4 |
|
Trimethoprime (5 micro gm) |
<10 |
11-15 |
|
>16 |
|
>16 |
<4 |
a Adapté du document d’octobre
1983 (M2-T3) of the NCCLS. Faire référence au documents de MCCLS les
plus courant pour les mises à jour et changement.
b R, Résistant; I, intermédiaire; MS, modérément sensible; S, sensible.
Un résultat I doit être rapport puisqu’il indique un résultat de test
ambigu qui peut nécessiter de plus amples investigations. Lorsqu’il est
désigné dans le tableau, un résultat MS doit être rapporté pour indiquer
le niveau de sensibilité qui peut nécessiter un dosage maximum pour la
thérapie. Les souches de la catégorie MS sont sensibles et non
intermédiaires.
c Les MIC approximatives corrélées utilisées pour la définition de la
résistance et les catégories sensible. Ces corrélations ne doivent pas
utilisées pour l’interprétation des résultats des tests de dilution
d’antimicrobiens.
|
|
|
|
SYNTHESE DES PROTEINES ET SITE D’ACTION
DES ANTIMICROBIENS QUI INHIBENT LA SYNTHESE DES PROTEINES
A. Initiation de la
synthese des proteines
La figure 3 illustre l’initiation de la synthèse des
protéines et le site d’action des antimicrobiens qui inhibent ce processus.
B. Elongation
La figure 4 illustre le processus d’élongation et le site
d’action des antimicrobiens qui inhibent ce processus.
INHIBITEURS DE LA SYNTHESE
DES PROTEINES
La sélectivité de ces agents est le résultat de différences
entre les ribosomes 70S des procaryotes et les ribosomes 80S des eucaryotes.
Puisque les ribosomes mitochondriaux sont similaires aux ribosomes procaryotes,
ces antimétabolites peuvent avoir une certaine toxicité. Ils sont principalement
bactériostatiques.
A. Antimicrobiens se
liant a la sous-unite ribosomale 30S
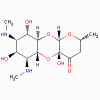
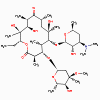
1. Aminoglycosides (bactéricide)
Streptomycine, Kanamycine, gentamicine, tobramycine, amikacine,
netilmicine, et néomycine (local).
a. Mode d’action
Les aminoglycosides se lient de manière irréversible au ribosome 30S
et bloquent le complexe d’initiation 30S (30S-mRNA-tRNA), de manière
à ce qu’aucune initiation n’ait plus lieu. Les aminoglycosides
ralentissent également la synthèse des protéines qui ont déjà
initiée leur traduction et induisent une mauvaise lecture de l’ARNm.
b. Spectre d’activité
Les aminoglycosides sont actifs contre de nombreuses bactéries Gram
négatives et quelques Gram positives. Ils ne sont généralement pas
utiles contre les bactéries anaérobies, puisque l’oxygène est
nécessaire à l’absorption de l’antibiotique, ni contre les bactéries
intracellulaires.
c. Résistance
La résistance à ces antibiotiques est courante.
d. Synergie
Les aminoglycosides fonctionnent en synergie avec les antibiotiques
à bêta-lactame comme la pénicilline. Les bêta-lactames inhibent la
synthèse de la paroi et ainsi augmentent la perméabilité de la
bactérie pour les aminoglycosides.
|
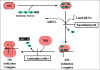 Figure 3 : Antibiotiques qui agissent au niveau de l’initiation de la synthèse
de protéines.
Figure 3 : Antibiotiques qui agissent au niveau de l’initiation de la synthèse
de protéines.
 Figure 4 : Antibiotiques qui agissent au niveau de la phase d’élongation
de la synthèse des protéines
Figure 4 : Antibiotiques qui agissent au niveau de la phase d’élongation
de la synthèse des protéines
 Streptomycine
Streptomycine
Néomycine |
Tétracycline
Spectinolycine |
2. Tétracyclines (bactériostatique)
Tétracycline, minocycline et doxycycline
a. Mode d’action
Les tétracyclines se lient de manière réversible au ribosome
30S et inhibent la liaison de l’aminoacyl-ARNt au site
accepteur sur le ribosome 70S.
b. Spectre d’action
Ce sont des antibiotiques à large spectre et sont utiles
contre les bactéries intracellulaires.
c. Résistance
La résistance à ces antibiotiques est courante.
d. Effets indésirables
La destruction de la flore normale de l’intestin a souvent
lieu, ce qui résulte en l’augmentation d’infections
secondaires. La structure et la coloration des dents et des
os peuvent également être affectés.
3. Spectinomycine
a. Mode d’action
La Spectinomycine interfère de manière réversible avec
l’interaction entre l’ARNm et le ribosome 30S. Elle est
structurellement similaire aux aminoglycosides mais ne cause
pas de biais de lecture de l’ARNm.
b. Spectre d’activité
La Spectinomycine est utilisée dans le traitement des
Neisseria gonorrhoeae résistantes à la pénicilline.
c. Résistance
Elle est rare chez Neisseria gonorrhoeae.
|
Chloramphénicol
Erythromycine
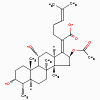
Acide Fusidique
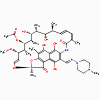
Rifampine
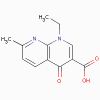
Acide Nalidixique
|
B. Antimicrobiens se liant a la sous-unite
50S du ribosome
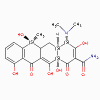
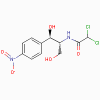
1. Chloramphénicol, lincomycine,
clindamycine (bactériostatique)
a. Mode d’action
Ces antimicrobiens se lient au 50S du ribosome et inhibent
l’activité de la peptidyl-transférase.
b. Spectre d’activité
• Chloramphénicol : large portée
• Lincomycine et clindamycine : portée restreinte.
c. Résistance
La résistance à ces antibiotiques est commune.
d. Effets indésirables
Le chloramphénicol est toxique (suppression de la moelle osseuse)
mais est utilisé dans le traitement des méningites.
2. Macrolides (bactériostatiques) –
Erythromycine (aussi azithromycine, clarithromycine)
a. Mode d’action
Les macrolides inhibent la translocation du peptidyl tRNA du site A
au site P du ribosome en liant à l’ARN 23S du 50S ribosomal.
b. Spectre d’activité
Bactéries à Gram positif, Mycoplasme, Legionella.
c. Résistance
La résistance à ces antibiotiques est courante. La majorité des
bactéries à Gram négatif sont résistantes aux macrolides.
C. Antimicrobiens qui interferent avec
les facteurs d'elongation
1. Acide fusidique (bactériostatique)
a. Mode d’action
L’acide fusidique se lie au facteur d’élongation GH (EF-G) et inhibe
le relargage de EF-G à partir du complexe EF-G/GDP.
b. Spectre d’activité
L’acide fusidique est efficace seulement contre les bactéries à
gram-positif comme Streptococcus, Staphylococcus aureus et
Corynebacterium minutissimum.
INHIBITEURS DE LA SYNTHESE ET DE
LA FONCTION DE L’ACIDE NUCLEIQUE La sélectivité de ces agents est
le résultat de la différence entre les enzymes procaryotes et eucaryotes
affectées par l’agent antibactérien.
A. Inhibiteurs de la synthese et de
la fonction de l'ARN
1. Rifampine, rifamycine, rifampicine (bactéricides)
a. Mode d’action
Ces antimicrobiens se lient à l’ARN polymérase DNA-dépendante et
inhibent l’initiation de la synthèse de l’ARN.
b. Spectre d’activité
Ce sont des antibiotiques à large spectre mais ils sont communément
utilisés dans le traitement de la tuberculose.
c. Résistance
La résistance à ces antibiotiques est commune.
d. Thérapie combinée
Comme la résistance est commune, la rifampine est généralement
utilisée en thérapie combinée.
B. Inhibiteurs de la synthese et de la
fonction de l'ADN
1. Quinolones- acide nalidixique,
ciprofloxacine, acide oxolinique (bactéricides)
a. Mode d’action
Ces antibiotiques se lient à la sous-unité A de l’ADN gyrase (topoisomérase)
et prévient le surenroulement de l’ADN, inhibant ainsi sa synthèse.
b. Spectre d’activité
Ces antibiotiques sont actifs contre les coques à Gram positif et
sont utilisés au cours des infections du tractus urinaire.
c. Résistance
Elle est commune pour l’acide nalidixique et se développe pour la
ciprofloxacine.
|
|
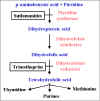 Figure 5 : Métabolisme de l’acide folique.
Figure 5 : Métabolisme de l’acide folique.
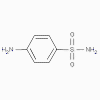
Sulfanilamide
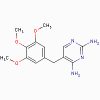
Triméthopine
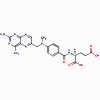
Méthotréxate
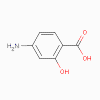
Acide amino salicylique
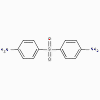
Dapsone
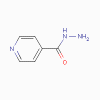
Isoniazid |
ANTIMICROBIENS ANTIMETABOLITES
A.
Inhibiteurs de la synthese de l'acide folique
La sélectivité de ces
antimicrobiens est la conséquence du fait que les bactéries ne peuvent pas
utiliser l’acide folique préformé et doivent synthétiser leur propre acide
folique. Par contraste, les cellules mammifères utilisent l’acide folique
obtenu à partir de la nourriture.
La figure 5 résume la
voie du métabolisme de l’acide folique et indique les sites auxquels les
antimétabolites agissent.
1. Sulphamidés, sulfones (bactériostatiques)
a. Mode d’action
Ces antimicrobiens sont analogues de l’acide para-aminobenzoïque et
inhibent de manière compétitive la formation de l’acide
dihydroptérique.
b. Spectre d’activité
Ils ont un large champ d’action contre les bactéries à gram-positif
et à gram-négatif et sont utilisés en première intension dans les
infections du tractus urinaire et dans les infections à Nocordia.
c. Résistance
La résistance à ces antibiotiques est commune.
d. Thérapie combinée
Les sulfamidés sont utilisés en combinaison avec la triméthoprime.
Cette combinaison bloque deux étapes distinctes du métabolisme de
l’acide folique et prévient l’émergence de souches résistantes.
2.
Triméthoprime, méthotrexate, pyriméthamine (bactériostatique)
a. Mode d’action
Ces antimicrobiens se lient à la dihydrofolate réductase et inhibent
la formation de l’acide tétrahydrofolique.
b. Spectre d’activité
Ils ont un large champ d’action contre les bactéries à gram-positif
et à gram-négatif et sont utilisés en première intension dans les
infections du tractus urinaire et dans les infections à Nocordia.
c. Résistance
La résistance à ces antibiotiques est commune.
d. Thérapie combinée
Ces antibiotiques sont utilisés en combinaison avec les sulphamidés.
Cette combinaison bloque deux étapes distinctes du métabolisme de
l’acide folique et prévient l’émergence de souches résistantes.
B. Agents anti-mycobacteriens
Les agents anti-mycobactériens
sont généralement utilisés en combinaison avec d’autres antimicrobiens car
ce traitement est prolongé et des résistances se développent rapidement
contre les agents individuels.
1. Acide para-aminosalicylique (PSA) (bactériostatique)
a. Mode d’action
Il est similaire à celui des sulfamidés.
b. Spectre d’activité
Le PSA est spécifique pour Mycobacterium tuberculosis.
2. Dapsone (bactéristatique)
a. Mode d’action
Similaire aux sulnamidés
b. Spectre d’activité
Le Dapsone est utilisé dans le traitement de la lèpre.
3. Isoniazide (INH) (bactériostatique)
a. Mode d’action
L’isoniazide inhibe la synthèse des acides mycoliques.
b. Spectre d’activité
L’INH est utilisé dans le traitement de la tuberculose.
c. Résistance
Une résistance s’est développée.
|
| |
RESISTANCE AUX MEDICAMENTS
ANTIMICROBIENS
A. Principes et definitions
1. Résistance clinique La
résistance clinique à un agent antimicrobien apparait quand la MIC de la
drogue pour une souche de bactérie particulière dépasse celle qui est
capable d’être obtenue in vivo en toute sécurité. Une résistance à un
antimicrobien peut apparaitre :
- Par mutation dans le gène qui détermine la sensibilité/résistance
à l’agent
- Par acquisition d’un ADN extra-chromosomique (plasmide) portant
le gène de résistance.
La résistance qui apparait après l’introduction d’un agent
antimicrobien dans l’environnement résulte généralement d’un
processus de sélection, i.e l’antibiotique sélectionne la survie des
souches qui possèdent le gène de résistance. La résistance peut se
développer en une seule étape ou peut résulter de l’accumulation de
plusieurs mutations.
2. Résistance croisée
La résistance croisée sous-entend qu’un mécanisme unique confère
la résistance à de multiples agents antimicrobiens alors que la
résistance multiple sous-entend que de multiples mécanismes sont
impliqués dans la résistance. La résistance croisée et communément
observée pour des agents antimicrobiens apparentés alors que la
résistance multiple est observée pour des agents antimicrobiens non
apparentés.
B. Mechanismes de
resistance
1. Perméabilité de l’agent
antimicrobien affectée
Une perméabilité affectée peut être due à l’incapacité de
l’agent antimicrobien à entrer dans la cellule bactérienne ou
alternativement à un export actif de l’agent hors de la cellule.
2. Inactivation de l’agent
antibactérien
La résistance est souvent le résultat de la production d’une
enzyme qui est capable d’inactiver l’agent antimicrobien.
3. Altération de la cible
Une résistance peut apparaitre suite à l’altération de la
cible de l’agent antimicrobien.
4. Remplacement de la voie sensible
Une résistance peut résulter de l’acquisition d’une nouvelle
enzyme qui remplace l’enzyme sensible à l’agent antimicrobien.
|
|


|
 Retourner à la section d'bacteriologie de Microbiologie et Immunologie On-line
Retourner à la section d'bacteriologie de Microbiologie et Immunologie On-line
This page last changed on
Wednesday, September 04, 2013
Page maintained by
Richard Hunt
Please report any problems to
richard.hunt@uscmed.sc.edu
|

 Figure 1 : Test de susceptibilité aux antibiotiques.
Figure 1 : Test de susceptibilité aux antibiotiques. Figure 3 : Antibiotiques qui agissent au niveau de l’initiation de la synthèse
de protéines.
Figure 3 : Antibiotiques qui agissent au niveau de l’initiation de la synthèse
de protéines.

















