| x | x | |||||||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||||||||
| IMMUNOLOGIE | MYCOLOGY | PARASITOLOGY | VIROLOGIE | |||||||||||||||||||||||||||||||||||||||||||||||
Abdul Ghaffar, Ph.D. Emertius Professor of Pathology, Microbiology and Immunology University of South Carolina
Denis
Hudrisier, Ph.D.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Let us know what you think |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
| Logo image © Jeffrey Nelson, Rush University, Chicago, Illinois and The MicrobeLibrary | ||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
OBJECTIFS DU COURS
|
L’hypersensibilité fait référence à des réactions excessives, indésirables (dommageables, inconfortables et parfois mortelles) produites par le système immunitaire normal. Les réactions d'hypersensibilité ont besoin d'un état (immunitaire) de l'hôte dit « pré-sensibilisé ». Les réactions d'hypersensibilité peuvent être divisés en quatre types: type I, type II, type III et type IV, sur la base des mécanismes impliqués et des délais de réaction. Souvent, un état clinique particulier (maladie) peut comporter plus d'un type de réaction.
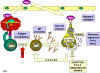
REACTION D’HYPERSENSIBILITE DE TYPE I L’hypersensibilité de type I est également connue comme l'hypersensibilité immédiate ou anaphylactique. La réaction peut impliquer la peau (urticaire et eczéma), les yeux (conjonctivite), le nasopharynx (rhinorrhée, rhinite), les tissus broncho-pulmonaires (asthme) et le tube digestif (gastro-entérite). La réaction peut provoquer une série de symptômes allant de dérangements mineurs jusqu’à la mort. La réaction prend habituellement 15 - 30 minutes à partir du moment de l'exposition à l'antigène, bien que parfois il puisse y avoir un début retardé (10-12 heures). L'hypersensibilité immédiate est médiée par les IgE. Le composant cellulaire primaire dans cette hypersensibilité est le mastocyte ou le basophile. La réaction est amplifiée et/ou modifiée par les plaquettes, les neutrophiles et les éosinophiles. Une biopsie du site de réaction montre la présence d’éosinophiles et de mastocytes principalement. Le mécanisme de la réaction implique la production préférentielle de l'IgE, en réponse à certains antigènes (souvent appelés allergènes). Le mécanisme précis pour expliquer pourquoi certaines personnes sont plus sujettes à ce type d’hypersensibilité n'est pas clair. Cependant, il a été montré que ces individus produisent préférentiellement des cellules TH2 qui sécrètent l'IL-4, IL-5 et IL-13 qui, à leur tour, favorisent la commutation de classe vers anticorps vers les IgE. L’IgE a une très forte affinité pour son récepteur (Fce; CD23) sur les mastocytes et les basophiles. Une ré-exposition au même allergène conduit à l’agrégation des Fce via les IgE auxquelles viennet se lier l’allergène et déclenche la libération de diverses substances pharmacologiquement actives (Figure 1). La réticulation du complexe l'IgE-récepteur Fc est importante dans le déclenchement de l’activation des mastocytes. La dégranulation des mastocytes est précédée par une augmentation de l'afflux de Ca + +, qui est un processus crucial; les ionophores qui augmentent la Ca++ cytoplasmique promeuvent également la dégranulation, alors que les agents qui appauvrissent le Ca + + cytoplasmique inhibent la dégranulation. Les agents libérés par les mastocytes et leurs effets sont présentés dans le Tableau 1. Les mastocytes peuvent être activés par d'autres stimuli tels que l'exercice, le stress émotionnel, les produits chimiques (par exemple, le milieu de développement photographique, les ionophores de calcium, la codéine, etc…), les anaphylotoxines (par exemple, , C4a, C3a, C5a, etc.) Ces réactions, médiées par des agents n’impliquant pas la formation de complexes IgE-allergène, ne sont pas des réactions d'hypersensibilité même si elles produisent les mêmes symptômes.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
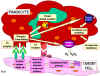
La réaction
est
amplifiée
par le PAF
(facteur
d’activation des plaquettes), qui
provoque
l'agrégation des plaquettes
et la
libération de
l'histamine, de
l'héparine
et des amines
vasoactives.
Le
facteur
chimiotactique
de l'anaphylaxie des
éosinophiles
(ECF-A)
et
des
facteurs chimiotactiques des
neutrophiles
attirent
les
éosinophiles
et les neutrophiles
qui libèrent
diverses enzymes
hydrolytiques
provoquant
une nécrose.
Les
éosinophiles
peuvent également
contrôler
la réaction
locale
en libérant des enzymes comme
l’arylsulphatase,
l’histaminase,
la
phospholipase-D
et des
produits comme la
prostaglandine-E,
bien que ce
rôle
des éosinophiles
soit
maintenant
en question. |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Les nucléotides cycliques semblent jouer un rôle important dans la modulation de la réaction d'hypersensibilité immédiate, bien que leur fonction exacte demeure mal comprise. Des substances qui modifient les taux d'AMPc et de GMPc modifient significativement les symptômes allergiques. Ainsi, les substances qui augmentent l'AMPc intracellulaire semblent soulager les symptômes allergiques, en particulier les symptômes broncho-pulmonaires, et sont utilisés en thérapeutique (Tableau 2). Inversement, les agents qui diminuent l'AMPc ou le cGMP aggravent ces affections allergiques.
Les tests diagnostiques de l'hypersensibilité immédiate incluent les test cutanés (Prick-test et intradermo réaction) (Fig. 1A) ainsi que la mesure des IgE totales et des IgE spécifiques contre les allergènes suspectés. Les IgE totales et les IgE spécifiques sont mesurées par un dosage immuno-enzymatique (ELISA) adapté. L'augmentation des taux d'IgE suggère une situation atopique bien que l'IgE puisse être élevée dans certaines maladies non-atopiques (par exemple les myélomes, les infections par des helminthes, etc...) Il semble y avoir une prédisposition génétique pour les maladies atopiques et il existe des preuves d’association avec certains allèles HLA (A2). Le traitement symptomatique est réalisé avec des anti-histaminiques qui bloquent les récepteurs de l'histamine. Le cromoglicate de sodium inhibe la dégranulation des mastocytes, probablement, par inhibition de l'afflux de Ca + +. Les symptômes allergiques d'apparition tardive, en particulier la bronchoconstriction qui est médiée par les leukotriènes, sont traités avec des inhibiteurs des récepteurs des leucotriènes (Singulair, Accolate) ou des inhibiteurs de la voie de la cyclo-oxygénase (Zileutoin). La bronchoconstriction est également traitée par bronchodilatateurs (en inhalateur) tels que les dérivés de l’isoprotérénol (Terbutaline, Albuterol). La théophylline qui élève l'AMPc en inhibant l'AMPc phosphodiestérase et inhibe le Ca + + intracellulaire est également utilisée pour soulager les symptômes broncho-pulmonaires. L'utilisation d'anticorps de type IgG dirigés contre les portions Fc des IgE et qui empêchent la liaison aux mastocytes a été approuvée pour le traitement de certaines allergies, dans la mesure où ce traitement peut bloquer la sensibilisation des mastocytes.
La
désensibilisation
(immunothérapie
ou
désensibilisation)
est une autre
modalité de
traitement
qui
est retenue
dans
un certain
nombre d'allergies, en particulier
pour
les venins
d'insectes
et, dans
une
certaine mesure, les pollens.
Le mécanisme
n'est pas
clair,
mais
il existe
une corrélation
entre l'apparition
d'IgG
(anticorps
bloquants)
et
le
soulagement des symptômes.
Les cellules
T
suppressives
qui inhibent
spécifiquement la production d’anticorps de type
IgE
peuvent
aussi jouer
un rôle. |
||||||||||||||||||||||||||||||||||||||||||||||||||
 Figure 1A Vue du résultat d’un test de réaction intradermique avec de
nombreuses réponses positives à des allergènes
Figure 1A Vue du résultat d’un test de réaction intradermique avec de
nombreuses réponses positives à des allergènes © Bristol Biomedical Image Archive. Utilisé avec permission
|
Hypersensitibilite de type ii
L'hypersensibilité de type II est également connue comme l'hypersensibilité cytotoxique et peut affecter une variété d'organes et de tissus. Les antigènes sont normalement endogènes, bien que les produits chimiques exogènes (haptènes) capables de se lier aux membranes cellulaires peuvent également conduire à une hypersensibilité de type II. L’anémie hémolytique médicamenteuse, la granulocytopénie et la thrombocytopénie sont des exemples. Le temps de réaction est de quelques minutes à quelques heures. L'hypersensibilité de type II est principalement médiée par les anticorps de la classe IgM ou IgG et le complément (Figure 2). Les phagocytes et les cellules Killer peuvent également jouer un rôle.
Hypersensitibilite de type iiI L’hypersensibilité de type III est également connue comme l'hypersensibilité à complexes immuns. La réaction peut être générale (par exemple : maladie sérique) ou peut impliquer différents organes dont la peau (le lupus érythémateux disséminé, réaction d’Arthus), les reins (néphrite lupique), les poumons (aspergillose), les vaisseaux sanguins (périartérite), les articulations (polyarthrite rhumatoïde) ou d'autres organes. Cette réaction peut aussi être le mécanisme pathogènique de maladies provoquées par de nombreux micro-organismes. La réaction peut débuter 3 - 10 heures après l'exposition à l'antigène (comme dans la réaction d'Arthus). Elle est médiée par des complexes immuns solubles. Ils impliquent surtout des immunoglobuliness de la classe IgG mais l’IgM peut aussi être impliquée. L'antigène incriminé peut être exogènee (infections chroniques bactériennes, virales ou parasitaires) ou endogènes (auto-immunité non spécifique d’organe: par exemple, le lupus érythémateux disséminé, SLE). L'antigène est soluble et non lié à l'organe impliqué. Les principaux composants sont les complexes immuns solubles et le complément (C3a, 4a et 5a). Les dommages sont causés par les plaquettes et les neutrophiles (Figure 4). La lésion contient principalement des neutrophiles et des dépôts de complexes immuns et de complément. Les macrophages infiltrant les tissus dans les étapes ultérieures peuvent être impliqués dans le processus de guérison. L'affinité des anticorps et la taille des complexes immuns sont des éléments importants pour le déclenchement de la maladie et la détermination du tissu impliqué. Le diagnostic repose sur l'examen des biopsies de tissus par microscopie de fluorescence visant à détecter les dépôts d'immunoglobulines et le complément. La coloration par immunofluorescence de l'hypersensibilité de type III est granuleuse (par opposition à l’imagerie linéaire vue dans le type II). La présence de complexes immuns dans le sérum et la déplétion du taux de complément sont également des éléments du diagnostic. La turbidité induite par le polyéthylène glycol (néphélométrie), le test de liaison au C1q et le test utilisant les cellules Raji sont également utilisés pour détecter les complexes immuns. Le traitement comprend des agents anti-inflammatoires.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
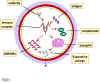 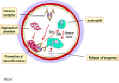
Figure 4. Mécanisme des dommages liés aux complexes immuns dans l’hypersensibilité
|
Hypersensitibilite de type iV
L’hypersensibilité de type IV est également connue comme hypersensibilité à médiation cellulaire ou hypersensibilité de type retardée. L'exemple classique de cette hypersensibilité est à le test à la tuberculine (Mantoux) (Figure 5) dont l’intensité culmine 48 heures après l'injection de l'antigène (PPD ou tuberculine). La lésion est caractérisée par un érythème et une induration.
L’hypersensibilité de type IV
est
impliquée dans
la
pathogenèse
de nombreuses
maladies auto-immunes
et
infectieuses (tuberculose, lèpre,
blastomycose,
histoplasmose,
toxoplasmose, leishmaniose,
etc..)
et les
granulomes
dus
à des
infections et
des antigènes étrangers.
Une autre
forme
d'hypersensibilité
retardée
est la
dermatite
de contact (exposition au
poison du sumac vénéneux
(Figure
6),
produits chimiques,
métaux lourds,
etc…)
dont les
lésions
sont plus
papuleuses.
Les
hypersensibilités de type IV
peuvent être classées en
trois
catégories
en fonction du délai
d’initiation et du tableau clinique et
histologique
(Tableau 3). |
|||||||||||||||||||||||||||||||||||||||||||||||||
 Figure 6 Poison Ivy (sumac grimpant) CDC
Figure 6 Poison Ivy (sumac grimpant) CDC |
Les mécanismes d'endommagement tissulaires dans l'hypersensibilité retardée mettent en jeu des lymphocytes T et des monocytes et/ou macrophages. Les cellules T cytotoxiques (Tc) causent des dommages directs, tandis que les cellules T helper (Th1) sécrètent des cytokines qui activent les cellules T cytotoxiques et recrutent et activent les monocytes et les macrophages, qui provoquent la majeure partie des dommages (Figure 4). Les lésions d'hypersensibilité retardée contiennent principalement des monocytes et quelques cellules T. Les principales lymphokines impliquées dans la réaction d'hypersensibilité retardée sont des facteurs chimiotactiques des monocytes, l'interleukine-2, l'interféron-gamma, les TNF alpha et beta, etc… Les tests de diagnostic in vivo incluent la réaction cutanée retardée (par exemple le test Mantoux (Figure 5)) et le patch test (dermatite de contact). Les tests in vitro pour une hypersensibilité retardée incluent les tests de réponse mitogénique, de lymphocytotoxicité et la production d'IL-2. Les corticostéroïdes et d'autres agents immunosuppresseurs sont
utilisés dans le traitement de ces affections.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Vous avez appris: Les distinctions entre les différents types d'hypersensibilité. Les mécanismes des dommages à médiation immunitaire. Des exemples de différents types d'hypersensibilité et les chevauchements entre eux. Les tests de diagnostic pour les maladies
d'hypersensibilité et les traitements.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||