|
OBJECTIFS DU COURS
Connaître les preuves d’une réactivité immunitaire contre les tumeurs
Connaître les modifications des caractéristiques cellulaires dans le cas
des tumeurs malignes
Connaître les composants de l’hôte qui limitent la progression tumorale
Connaître les composants de la cellule tumorale qui la protègent contre
l’action du système immunitaire
Comprendre les bases rationnelles de l’immunothérapie des tumeurs et
connaître les approches utilisées
|
TRANSFORMATION MALIGNE
La prolifération des cellules
normales est soigneusement régulée. Cependant, lorsque ces cellules sont
exposées à des agents chimiques carcinogènes, à des irradiations ou à
certains virus, elles peuvent subir des mutations conduisant à leur
transformation en cellules capables de croître de façon non maîtrisée,
produisant une tumeur ou néoplasme.
Une tumeur peut être:
-
bénigne, si elle n'est pas
capable d'une croissance indéfinie : dans ces conditions, l'hôte
survit.
-
maligne, si la tumeur
continue de croître indéfiniment et dissémine (métastases),
finissant par tuer l'hôte. Cette croissance incontrôlée peut être
due à l’expression augmentée d'oncogènes (gènes cancérigènes) et/ou
une expression diminuée de gènes suppresseurs de tumeurs (c'est-à
qui dire qui inhibent normalement la croissance tumorale en
induisant la mort cellulaire).
PREUVES DE L’EXISTENCE D’UNE RÉACTIVITÉ IMMUNOLOGIQUE CONTRE LES TUMEURS
Il y a de nombreuses
indications que les tumeurs peuvent déclencher une réponse immunitaire:
-
Les tumeurs présentant une
infiltration massive de cellules mononucléaires disposent d’un
meilleur pronostic que celles ne présentant pas de telles
infiltrations.
-
Certaines tumeurs (par
exemple : les mélanomes, les neuroblastomes) régressent spontanément
ce qui suggère l’action d’une réponse immunitaire.
-
Des métastases de tumeurs
régressent après le retrait de la tumeur primaire, ce qui réduit la
charge tumorale et induit de ce fait une réponse du système
immunitaire permettant de tuer la tumeur résiduelle.
-
Bien que la chimiothérapie
entraîne le rejet d'un grand nombre de cellules tumorales, les
cellules tumorales qui échappent à l'action des médicaments peuvent
prendre le dessus et tuer l'hôte. Toutefois, le système immunitaire
peut être capable de réagir contre les cellules tumorales
résiduelles insensibles à l'agent chimiothérapeutique.
-
Il y a une augmentation de
l'incidence des tumeurs malignes chez les patients immunodéficients
comme les sidéens (sensibles au sarcome de Kaposi) et chez les
patients transplantés [sensibles aux tumeurs induites par le virus
d'Epstein-Barr (EBV)].
-
Des anticorps spécifiques
de la tumeur et des lymphocytes T (détectés dans des essais de
cytotoxicité et de réponse proliférative) ont été observés chez les
patients porteurs de tumeurs.
-
Les segments les plus
jeunes et les plus vieux de la population ont une incidence accrue
de tumeurs. Or, ces personnes ont souvent un système immunitaire
compromis.
-
On peut immuniser des
individus contre divers types de tumeurs montrant que les antigènes
tumoraux peuvent provoquer une réponse immunitaire.
ANTIGENES ASSOCIES AUX
TUMEURS
Pour que le système
immunitaire réagisse contre une tumeur, il doit pouvoir détecter des
antigènes reconnus comme étrangers. Un certain nombre d'altérations de
l'expression génique dans les cellules se produit au cours de la
tumorigénèse. La tumorigénèse peut conduire à l'expression de nouveaux
antigènes (néo-antigènes) ou la modification d’antigènes existants déjà
présents dans les cellules normales. Ces antigènes peuvent être des
récepteurs membranaires, des régulateurs du cycle cellulaire et de
l'apoptose ou encore des molécules impliquées dans les voies de
transduction du signal.
Il existe 2 types principaux
d'antigènes tumoraux:
-
les antigènes de
transplantation spécifiques de la tumeur (TSTA) qui sont uniques aux
cellules tumorales et ne sont pas exprimés sur les cellules normales.
Ils sont responsables du rejet de la tumeur.
-
les antigènes de
transplantation associés aux tumeur (TATA) qui sont exprimés par les
cellules tumorales et les cellules normales.
Bien que les agents chimiques,
les rayons UV ou les tumeurs induites par des virus expriment des
néo-antigènes, la majorité de ces tumeurs sont souvent faiblement
immunogènes voire non-immunogènes. Dans la plupart des cas, les TSTA ne
peuvent être facilement identifiés. Certains de ces antigènes peuvent
être sécrétés tandis que d'autres peuvent être associés à la membrane.
Antigènes de
transplantation associés aux tumeurs (TATA)
La majorité des antigènes de tumeur sont également présents sur les
cellules normales et sont désignés comme des antigènes de
transplantation associés à une tumeur. Ils peuvent être exprimés à
des niveaux plus élevés sur les cellules tumorales que sur les
cellules normales. Parfois, ils peuvent être exprimés uniquement au
cours du développement puis perdus au cours de la vie adulte, mais
ré-exprimés dans les tumeurs.
Antigènes
développementaux associés aux tumeurs ou antigènes onco-fœtaux.
Il s'agit notamment de l'alpha-foetoprotéine (AFP) et de l'antigène
carcino-embryonnaire (CEA) que l’on trouve sécrétés dans le sérum.
L’AFP est retrouvée chez des patients atteints d'un carcinome
hépatocellulaire alors que le CEA est retrouvé dans le cancer du
côlon. Ces antigènes sont importants en termes de diagnostic. L’AFP
est produite uniquement sous la forme d’une protéine sécrétée tandis
que le CEA est retrouvé à la fois sur les membranes cellulaires et
dans les fluides sécrétés. Dans la mesure où les antigènes sécrétés
contribuent peu à l'immunité contre les tumeurs, le rôle de ces
néo-antigènes dans l'immuno-surveillance reste discutable.
La concentration
physiologique de l'AFP chez l'homme est de l’ordre de 0-20 ng/ml. Ce
niveau augmente considérablement chez les patients atteints
d’hépatomes et de carcinome testiculaire non-séminal. Une hausse de
5 fois ou plus dans l’e cette protéine sera utilisée pour suivre
l’évolution des hépatomes et des cancers testiculaires. Le niveau
d’AFP pourra également être élevé dans certaines conditions non
malignes, comme la cirrhose, l'hépatite et d'autres formes de
dommages au foie.
Le taux d'ACE chez les
individus sains va jusqu'à 2,5 ng/ml, mais il augmente de manière
significative dans certaines tumeurs malignes, en particulier les
cancers colo-rectaux. Il peut également augmenter dans certaines
conditions non malignes (comme la cirrhose chronique, l'emphysème
pulmonaire et le tabagisme lourd). Des niveaux qui sont 4 à 5 fois
supérieurs à la normale ont été utilisés pour prédire la récidive
des tumeurs colo-rectales.
|
 Figure 1
Figure 1 |
ANTIGENES DE
TRANSPLANTATION ASSOCIES AUX TUMEURS SUR LES TUMEURS D’ORIGINE VIRALE
Les virus qui causent des tumeurs humaines comprennent:
Les virus à ADN
-
virus de type papova (papilloma, polyoma): le virus
Papilloma cause le cancer du col utérin.
-
Les virus des hépatites: le virus de l'hépatite B
provoque le cancer hépatocellulaire.
-
Les adénovirus peuvent également être tumorigènes
Les virus à ARN
Un certain nombre de virus provoquent différents types de tumeurs chez
les animaux (par exemple les virus SV-40, l’adénovirus, le virus du
sarcome de Rous, le virus de Friend érythroleucémique, le virus de
Moloney Rauscher et Gross). Les virus sont impliqués ou soupçonnés
d'être impliqués dans certaines tumeurs malignes humaines (HTLV-1 pour
la leucémie, le virus de l'hépatite B pour le carcinome hépatique, le
virus du papillome pour le cancer du col utérin). Les tumeurs induites
par les virus expriment des antigènes de surface cellulaire distincts
des antigènes du virion lui-même et qui sont partagés par toutes les
tumeurs induites par le même virus. Ces antigènes sont caractéristiques
du virus provoquant la tumeur, quelle que soit l'origine tissulaire de
la tumeur ou de l'espèce animale dans laquelle la tumeur est présente
(Figure 1). Davantage d'informations sur les virus de tumeurs sont
accessibles dans la section sur les
virus oncogènes
|
 Figure 2
Figure 2 |
ANTIGENES DE
TRANSPLANTATION ASSOCIES AUX TUMEURS SUR LES TUMEURS INDUITES PAR DES
AGENTS CHIMIQUES
Les tumeurs induites chimiquement sont différentes des
tumeurs induites par les virus en ce sens qu'elles sont très hétérogènes
du point de vue de leurs caractéristiques antigéniques. Ainsi, deux
tumeurs induites par le même produit chimique, même chez le même animal,
n’ont que rarement des antigènes spécifiques de tumeurs en commun
(Figure 2). Ces antigènes spécifiques de tumeurs induits chimiquement
sont appelés antigènes de transplantation spécifiques de la tumeur (TSTA).
TUMEURS SYNGENIQUES, ALLOGENIQUES
ET XENOGENIQUES
Une tumeur qui se développe dans une souche animale va
également croître dans un autre animal appartenant à la même souche pure
obtenue par croisements répétés entre frères et sœurs. Ces animaux
expriment les mêmes molécules du CMH et sont dits syngéniques. Cependant,
la plupart des populations animales d’une même espèce sont allogéniques
et vont exprimer différents haplotypes du CMH. Ainsi, une tumeur
transférée d'un animal à un autre animal appartenant à une souche non
consanguine sera rejetée davantage en raison des différences de CMH que
de celles en TSTA. Une tumeur transférée à partir d'un animal
appartenant à une espèce donnée à un autre animal appartenant à une
espèce différente est rapidement rejetée parce que les animaux sont
xénogéniques.
|
| |
IMMUNITE CONTRE
LES TUMEURS
Bien qu'il y ait de nombreuses indications d’une
réactivité immunitaire anti-tumorale chez l'homme, les preuves de
l’existence d’une immunité contre les tumeurs malignes proviennent
essentiellement d'études expérimentales chez l’animal. Des souris ont
été immunisées par administration de cellules tumorales irradiées ou
après l'enlèvement d'une tumeur primaire avant de recevoir la même
tumeur mais viable et agressive. Ces animaux se sont révélés résistants
à l’implantation de la tumeur viable. Bien que les anticorps puissent se
développer contre certains cancers, c’est l'immunité à médiation
cellulaire qui joue un rôle essentiel dans le rejet de la tumeur. Ainsi,
dans la plupart des cas, l'immunité peut être transférée d'un animal
chez lequel la tumeur a régressé, vers un animal destinataire syngénique
naïf grâce à l’administration de lymphocytes T. Les cellules T
auxilliaires (Th) reconnaissent des antigènes tumoraux relâchés par la
tumeur puis internalisés, apprêtés et présentés en association avec le
CMH de classe II sur les cellules présentatrices d'antigènes. Ces
cellules Th, une fois activées, produisent des cytokines. Les Th ainsi
activés fournissent alors une aide aux cellules B pour favoriser la
production d'anticorps. Des cytokines telles que l'IFN-gamma peuvent
également activer les macrophages et leur conférer une activité anti-tumorale.
Par ailleurs, les cellules Th fournissent une aide aux cellules T
cytotoxiques spécifiques de la tumeur (CTL) en induisant leur
prolifération et leur différenciation. Les CTL reconnaissent les
antigènes tumoraux dans le contexte du CMH de classe I et permettent la
lyse des cellules tumorales. Pour les tumeurs qui présentent une
diminution dans l’expression des antigènes du CMH, les cellules tueuses
naturelles (NK) jouent alors un rôle important dans le rejet de tumeur.
ÉCHAPPEMENT À L’IMMUNO-SURVEILLANCE
Selon la théorie de la surveillance immunitaire, les
cellules cancéreuses qui se développent dans le corps sont éliminées par
le système immunitaire. Toutefois, en raison d’une réactivité
immunitaire altérée, les cellules cancéreuses peuvent parvenir à
échapper à la destruction. Les tumeurs échappent à la reconnaissance
immune par plusieurs mécanismes. Elles peuvent ne pas exprimer de
néo-antigènes suffisamment immunogènes ou peuvent ne pas exprimer les
molécules co-stimulatrices nécessaires pour l'activation des lymphocytes
T. En outre, certaines tumeurs sont connues pour n’exprimer que
faiblement, voire pas du tout, les antigènes du CMH. Une autre raison de
l'échec de la surveillance immunitaire peut être le fait que, dans le
développement précoce d'une tumeur, la quantité d'antigène peut être
trop faible pour stimuler le système immunitaire (on parle de tolérance
à faible dose) ou, en raison de la prolifération rapide de cellules
malignes (on parle de tolérance à forte dose). Le système immunitaire
est alors rapidement débordé. En outre, certaines tumeurs peuvent
échapper au système immunitaire en sécrétant des molécules
immunosuppressives et d'autres peuvent induire des cellules régulatrices,
en particulier les cellules régulatrices T + CD4 + CD25 + FoxP3.
Finalement, certaines tumeurs peuvent relâcher leurs antigènes dans le
milieu extracellulaire : ces antigènes peuvent à leur tour interagir et
bloquer les anticorps et les lymphocytes T lors de la réaction avec les
cellules tumorales.
|
| |
UTILISATION DE
NÉO-ANTIGÈNES TUMORAUX POUR LA PRISE EN CHARGE DES PATIENTS
La présence de néo-antigènes sur les cellules tumorales
a été exploitée à des fins diagnostic et thérapeutique.
Immuno-diagnostic
Les anticorps monoclonaux marqués avec des
radio-isotopes ont été utilisés pour la détection in vivo de foyers
tumoraux relativement petits. Les anticorps ont également été
utilisés in vitro pour identifier l'origine cellulaire de tumeurs
non différenciées, en particulier celles d'origine lymphoïde. De
plus, la coloration immuno-histologique est utilisée pour confirmer
la présence de foyers métastatiques suspects, en particulier dans la
moelle osseuse
|
| |
Immunothérapie
L'immunothérapie est très utilisée en tant que
nouveau moyen de traitement du cancer. Deux stratégies, active et
passive, ont été utilisés pour stimuler les réponses immunitaires
non-spécifique et spécifique et ont, dans certains cas, connu un
succès considérable.
-
une activation spécifique est obtenue en
utilisant des vaccins. Exemple : vaccin contre l'hépatite B
ou contre le virus du papillome humain (HPV)
-
une activation non spécifique est obtenue
par immunisation avec, par exemple, le bacille de
Calmette-Guérin (BCG) ou Corynebacterium parvum
Ces microorganismes atténués activent les
macrophages et leurs confèrent une activité tumoricide.
-
Approche spécifique:
i) transfert d’anticorps dirigés contre des antigènes
tumoraux (par exemple, Her2/Neu pour le traitement du cancer
du sein)
ii) transfert d’anticorps contre l'IL-2R pour la leucémie à
cellule T de l’adulte due au virus lymphotrope T humain
(HTLV-1)
iii) transfert d’anticorps contre la molécule CD20 exprimée
sur les lymphomes à cellules B non hodgkinien. Ces anticorps
se lient à des antigènes tumoraux à la surface cellulaire et
activent le complément (C ') qui sert de médiateur pour la
lyse des cellules tumorales. En outre, des cellules portant
des récepteurs Fc, tels que des cellules NK, des macrophages
et des granulocytes peuvent se lier à des complexes
antigène-anticorps à la surface des cellules tumorales et
médier la lyse des cellules tumorales par le mécanisme de
cytotoxicité à médiation cellulaire dépendante des anticorps.
iv) transfert d’anticorps conjugués à des toxines, des
radio-isotopes ou des médicaments anti-cancéreux. Ceux-ci
pénètrent dans les cellules et inhibent la synthèse des
protéines. Par exemple, utilisation d’un anticorps anti-CD20
conjugué à la toxine de Pseudomonas ou à la ricine.
Il existe plusieurs problèmes avec l'utilisation
d'anticorps
-
Les anticorps peuvent ne pas être
efficaces car les antigènes tumoraux sont associées à
des antigènes de classe I du CMH.
-
Les tumeurs peuvent relâcher dans leur
environnement les antigènes ou les complexes
antigène-anticorps. Dans ce cas, les cellules
immunitaires ne peuvent plus servir de médiateurs à la
destruction de la tumeur.
-
Certains anticorps peuvent ne pas être
cytotoxiques.
-
Les anticorps peuvent se lier de manière
non spécifique aux cellules du système immunitaire
exprimant des récepteurs Fc (cellules NK, lymphocytes B,
macrophages et granulocytes) et ne sont alors plus
disponibles pour se lier aux cellules tumorales.
o Approches non-spécifique:
i) transfert adoptif de lymphocytes:
ii) Les cellules dendritiques incubées avec
des antigènes tumoraux peuvent induire des réponses de
cellules T spécifiques de la tumeur. Dans la mesure où les
antigènes tumoraux ne sont généralement pas connus, des
lysats tumoraux sont utilisés.
iii) Les cytokines
-
L’IL-2 active les cellules T et les
cellules NK exprimant les récepteurs à l’IL-2. Elle est
utilisée dans le traitement du carcinome des cellules
rénales et le mélanome
-
L’IFN-alpha induit l'expression du CMH
sur les tumeurs et est utilisé dans le traitement de la
leucémie à tricholeucocytes
-
L’IFN-gamma augmente l’expression du CMH
de classe II notamment et est utilisé dans le traitement
de cancers de l'ovaire.
-
Le TNF-alpha tue les cellules tumorales.
iv) la transfection de tumeurs par des gènes de cytokines
peut également être utilisée pour activer l'immunité anti-tumorale
médiée par les cellules T ou les LAK.
|
Table 1. Immunothérapie des tumeurs |
|
active |
non-spécifique |
BCG*, Propionibacterium acnes,
levamisole, cytokine genes, etc. |
|
spécifique |
Cellules tumorales tuées ou extraits cellulaires,
antigènes recombinants, molécules co-stimulatrices, etc… |
|
passive |
non-spécifique |
Cellules LAK, cytokines |
|
spécifique |
Anticorps seuls ou couplés à des molécules toxiques, des
précurseurs de toxines ou des radioéléments ; anticorps bispécifiques ;
cellules T |
|
combinée |
Cellules LAK et anticorps bispécifiques |
|
* BCG: Le Bacille de Calmette et Guérin est
une souche bovine proche de Mycobacterium tuberculosis |
|
| |
De
nombreux agents (modificateurs de la réponse biologique immunostimulante)
sont utilisés pour renforcer l'immunité anti-tumorale. Cela inclue des
produits bactériens, des produits chimiques de synthèse et des cytokines
(Tableau 2). La plupart de ces agents exercent leurs effets en activant
les macrophages et les cellules tueuses naturelles (NK), provoquant la
production de cytokines ou l'amélioration des fonctions des cellules T.
|
Table 2. Immunothérapie active
non-spécifique: modulateurs de la réponse biologique (BRMs) |
|
Type de BRM |
Exemples |
Effet majeur |
|
Produits bactériens |
BCG, P. acnes, muramyl di-peptide, trehalose
dimycolate |
Activent les macrophages et les cellules NK (via des
cytokines induites) |
|
Molécules synthétiques |
pyran, poly I:C, pyrimidines |
Induisent la production d’interférons |
|
Cytokines |
Interferon-alpha, -beta, -gamma, IL-2, TNF |
Activent les macrophages et les cellules NK |
|
| |
Depuis la découverte que les
cytokines ont des effets puissants et sélectifs sur certains éléments du
système immunitaire, nombre d’entre elles ont été utilisées pour
potentialiser la fonction immunitaire de l'hôte (Tableau 3).
|
Table 3. Cytokines utilisées en
thérapie anti-tumorale |
|
Cytokine |
Type de tumeur et résultats
obtenus |
Mécanismes anti-tumoraux |
|
IFN-alpha, beta |
Rémission de la leucémie à tricholeucocytes, faible effet
sur certains cancers |
Augmentation de l’expression des antigènes du CMH de
classe I, effet cytostatique anti-tumoral possible |
|
IFN-gamma |
Rémission du carcinome péritonéal de l’ovaire ; inefficace
par voie systémique |
Augmentation de l’expression des antigènes du CMH,
activation des macrophages, cellules T cytotoxiques et cellules NK |
|
IL-2 |
Rémission du carcinome rénal et du mélanome |
Prolifération et activation des cellules T, activation des
cellules NK |
|
TNF-alpha |
Peut réduire les ascites malignes |
Activation des macrophages et des lymphocytes |
|
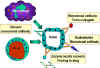 Figure 3
Figure 3 |
Des anticorps anti-tumoraux
monoclonaux ont été utilisés sous des formes différentes pour le
traitement du cancer, soit en raison de leur effet direct ou en tant que
véhicules pour cibler des médicaments anticancéreux, des toxines et des
composants non spécifiques du système immunitaire de l'hôte vers le site
de la tumeur (Figure 3). En outre, de tels anticorps spécifiques sont
également utilisés dans le diagnostic de lésions métastatiques, dans le
cas où elles sont non détectables par des moyens radiologiques
conventionnels. |
| |
|
|
|
 Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
This page last changed on
Monday, October 06, 2014
Page maintained by
Richard Hunt
Please report any problems to
richard.hunt@uscmed.sc.edu
|

 Figure 1
Figure 1 Figure 2
Figure 2 Figure 3
Figure 3