|
|
 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Dr Richard Hunt |
BACTERIOLOGÍA | INMUNOLOGÍA | MICOLOGÍA | PARASITOLOGÍA | VIROLOGÍA | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
VIDEOCONFERENCIA |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
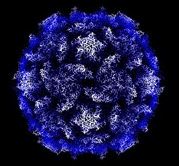
Polio virus (Tomado del Hogle Lab de Harvard, URL desconocido) Muchas de las imágenes en la sección de la Viruela en este archivo fueron tomadas de Fenner, Henderson, Arita et al. La viruela y su erradicación. 1988 Génova, Organización Mundial de la Salud y fueron compiladas por Laura Gregorio en su ensayo El legado de la Viruela, Pharos. Otoño 1996 |
INTRODUCCIÓN ¿Qué es una vacuna? Las vacunas son agentes inocuos, percibidos como dañinos. Son moléculas, no siempre proteicas, que evocan una respuesta inmunológica, proveyendo así inmunidad protectora contra patógenos potenciales. Aunque que el patógeno puede ser una bacteria o incluso un protozoario eucariótico, las vacunas más eficaces han sido las creada contra los virus y en este capítulo trataremos mayormente de vacunas antivirales. La inmunidad contra un virus normalmente depende del desarrollo de una respuesta inmune hacia antígenos que se encuentran en la superficie de una célula infectada por el virus de que se trate o en la superficie del virus mismo. Las respuestas inmunes a antígenos internos regularmente juegan un papel mínimo en lo que es inmunidad. Por ello, en pandemias de influenza, en las que una nueva glicoproteína de superficie, adquirida mediante cambios antigénicos, caracteriza a la nueva cepa del virus, la población tiene muy poca por no decir ninguna inmunidad contra esta. Esta nueva cepa del virus de la influenza puede, no obstante, contener proteínas internas que también se hallan en cepas ya conocidas. A las glicoproteínas de superficie también se les conoce como antígenos protectores. Para crear una vacuna exitosa contra un virus, la naturaleza de estas proteínas de superficie ha de ser conocida, a menos que se quiera abordar de forma empírica como se hacía antaño. Haremos notar, sin embargo, que una célula infectada por un virus, muestra fragmentos de los antígenos internos de dicho virus en su superficie, y estos pueden provocar una respuesta citotóxica de células T en contra de la célula infectada. Se puede encontrar más de una glicoproteína de superficie en un virus y alguna de estas puede ser más importante que las otras en la respuesta inmune protectora; este antígeno ha de ser identificado para una vacuna lógica que no permita ineficacia. Por ejemplo, el virus de la influenza tiene una neuraminidasa y una hemaglutinina en su superficie. La hemaglutinina es la que provoca la neutralización de la inmunidad porque es la proteína que adhiere el virus a sus receptores en la superficie de las células a infectar, y un anticuerpo neutralizante interferiría con la unión del virus a la célula. Además del impedimento de la unión del virus con la célula, otros factores pueden ser importantes en la neutralización de los virus; por ejemplo, el sistema de complemento puede lisar viriones envueltos luego de la opsonización por anticuerpos anti-virales.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
FUENTES EN LA RED (en inglés) |
Principales lugares de ataque de una infección viral Para desarrolla una vacuna eficaz, ciertas características de una infección viral deben de conocerse. Una de estas es la puerta de entrada del virus al organismo. Tres lugares principales pueden definirse:
La inmunidad local mediada por IgA es muy importante en los tipos 1 y 2. No hay mucha importancia en neutralizas los anticuerpos humorales en la circulación si el virus se replica en el tracto respiratorio superior, por ejemplo. Lógicamente, en este caso los anticuerpos secretados son más importantes. Por tanto, lo que se necesita saber:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Figura 1 Comparación de la morbilidad máxima y actual de las
enfermedades prevenibles por vacunas
Figura 1 Comparación de la morbilidad máxima y actual de las
enfermedades prevenibles por vacunas |
Tipos de vacunas Hay tres tipos básicos de vacunas hoy en día
Inconveniente en el desarrollo de vacunas Hay muchos inconvenientes inherentes al desarrollo de una buena protectora vacuna antiviral. Entres estos tenemos:
A pesar de estos inconvenientes, las vacunas anti-virales han sido, en algunos casos, espectacularmente eficaces (figura 1) llevando en un caso (el de la viruela) a la eliminación de la enfermedad de la población humana. La vacuna de la viruela es un ejemplo de vacuna atenuada, aunque no para el patógeno original. Otra vacuna exitosa es la vacuna del polio, la cual podría llevar a la eliminación de esta enfermedad de la población humana en los próximos años. Esta vacuna viene en dos formas. La vacuna Salk es una vacuna de virus muertos mientras que la desarrollada por Sabin es una vacuna de virus vivos atenuados. El Polio está actualmente restringido a partes de África y el Sur de Asia.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
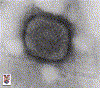
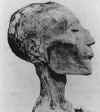
ÉXITOS DEL PASADO VIRUELA (Variola) La viruela es una enfermedad desfigurante y devastadora que es altamente infecciosa. Es causada por el virus variola (también conocido como virus de la viruela), un miembro de los ortopoxviridae (figura 2A). La enfermedad de la viruela se conoce desde hace miles de años y probablemente se originó en Asia. Se difundió hacia el Oeste al Medio Oriente y entre sus víctimas estuvo de Faraón Ramsés V (figura 2B). Puede que la enfermedad haya alcanzado Europa con las cruzadas. La viruela fue introducida al Nuevo Mundo por los colonizadores europeos y causó epidemias devastadoras en las poblaciones indígenas que no habías adquirido inmunidad natural. De hecho, algunos de los primeros colonizadores utilizaron la viruela como un arma biológica en contra de los habitantes naturales de América del Norte y Sudamérica. La viruela se caracteriza por numerosas pústulas en todo el cuerpo que contienen el virus infeccioso (figuras 2C y D). La tasa de mortalidad es más de un 25% de los pacientes infectados con su variante más complicada por el virus variola mayor. Otra forma de la viruela causada por el variola menor tiene una tasa de mortalidad menos alta (hasta un 5%). Los primeros intentos para controlar la viruela ocurrieron en el siglo X e implicaron ‘variolación’ (así llamada por el nombre de Variola del virus). En la variolación (figura 2E), se obtenía material (costras) de las pústulas de una persona infectada que no hubiese muerto por la enfermedad. Esta persona, por tanto, tenía la forma menos severa de la enfermedad como resultado de la ocurrencia de una variante natural. Este material era usado para infectar otra persona quien, generalmente, también sufría una forma menos severa de la enfermedad. Si la persona no moría, tenía inmunidad de por vida. Otra razón del éxito de la variolización es que el virus en las costras era menos virulento puesto que había sido parcialmente disecado y había sido unido e inactivado por anticuerpos del donante. La tasa de mortalidad de la variolación es cerca de 1-2% y por eso todavía era un procedimiento peligroso. Esta técnica fue usada en Pakistán, Etiopía, y Afganistán hasta 1970. La variolación fue difundida en Inglaterra en los 1700s cuando fue introducida por la esposa del Embajador Inglés en Turquía, Mary Wortly Montague. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Figura 2
 Figura 2C.
Infante con viruela
Figura 2C.
Infante con viruela
 Figura
E. En la
Medicina China las costras pulverizadas de las pústulas fueron inhaladas
para proveer protección contra la viruela
Figura
E. En la
Medicina China las costras pulverizadas de las pústulas fueron inhaladas
para proveer protección contra la viruela
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 3
 Figura
3C.
La vaca Blossom Figura
3C.
La vaca Blossom
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Jenner era un médico que vivía en pueblo rural de Gloucestershire al oeste de Inglaterra y en ese tiempo era de conocimiento popular que las personas que contraían la viruela de las vacas (como las damiselas que ordeñaban las vacas) parecían ganar inmunidad protectora contra la viruela más virulenta. Jenner vacunó al Sr. Phipps (quien trabajaba para él) y a su propio hijo (figura 3B) con viruela de vaca de una vaca llamada Blossom (figura 3C) y luego presentó a ambos la viruela (variola). Ambos vacunados, afortunadamente, estaban protegidos. El virus original usado por Jenner no era el vaccinia que fue usado en las vacunaciones más recientes contra la viruela. El virus de la vacuna pudo haber surgido de un pox de caballo o de vaca recombinado. Por mucho tiempo, el virus de la vacuna fue mantenido en caballos o búfalos. El último caso de viruela natural en el Reino Unido ocurrió en los 1930; el último en EEUU fue en los 1940s. El último caso natural en el mundo fue en Somalia y ocurrió en octubre de 1977 (figura 3D). Aunque el virus había sido eliminado en la naturaleza, la viruela ha sido retenida en los laboratorios y como resultado de un accidente en el mismo hubo un caso subsiguiente fatal en Inglaterra. Las reservas mundiales fueron reducidas a laboratorios en Estados Unidos y en la Unión Soviética. Se desconoce si el virus infeccioso del laboratorio ruso fue distribuido luego de la disolución de la Unión Soviética. La erradicación de la viruela ha sido uno de los grandes triunfos de la salud pública. Hay varias razones para esto:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Figura
4 Figura
4Louis Pasteur |
LA RABIA Casi un siglo después del trabajo pionero de Jenner en la viruela, en 1885 Louis Pasteur (figura 4) desarrolló la primera vacuna atenuada – contra el virus de la rabia (figura 5) (rabhas, Sánscrito: haber violencia. La atenuación se consiguió al seleccionar cepas que eran menos virulentas para los humanos que fueron adaptadas para crecer en un huésped nuevo. Pasteur usó virus de un can rabioso y lo inyectó al cerebro de Conejos. Infecciones seriadas en Conejos llevaron a una cepa viral que era más virulenta en Conejos pero menos en canes (y humanos). Pasteur trató exitosamente a un niño (Joseph Meister) que había sido mordido por un perro rabioso. Vea también el capítulo 20
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| POLIO | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
FUENTES EN LA RED (en inglés)
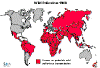
Polio – Conteo
actual de casos globales
Virus silvestre del
polio 2000-2004
Mapa de los casos
actuales VIDEO
Carrera para
alcanzar al último niño |
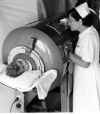
En países occidentales el polio en su tipo silvestres ya no es un problema pero aún se encuentra en algunos países menos desarrollados tales como Nigeria e India (figuras 4, 5 y 6). Hasta los 1950, cuando la vacunación anti-polio se volvió rutina, los brotes veraniegos de polio eran comunes en los países de occidente, generalmente se contagiaba por ruta oro-fecal en piscinas de uso común. Estos brotes llevaron a la difusión del polio paralítico que necesitaba de respiración asistida y el uso de “pulmones de hierro” (figura 7). Hay dos tipos de vacuna contra el polio, ambas fueron desarrolladas en los 1950s. La primera, desarrollada por Jonás Salk, es una preparación de un virus silvestre muerto con formalina. Esta es cultivada en células renales de monos y la vacuna se administra mediante inyección. Provoca una inmunidad humoral (Ig) buena y previene el transporte del virus a las neuronas en donde sería causante de polio paralítico. Esta vacuna es la única que se usó en algunos países escandinavos en donde completamente borró la enfermedad. Una segunda vacuna fue desarrollada por Albert Sabin. Esta es una vacuna de virus vivos que fue producida empíricamente mediante estadiajes seriados del virus en cultivos celulares. Esto dio como resultado la selección de un virus mutado que creció bien en los cultivos y, de hecho, en el intestino humanos en donde el virus silvestre crece. No puede, no obstante, migrar a las neuronas. Se replica en un sitio de infección normal puesto que el virus, de hecho, crece en la vacuna y provoca inmunidad tanto humoral como mediada por células. Se administra oralmente, ruta que es recorrida cuando el virus infecta normalmente, puesto que se transmite por vía oro-fecal. Esta se convirtió en la vacuna preferida en los Estados Unidos, Reino Unido, y muchos otros países porque alivianó la administración (usualmente en un terrón de azúcar), y por el hecho de que el virus de la vacuna se replica en el intestino y que solo se necesita una sola administración para obtener una buena inmunidad (aunque la administración repetida se usó mucho). Además, la inmunidad que resulta con la vacuna Sabin dura mucho más que la de la vacuna Salk, haciendo que la cantidad de refuerzos sea menor. La vacuna Sabin tiene el potencial de eliminar el virus silvestre mientras que la vacuna Salk sólo elimina el virus silvestre que migra a las neuronas y que todavía se replica en intestino humano. La vacuna atenuada de Sabin, no obstante, vino con un inconveniente: mutación de reversión. Esto puede resultar de recombinación entre el virus silvestre y la cepa de la vacuna. El virus virulento es frecuentemente aislado de receptores de la vacuna de Sabin. Los casos residuales (cerca de 8 por año en los EU hasta hace poco) en países que usan la vacuna del virus vivo atenuado fueron resultado de mutación de las cepas de la vacuna a cepas virulentas. Casi la mitad de estos casos sucedieron en vacunados y la mitad en allegados a los vacunados. El polio paralítico surgió en 1 de 100 casos de infección por el virus silvestre y 1 en 4 millones de vacunaciones como resultado de una mutación de reversión a virulencia. Eso se estimó que era aceptable puesto que el uso de virus atenuados significa que la cepa del virus aún se replica en el cuerpo y provee inmunidad intestinal vía IgA. Como resultado de la IgA de la mucosa, el virus silvestre no se replica en el intestino de los que han sido vacunados, ni tampoco puede migrar a tejido neuronal en donde la enfermedad se manifiesta. El vacunado que ha recibido la vacuna de virus muertos de Salk aún permite que el virus silvestre se replique en su tracto gastrointestinal, ya que la mayor respuesta inmune al virus inyectado es IgG. Como se mencionó antes, esta vacuna protege contra el polio paralítico ya que, aunque el virus silvestre todavía se replica en el intestino del vacunado, no puede moverse al sistema nervioso en donde se manifiestan los síntomas de polio. Por tanto, es improbable que el virus silvestre muera en las poblaciones que han recibido únicamente la vacuna de virus muertos, puesto que sería descartado en las heces. Debe de tomarse en cuenta, que en los estudios en Holanda durante el brote de polio en 1992 (entre personas que habían rehusado a vacunarse) se demostró que la inmunidad producida por la vacuna Salk sí previene la circulación del virus silvestre en la población general. Un problema adicional al usar vacunas atenuadas es que la preparación puede contener otros patógenos de las células en las que el virus ha sido cultivado. Esto ciertamente fue el problema inicial puesto que las células de mono que se usaron para producir la vacuna del polio estaban infectadas con el virus del simio 40 (SV40) y este también se encontraba en la vacuna. El SV40 es un poliomavirus y tiene el potencial de causar cáncer (vea el capítulo de los virus oncogénicos). Aparentemente, no obstante, no han causado problemas en los vacunados que lo obtuvieron inadvertidamente. Ha habido algunas alegaciones que la vacuna original de virus atenuados usada en África puedo haber estado contaminada con el virus de la inmunodeficiencia humana (VIH). Este alegato NO ha sido probado verdadero. Por supuesto, también puede haber problemas similares con las vacunas de virus muertos si son inactivados de forma inapropiada. Algo que también ha ocurrido. Recomendaciones actuales con respecto a las vacunas de polio Ahora que los únicos casos de polio en los EU son asociados a la vacuna, el protocolo previo del solo uso de la vacuna Sabin ha sido reevaluado. Primero, esto se realizó con la idea de que uno podía administrar la vacuna de virus muertos primero y luego la vacuna de virus atenuados. La vacuna de virus muertos pararía a los ‘inversores’ vivos de la vacuna al impedir el movimiento al sistema nervioso. Por tanto, en 1997, el siguiente protocolo fue recomendado: Para reducir casos relacionados con vacuna (8 a 10 por año), el Comité Consultor de Prácticas de Inmunización del Centre of Disease Control (CDC) ha recomendado (Enero 1997) un régimen de dos dosis de la vacuna inyectable de virus muertos (inactivados: Salk) seguida de dos dosis de la vacuna oral de virus atenuados en un esquema de dos meses de edad (inactivada), 4 meses (inactivada), 12-18 meses (oral( y 4-6 años (oral). Actualmente se aplican 4 dosis de la vacuna oral en los primeros dos años de vida. Se cree que el nuevo esquema eliminará muchos de los casos de la enfermedad relacionados con la vacuna. Este régimen ya fue adoptado por muchos países europeos y algunas partes de Canadá. . El régimen de la vacunación de polio fue enmendado de nuevo en el 2000. RECOMENDACIONES ACTUALES: Para eliminar el riesgo de Poliomielitis Paralítica asociada a vacunas, el Comité Consultor de Prácticas de Inmunización del CDC recomienda un esquema de vacuna completamente-inactivada del poliovirus (IVP) para la vacunación rutinaria del polio en la niñez en los Estados Unidos. Desde el 1º de Enero del 2000, todos los niños han de recibir cuatro dosis de IVP en las edades de 2 meses, 4 meses, 6-18 meses y 4-6 años. Refiérase aquí (Nota al lector: Recomendaciones del Comité Consultor de Prácticas de Inmunización: Recomendaciones Revisadas para la Vacunación Rutinaria de la Poliomielitis) Otras vacunas anti-virales usadas comúnmente se enumeran en la tabla 1.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
REPORTE DE CASO (en inglés) Infecciones de poliovirus en cuatro niños no vacunados --- Minnesota, Agosto--Octubre 2005 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
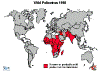
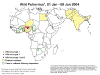 Figura 4.
Figura 4.Polio - 2004 OMS |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 5 -
Estadística del Polio
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Figura 6
 Figura 6B
Figura 6BReporte (casos por 100,000 habitantes) de casos de poliomielitis paralítica en los Estados Unidos de 1951-1992 en donde inicialmente se usó la vacuna de virus muertos de Salk. Esta fue subsiguientemente remplazada por la vacuna oral de virus vivos atenuados desarrollada por Albert Sabin. La vacuna Sabin es deglutida. Usualmente se da en un terrón de azúcar.
 Figura 6D
Figura 6DBrotes en EU desde 1970 CDC
 Figura 6F
Figura 6FPolio paralítico asociado a vacunas - VAPP en EU 1964-1995 CDC
 Figura 6H
Figura 6HRiesgo de polio paralítico asociado a vacunas 1980-94
 Figura 6J
Figura 6JRiesgo de polio paralítico asociado a vacunas en personas relacionadas a los vacunados 1980-94 CDC |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Figura 7 - Poliomieliti
 Figura
C. Niño con secuelas de polio
OMS
Figura
C. Niño con secuelas de polio
OMS
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
VACUNAS – GENERALIDADES
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Vacunas atenuadas La atenuación usualmente se adquiere con el paso de los virus por un huésped extraño como un huevo embrionado y cultivos de células tisulares. De los muchos virus mutantes que existen en la población (especialmente los virus de ARN), alguno serán seleccionados por tener mayor habilidad para crecer en el huésped extraño (alta virulencia). Estos tienden a ser menos virulentos para el huésped original. Para producir la vacuna Sabin contra el polio, la atenuación fue concebida únicamente con altas inoculaciones y rápido pase por células primarias de monos. La población vírica se convirtió en superpoblada con una cepa menos virulenta (para los humanos) que podría crecer bien en tejidos no-nerviosos (renal) pero no en el sistema nervioso central. Las cepas no virulentas de los tres tipos de polio han sido producidas para la vacuna. Bases moleculares para la atenuación Se desconocen las bases para la atenuación en la mayoría de los casos puesto que la atenuación se concibió empíricamente. Los métodos empíricos de pase celular por tejido extraño causan muchas mutaciones en un virus y es difícil determinas cuáles son las mutaciones importantes. Muchos virus atenuados son sensibles a la temperatura (esto es, crecen mejor a 32-35 grados que a 37 grados) o están adaptados al frío (podrían crecer a temperaturas tan bajas como 25 grados). En la cepa atenuada de la vacuna contra el poliovirus tipo 1, hay 57 cadenas de nucleótidos en el genoma, resultando en 21 cambios de amino ácidos. Un tercio de las mutaciones se dan en el gen VP1 (este gen constituye solo el 12% del genoma). Esto sugiere que la atenuación resulta de cambios en las proteínas de superficie del virus. Recientemente, una vacuna atenuada nasal para la influenza fue desarrollada (vea más adelante). Esta contiene cepas víricas adaptadas al frío que fueron cultivadas en cultivo celular a temperaturas progresivamente menores. Luego de una docena o más de pases, los virus crecen bien solo a temperaturas cercadas a los 25 grados y el cultivo in vivo es restringido al tracto respiratorio superior. Los fabricantes usaron una vacuna trivalente similar a la vacuna que se formula anualmente mediante cepas muertas. Investigaciones demostraron que los episodios de influenza ocurren en solo el 7% de los voluntarios que recibieron la vacuna intra-nasal contra la misma, en comparación con el 13% de los que fueron inyectados con la vacuna trivalente de cepas inactivadas y el 45% de los voluntarios que recibieron placebo. Las comparaciones de ambas vacunas con la cohorte que recibió placebo son estadísticamente significativas. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Figura 8 Anticuerpo secretado (IgA nasal y de la mucosa intestinal) y
anticuerpos sérico (IgG, IgM e IgA séricos) en respuesta a la vacuna de
polio inactivado (izquierda) administrada por inyección intramuscular y
a la vacuna de polio vivo atenuado (derecha) administrado oralmente
Figura 8 Anticuerpo secretado (IgA nasal y de la mucosa intestinal) y
anticuerpos sérico (IgG, IgM e IgA séricos) en respuesta a la vacuna de
polio inactivado (izquierda) administrada por inyección intramuscular y
a la vacuna de polio vivo atenuado (derecha) administrado oralmente |
Ventajas de las vacunas atenuadas
Desventajas de las vacunas atenuadas
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Ventajas de las vacunas inactivadas
Desventajas de las vacunas inactivas
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
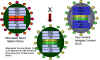 Figura 9 Vacuna contra la influenza con cepas atenuadas usando una
variante mutante sensible al frío que puede ser encasillada con nuevas
cepas virulentas
Figura 9 Vacuna contra la influenza con cepas atenuadas usando una
variante mutante sensible al frío que puede ser encasillada con nuevas
cepas virulentas |
Nuevos métodos de producción de vacunas
1)
Selección por mutación de tipo de cambio de sentido |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2) Péptidos sintéticos Los péptidos inyectados son mucho más pequeños que la proteína vírica original, provocan una respuesta de IgG pero tienen problemas de poca antigenicidad. Esto es porque el epítope puede depender de la conformación del virus como un todo. Un ejemplo no-vírico que ha tenido cierto éxito relativo es el prototipo de la vacuna anti-malaria. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 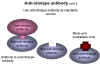 Figura 10 Anticuerpos anti-idiotipo
Figura 10 Anticuerpos anti-idiotipo |
3) Vacunas anti-idiotipo Un sitio de unión de un antígeno en un anticuerpo es un reflejo de parte de la estructura tridimensional del antígeno, esto es de un epítope particular. Esta estructura única de aminoácido en el anticuerpo es conocida como el idiotipo que puede pensarse como un espejo del epítope en el antígeno. Se puede provocar una respuesta de los anticuerpos (anti-ids) contra el idiotipo al inyectar el anticuerpo en otro animal. Esto resulta en un anticuerpo anti-idiotipo y esto, entonces, imita parte de la estructura tridimensional del antígeno, o sea, el epítope (figura 10). Esto puede utilizarse como vacuna. Cuanto el anticuerpo anti-idiotipo se inyecta en un vacunado, se forman anticuerpos (anticuerpos anti – anti-idiotipo) que reconocen una parte estructural similar del virus y podrían potencialmente neutralizarlo. Esto es lo que sucede: Se forman anti-ids en contra de los anticuerpos al antígeno S de la hepatitis B que provocan anticuerpos antivirales. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4) Técnicas de ADN recombinante
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Vacunas de ADN La Revolución de la Tercera Vacuna Estas vacunas son basadas en la introducción deliberada de plásmidos de ADN en los vacunados. El plásmido transporta un gen codificador de proteína que transfecta células in vivo con una eficiencia muy baja y expresa un antígeno que causa una respuesta inmune. Usualmente estas se conocen como vacunas de ADN pero es mejor referirse a ellas como inmunización mediada por ADN o basada en ADN en vista de que el objetivo no es provocar anticuerpos en contra de las moléculas de ADN mismas sino hacer que la proteína sea expresada por las células del vacunado. Generalmente, las células musculares logran esto puesto que el plásmido es administrado intramuscularmente. Ha de hacerse notar que el plásmido no se replica en las células del vacunado, sólo provoca la síntesis de proteína. Las células musculares toman el plásmido de ADN luego de la inyección. Se ha demostrado también que el ADN puede introducirse a los tejidos al bombardear la piel con partículas de oro cubiertas de AND. También es posible introducir ADN al tejido nasal mediante gotas nasales. En el caso del bombardeo de partículas de oro, un nanogramo de oro recubierto con ADN provocó una respuesta. Un microgramo de ADN podría potencialmente introducir un mil genes diferentes en el vacunado.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
FUENTES EN LA RED (en inglés) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Ventajas de las vacunas de ADN
Todo lo anterior significa que las vacunas de ADN son baratas y por tanto es probable que se desarrollen contra patógenos de menor importancia económica (por lo menos del punto de vista de las casas farmacéuticas)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Posibles Inconvenientes
Investigaciones iniciales La mayor parte de las investigaciones han sido dirigidas a vacunas de ADN contra virus dado que la inmunización por plásmidos basada en ADN en realidad simula una infección viral. Cuando han sido bien identificadas, las respuestas inmunes son de carácter amplio e imitan el cuadro visto en una infección normal por el virus homólogo. La respuesta inmune puede ser marcadamente duradera y todavía más luego de la aplicación de una inyección de refuerzo de plásmido. Las respuestas de los linfocitos T citotóxicos también son bien provocadas como es de esperar, dado que el sistema inmune reacciona como cuando una célula es infectada. Una demostración importante que usó una vacuna de AND ha sido la inducción de inmunidad celular citotóxica contra una proteína interna recurrente de la influenza A para determinar si es posible sobrepasar la variación anual (flujo y recambio antigénico) del virus. Los linfocitos T citotóxicos fueron sintetizados en ratas en contra de la nucleoproteína recurrente de la gripe y estos fueron efectivos para proteger las ratas de la enfermedad, aun cuando fueron provocadas con una dosis letal de un virus heterólogo virulento con una hemaglutinina de superficie diferente. Puesto que la transferencia de anticuerpos anti-nucleoproteína a ratas no tratadas no las protegía de la enfermedad, el efecto protector de la vacuna debía de ser mediada por células. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La vacuna actual contra la influenza es una preparación inactivada que contiene antígenos de las cepas de la influenza que se cree que serán las más infecciosas de la temporada. Si dicha predicción resulta errónea, la vacuna no tiene utilidad. Los antígenos de superficie son los que cambian como resultado de una readaptación del virus en su reservorio animal (el pato) (véase las notas de cátedra sobre la influenza). La vacuna se inyecta intramuscularmente y provoca una respuesta IgG (anticuerpo humoral en la circulación). La vacuna protege puesto que suficientes IgG cruzan la mucosa de los pulmones para unirse y neutralizar el virus al unirse a sus antígenos de superficie. Si una vacuna de ADN basada en plásmidos es usada, se producen tanto linfocitos T citotóxicos como humorales, los primeros reconocen antígenos presentados por células plásmido-infectadas. Los linfocitos T citotóxicos se producen porque las células musculares infectadas presentan antígenos de influenza asociados a moléculas del CMH clase I. Si el antígeno es presentado es una proteína de nucleocápside (la cual es una proteína recurrente), se sobrepasara el problema de la variación antigénica. Esto abordaje pudiera revolucionar la vacuna de la influenza. Otros ensayos han empleado una mezcla de plásmidos que codifican tanto la nucleoproteína como los antígenos de superficie. También se ha demostrado la eficacia de las vacunas de ADN con la rabia, micoplasma, y Plasmodium yoelii. En la actualidad se están llevando a cabo ensayos en humanos con la vacuna de ADN de la influenza. También se han probado vacunas anti-VIH. En las cátedras sobre VIH hago alusión al hecho de que el progreso en las vacunas del SIDA ha sido bloqueado por el hecho de que las vacunas actuales solo provocan anticuerpos humorales y que el uso de vacunas virales enteras (las cuales provocan una respuesta de linfocitos T citotóxicos) ha sido rechazado por otros problemas potenciales. Las vacunas basadas en plásmidos podrían sobrepasar estos problemas; de hecho, la actualmente experimental vacuna anti-VIH basada en plásmido si provoca una respuesta de linfocitos T citotóxicos. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Figura11 Enfermedades prevenibles con vacunas, por año de
desarrollo o aprobación de la vacuna – Estados Unidos, 1798-1998
(MMWR/CDC)
Figura11 Enfermedades prevenibles con vacunas, por año de
desarrollo o aprobación de la vacuna – Estados Unidos, 1798-1998
(MMWR/CDC) |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
FUENTES EN LA RED (en inglés)
Baseline 20th century annual morbidity and 1998 provisional morbidity
from nine diseases with vaccines recommended before 1990 for universal
use in children in the United States |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Derechos de autor 2007 The Board of Trustees of the University of South Carolina
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||