|
|
|
|
 |
 |
|
Dr Abdul Ghaffar |
BACTERIOLOGÍA |
INMUNOLOGÍA |
MICOLOGÍA |
PARASITOLOGÍA |
VIROLOGÍA |
|
EN INGLÉS |
BACTERIOLOGIA – CAPITULO DIECISIETE
ZOONOSIS
LISTERIA, FRANCISELLA, BRUCELLA, BACILOS Y
YERSINIA
Dr Abdul Ghaffar
Traducido por : Dr. en C. Paula
Figueroa-Arredondo y M. en C. Ana Laura Luna Torres
|
|
VA EL CAPÍTULO 18 |
E-MAIL
DR PAULA FIGUEROA |
VIDEO LECTURA
EN INGLÉS |
|
|
|
|
|
 Arnold Boecklin: La plaga 1898. Tempera en Madera, Kunstmuseum, Basel
Arnold Boecklin: La plaga 1898. Tempera en Madera, Kunstmuseum, Basel
OBJETIVOS DE ENSEÑANZA
Conocer la morfología general y la fisiología de los microorganismos
Conocer la epidemiología y los síntomas clínicos
Conocer el mecanismo de patogénesis
Conocer el diagnóstico, terapéutica y los procedimientos de prevención
|
El término Zoonosis se refiere a una enfermedad propia de animales, que puede
ser transmitida al humano como resultado del contacto directo ó indirecto con
poblaciones de animales infectados.
Morfología y fisiología
Brucella
es un coco bácilo Gram-negativo que carece de motilidad. Son aerobios
estrictos y crecen muy lentamente (fastidiosos)
en agar sangre. En el huésped, viven como patógenos intracelulares facultativos
Epidemiología, transmisión y sintomatología
La brucelosis es una enfermedad principalmente de animales, afecta
principalmente órganos ricos en el azúcar
eritritol
(mama, útero, epidídimo, etc.). El microorganismo se localiza en estos órganos
del animal y provoca infertilidad, esterilidad,
mastitis,
abortos o bien reside como reservorio. En humanos que tengan contacto directo
con animales infectados (trabajadores de rastros, veterinarios, granjeros,
trabajadores de lecherías) son los que tienen mayor riesgo de desarrollar la fiebre ondulante. Son observados de 100-200 casos de brucelosis en los
Estados Unidos, sin embargo la incidencia a nivel mundial se estima en 500,000
casos.
Se
conocen cuatro especies diferentes de Brucella que infectan al humano: B. abortus (ganado),
B. suis (cerdo), B. melitensis
(cabra/oveja) y B. canis (perro). Sin embargo la brucelosis ha sido
erradicada en muchos países por la vacunación desarrollada en animales, sin
embargo esta persiste en algunos países tanto desarrollados como no
desarrollados.
|
|
|
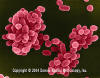 Brucella
abortus - Gram-negativo, coco-bacilo procarionte; ocasiona abortos
espontáneos en bovines debido a su rápido crecimiento con la presencia de
eritritol (producido en la placenta).
SEM x 29,650 ©
Dennis Kunkel Microscopy, Inc.
Utilizado
con el permiso
Brucella
abortus - Gram-negativo, coco-bacilo procarionte; ocasiona abortos
espontáneos en bovines debido a su rápido crecimiento con la presencia de
eritritol (producido en la placenta).
SEM x 29,650 ©
Dennis Kunkel Microscopy, Inc.
Utilizado
con el permiso
 Brucella
spp. se tiñen escasamente, son pequeños coco bácilos gram negativos
(0.5-0.7 x 0.6-1.5 micrómetros), se observan principalmente como células
sencillas y parecen “arena fina“ CDC Brucella
spp. se tiñen escasamente, son pequeños coco bácilos gram negativos
(0.5-0.7 x 0.6-1.5 micrómetros), se observan principalmente como células
sencillas y parecen “arena fina“ CDC
 Brucella
spp. características de las colonias: A. melindroso, por lo general no
es visible a las 24 horas. B. Lento crecimiento en la mayoría de los
medios estándar en el laboratorio (por ejemplo sangre de carnero,
chocolate y agar soya tripticaseína). Exactas, lisas, enteras,
translúcidas, no hemolíticas a 48 horas. CDC
Brucella
spp. características de las colonias: A. melindroso, por lo general no
es visible a las 24 horas. B. Lento crecimiento en la mayoría de los
medios estándar en el laboratorio (por ejemplo sangre de carnero,
chocolate y agar soya tripticaseína). Exactas, lisas, enteras,
translúcidas, no hemolíticas a 48 horas. CDC
 Brucella
ovis en epidídimo © Bristol Biomedical Image Archive, University of Bristol.
Utilizado con el permiso.
Brucella
ovis en epidídimo © Bristol Biomedical Image Archive, University of Bristol.
Utilizado con el permiso. |
La
B. abortus y B. canis causan una infección febril supurativa
moderada mientras que la B. suis ocasiona una infección
supurativa más
severa, la cual puede dar lugar a la destrucción de órganos linfo-reticulares y
del riñón.
B. melitensis
es la causa de la enfermedad más severa, prolongada y recurrente. La bacteria
ingresa al huésped humano a través de las membranas de la mucosa oro-faringea
(rutas de ingestión/inhalación), a través de abrasiones de la piel, ó bien a
través de la conjuntiva. La infección ocurre usualmente por contacto directo con
el material infectado, sin embargo también puede aparecer por la ingesta de
leche y productos lácteos. La bacteria es endocitada por los neutrófilos y los
monocitos que se localizan en los nódulos linfáticos y ahí proliferan
intracelularmente. Si los microorganismos de Brucela no se destruyen o se
eliminan del contenido de los nódulos linfáticos, la bacteria podría ser
liberada en dichos nódulos linfáticos ocasionando septicemia. El microorganismo
migra a otros órganos linfo-reticulares (bazo, médula ósea, hígado, testículos)
produciendo granulomas y/o micro abscesos. Los síntomas incluyen fiebre,
escalofríos, sudores, fatiga, mialgia, debilidad muscular severa y anorexia.
Frecuentemente suceden problemas de inflamación de las articulaciones. La brucelosis
puede bien ser aguda ó crónica. Las fatalidades (0-3%) generalmente ocurren
debido a endocarditis.
Patogénesis
Los síntomas de la brucelosis se deben a la presencia del microorganismo y
aparecen entre 2 - 4 semanas después de la exposición (algunas veces después de
dos meses). Debido a que en el fago-lisosoma, B. abortus libera guanosina-5´
y adenina los cuales son capaces de inhibir la liberación de la peroxidasa
contenida en los gránulos, lo que inhibe el sistema: mieloperoxidasa-peróxido-haluro
que lleva a la muerte bacteriana. La persistencia intracelular de las bacterias
resulta en la formación de granulomas en órganos del sistema retículo endotelial
y daño del tejido debido a las reacciones de hipersensibilidad más del tipo IV.
Diagnóstico
El diagnóstico se basa en la presencia prolongada (al menos una semana) de
fiebre ondulante,
mialgia,
artralgia
y el historial de la exposición a la zoonosis (contacto con animales o consumo
de material no procesado de animales infectados). El diagnóstico definitivo debe
realizarse mediante un hemocultivo de la muestra de sangre del paciente que se
inocula en un en medio enriquecido con sangre. El microorganismo (fastidioso)
crece muy lentamente (4-6 semanas en un cultivo de sangre). B. abortus
pero no otros, Brucella crece mejor en atmósfera de CO2 al 5%.
En agar sangre, produce colonias blancas brillosas. La serología puede ser
utilizada para confirmar el diagnóstico.
Para el tratamiento contra infecciones por
Brucella en humanos, se
recomienda un tratamiento prolongado con rifampicina, un antibiótico que penetra
en las células, conjuntamente con estreptomicina o tetraciclina. Las medidas de
control incluyen la vacunación de los animales y medidas que permitan evitar
contacto con materiales infectados.
|
|
|
|
 Dr.
Alexandre Yersin al frente de National Quarantine Station, Shanghai
Station, 1936
Dr.
Alexandre Yersin al frente de National Quarantine Station, Shanghai
Station, 1936
 Distribución
mundial de la plaga 1998
CDC
Distribución
mundial de la plaga 1998
CDC
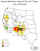 Distribución por estado de la plaga en USA
distribución CDC
Distribución por estado de la plaga en USA
distribución CDC
 Yersinia pestis
– procarionte en forma de bastón (dividiéndose); causante de la plaga
bubónica (SEM x20,800) ©
Dennis Kunkel Microscopy, Inc.
Utilizado con el permiso
Yersinia pestis
– procarionte en forma de bastón (dividiéndose); causante de la plaga
bubónica (SEM x20,800) ©
Dennis Kunkel Microscopy, Inc.
Utilizado con el permiso
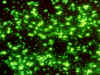 Yersinia pestis. Identificación
con anticuerpos fluorescentes CDC
Yersinia pestis. Identificación
con anticuerpos fluorescentes CDC
|
PLAGA
La plaga es la enfermedad que produce Yersinia pestis, y que se
conocía desde la edad media como la muerte negra. Esto es porque
frecuentemente conduce a gangrenamiento y ennegrecimiento que invade varias
partes del cuerpo. La fragilidad capilar resulta en hemorragias en la piel,
las cuales pueden aparecer como manchas negras.
Yersinia pestis
es un bacilo
pleomórfico,
Gram-negativo, de tinción bipolar, aerobio facultativo que carece de
motilidad. Su temperatura óptima de crecimiento es de 28ºC. Es un parásito
intracelular facultativo.
Epidemiología, transmisión y síntomas
Las tres pandemias documentadas de la plaga (muerte negra) han sido
responsables de la muerte de cientos de millones de personas. En la
actualidad, aún ocurren infecciones esporádicas. En los Estados Unidos, la
plaga animal (selvática)
aparece en estados del oeste, usualmente en pequeños roedores y en
carnívoros, los cuales se alimentan de estos roedores.
Los humanos se infectan por contacto con roedores que traen pulgas o por
contacto con animales infectados. Las pulgas adquieren al microorganismo de Y
pestis cuando se alimentan de la sangre infectada de los roedores. Estos
organismos pierden su cápsula, se multiplican en el tracto intestinal de la
pulga y bloquean parcialmente al proventriculus. Durante la alimentación en el
huésped humano, la pulga regurgita algunos de los microorganismos dentro de
picadura. La mayor parte de los organismos no cápsulados son fagocitados y
destruidos por neutrófilos. Sin embargo, algunos microorganismos son endocitados
por los histiocitos, los cuales son incapaces de eliminarlos y permiten que
re-sinteticen su cápsula y se multipliquen. Al ser liberados de los histiocitos,
los microorganismos encapsulados resisten la fagocitosis y matan a los
neutrófilos. La infección resultante se propaga por el líquido que llega hasta
los nódulos linfáticos, los cuales comienzan a elevar su temperatura, hincharse
y a ponerse muy sensibles con mucho dolor y a presentar hemorragia, dando lugar
a las características bubas negras, de donde se origina el nombre de la
enfermedad: la plaga bubónica. Al cabo de algunas horas el microorganismo se
propaga dentro del bazo, hígado y pulmones, resultando en pneumonía. Mientras
que en la circulación, el microorganismo causa coagulación intra-vascular
difusa, que resulta en trombos intra-vasculares y lesiones púrpuras por todas
partes del cuerpo. Si la infección no es tratada, tiene una alta tasa de
mortalidad (hasta un 90%). El microorganismo se exhala dentro de las gotas
saliva expulsadas durante la la tos, infectando a otros humanos en la proximidad
cercana, causando así la plaga neumónica, la cual es mas difícil de
controlar y tiene una mortalidad del 100%.
Patogénesis
Algunos factores tienen un papel importante directa o indirectamente
en la patogénesis de Y. pestis.
Baja respuesta del calcio (lcr): Este es un plásmido que codifica
genes capaces de crecer en un ambiente con niveles bajos de Ca++ (intracelular).
Coordina también la producción de diversos factores de virulencia, como
las V, W y yops (Proteínas externas de Yersinia).
Proteínas V y W: Estos plásmidos codifican proteínas que están
asociadas con una rápida proliferación y septicemia.
Yops:
Es un grupo de 11 proteínas, las cuales están codificadas en plásmidos,
son esenciales para la patogénesis de roedores y son las responsables de
la citotoxicidad, inhibición de la migración y endocitosis por fagocitos
y de la agregación plaquetaria.
Envoltura antígeno (F-1):
Este es un complejo de lipopolisacárido-proteína es cual es altamente
expresado a 37º en el huésped mamífero, más no
en la pulga y es antifagocítico.
Activador de coagulasa y plasminógeno:
Ambas son proteínas codificadas por plásmidos. La
coagulasa
es responsable de la formación de micro trombos y el activador de
plasminógeno promueve la diseminación del microorganismo. Este destruye
también al C3b de la superficie bacteriana, por lo que atenúa la
fagocitosis.
|
|
LIBRO WEB
Journal del año de
la plaga por Daniel Defoe (1722)ar by Daniel Defoe (1722) |
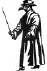
 Ropa de plaga.
El pico era llenado de aceites perfumados y vinagre para
evitar el olor de las victimas de la plaga. Aunque los médicos en 1300 no
conocían el origen de la plaga, las ropas pudieron haber sido efectivas al
menos para mantener alejadas las pulgas y el pico pudo haber sido un
obstáculo para el ingreso de las pulgas.
Izquierda:
Bubonic Plague by Ely Janis
Derecha: © Bristol Biomedical Image Archive, University of Bristol.
Utilizado con el permiso.
Ropa de plaga.
El pico era llenado de aceites perfumados y vinagre para
evitar el olor de las victimas de la plaga. Aunque los médicos en 1300 no
conocían el origen de la plaga, las ropas pudieron haber sido efectivas al
menos para mantener alejadas las pulgas y el pico pudo haber sido un
obstáculo para el ingreso de las pulgas.
Izquierda:
Bubonic Plague by Ely Janis
Derecha: © Bristol Biomedical Image Archive, University of Bristol.
Utilizado con el permiso.
|
Diagnóstico
El diagnóstico se basa en la aparición de las bubas. Se confirma por cultivo
de un aspirado de nódulos linfáticos. Deben garantizarse precauciones
extremas en el manejo del especímen, ya que es altamente infeccioso.
Prevención y tratamiento
La hospitalización y el aislamiento estricto son las reglas a seguir. La
estreptomicina y tetraciclina son altamente efectivas. Una vacuna efectiva
que mata a la bacteria mediante tratamiento con formalina, está disponible
pero se recomienda solo para población de alto riesgo. La enfermedad está
sujeta a cuarentena internacionalmente y el reporte oficial de los casos es
obligatorio. El control de la plaga urbana se fundamenta en el control de la
pulga y los roedores.
|
|
|
 Macho de Xenopsyllas cheopsis (pulga de la rata
oriental) devorando sangre CDC
Macho de Xenopsyllas cheopsis (pulga de la rata
oriental) devorando sangre CDC
 Nódulos linfátcos hinchados (bubas) a causa de la plaga
bubónica CDC
Nódulos linfátcos hinchados (bubas) a causa de la plaga
bubónica CDC
 Tinción de Wayson en Yersinia pestis. Note las característica
apariencia de alfiler de seguridad de bacteria. CDC
Tinción de Wayson en Yersinia pestis. Note las característica
apariencia de alfiler de seguridad de bacteria. CDC
 Síntomas de un paciente con la plaga, incluye un bubón inguinal CDC
Síntomas de un paciente con la plaga, incluye un bubón inguinal CDC
 Histopatología
del bazo debido a la plaga - Necrosis y Yersinia pestis fatal en el
humano.
CDC/Dr. Marshall Fox Histopatología
del bazo debido a la plaga - Necrosis y Yersinia pestis fatal en el
humano.
CDC/Dr. Marshall Fox
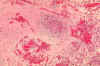 Histopatología de un nódulo linfático en la plaga fatal para
el humano – Necrosis medular con fluidos y Yersinia pestis.
CDC/Dr. Marshall Fox
Histopatología de un nódulo linfático en la plaga fatal para
el humano – Necrosis medular con fluidos y Yersinia pestis.
CDC/Dr. Marshall Fox
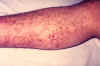 Fragilidad capilar es una de las manifestaciones de la infección por la
plaga, se muestra como evidencia el brazo de una persona infectada. CDC
Fragilidad capilar es una de las manifestaciones de la infección por la
plaga, se muestra como evidencia el brazo de una persona infectada. CDC
 Gangrena es una de las manifestaciones de la plaga y es el origen del
término “muerte negra” dado a la plaga a través de los años CDC
Gangrena es una de las manifestaciones de la plaga y es el origen del
término “muerte negra” dado a la plaga a través de los años CDC
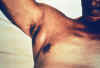 Paciente con la plaga mostrando un nódulo linfático axilar inflamado CDC
Paciente con la plaga mostrando un nódulo linfático axilar inflamado CDC
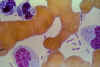 Las tinciones bipolares obscuras de Yersinia pestis pueden observarse
claramente en la tinción de Wright en sangre de una victima de plaga.
Las tinciones bipolares obscuras de Yersinia pestis pueden observarse
claramente en la tinción de Wright en sangre de una victima de plaga.
 Buen crecimiento de Yersinia pestis en un medio de cultivo estándar de
laboratorio, después de 48-72 horas,
Buen crecimiento de Yersinia pestis en un medio de cultivo estándar de
laboratorio, después de 48-72 horas,
crecimiento gris-blanco a ligeramente amarillo y opaco, morfología
irregular, como un “huevo frito”; alternativamente las colonias pueden tener
una superficie brillante descrita como de “cobre martillado “. CDC
|
|
WEB RESOURCES
Questions
and answers about plague from the CDC
|
|
|
 Micrografías originales de Robert Koch del bacilo del antrax
DOD Anthrax Program
Micrografías originales de Robert Koch del bacilo del antrax
DOD Anthrax Program
 Tinción de Gram del bacilo del ántrax.
DOD Anthrax Program
Tinción de Gram del bacilo del ántrax.
DOD Anthrax Program
 Ántrax
debido al Bacillus anthracis (frotis de sangre) © Bristol Biomedical
Image Archive, University of Bristol.
Utilizada con permiso.
Ántrax
debido al Bacillus anthracis (frotis de sangre) © Bristol Biomedical
Image Archive, University of Bristol.
Utilizada con permiso. |
ÁNTRAX
Morfología y fisiología
El Bacillus anthracis es el agente causal del ántrax. Es un bacilo largo
Gram positivo, aeróbio formador de esporas (esporulado). Las esporas se
forman en cultivos, en el suelo, en tejidos y exudados de animales muertos,
pero no en la sangre, o en los tejidos de animales vivos. Las esporas
permanecen viables en la tierra por décadas.
Epidemiología, transmisión y síntomas
El ántrax es una de las principales enfermedades que amenaza a los animales
herbívoros (ganado vacuno, ovejas y en menor grado, caballos, cerdos y
cabras). Inicialmente las personas se infectan por vía cutánea (por contacto
directo con animales enfermos, trabajos de peletería industrial con piel de
animales, madera, contacto con cepillos o brochas o bien por comer tuétanos
de animales infectados); por la vía de inhalación (Enfermedad del
distribuidor de lana), o por la ingesta de carne de animales enfermos.
|
 Antrax cutáneo. DOD Anthrax Program
Antrax cutáneo. DOD Anthrax Program
 Desarrollo de antrax cutáneo. CDC
Desarrollo de antrax cutáneo. CDC
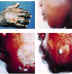 Antrax cutáneo CDC
Antrax cutáneo CDC |
Ántrax cutáneo
representa más del 95% de los casos en humanos. Las esporas entran a través de
alguna fisura de la piel, germinan a células vegetativas, las cuales proliferan
rápidamente en la vía de entrada. En pocos días
emergen pequeñas pápulas que llegan a convertirse en vesículas. Posteriormente
se llenan de líquido azul-negro del edema. La ruptura de esta lesion revelará
una
escara
negra en la base rodeada por una zona de
induración.
Esta
lesión se denomina pústula maligna; sin embargo, no se manifiesta dolor o pus.
La lesión es clásica en las manos, antebrazo o cabeza. La invasión al torrente
sanguíneo podría permitir una diseminación sistémica de la bacteria.
Ántrax pulmonar
resultado de la inhalación de esporas de
B. anthracis
las cuales son
fagocitadas
por los macrófagos alveolares en donde germinan y se replican. La célula huésped
y los organismos dañados infectan los nódulos linfáticos haluro, donde puede
ocurrir una fuerte necrosis hemorrágica. El paciente puede manifestar fiebre,
malestar, mialgia y una tos no productiva. Una vez en el nodo linfático haluro,
la infección puede diseminarse por el torrente sanguíneo. Dificultad
respiratoria y cianosis son las manifestaciones de la toxemia. La muerte puede
ocurrir al término de 24 horas. Esta forma de antrax tiene importancia como arma
biológica.
Ántrax gastrointestinal
resulta de la ingesta de carne proveniente de un animal infectado y conduce la
proliferación bacteriana dentro del tracto gastrointestinal, invasión del
epitelio y ulceración de la mucosa. La invasión se disemina a los nodos
linfáticos mesentéricos y luego a la circulación sanguínea. Inicialmente, existe
vómito y diarrea, seguidos de sangre en las heces. La invasión al torrente
sanguíneo se asocia con una postración profunda, choque y la muerte. Debido a
las medidas muy estrictas de control, ésta forma de ántrax no ha sido vista en
los Estados Unidos.
|
|
Caso de inhalación de
Antrax en Pensilvania - 2006
|
| |
 Lesión cutánea de ántrax en la cara de un hombre CDC
Lesión cutánea de ántrax en la cara de un hombre CDC
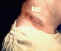 Lesión de antrax cutáneo en el cuello de un hombre CDC
Lesión de antrax cutáneo en el cuello de un hombre CDC
 Hemorragia marcada en la mucosa y sub mucosa con degeneración
arteriolar.
CDC/Dr.
Marshall Fox
Hemorragia marcada en la mucosa y sub mucosa con degeneración
arteriolar.
CDC/Dr.
Marshall Fox
 Histopatología de hígado en un caso fatal de antrax en
humano.
Sinusoides dilatados, infiltración de neutrófilos. CDC/Dr.
Marshall Fox
Histopatología de hígado en un caso fatal de antrax en
humano.
Sinusoides dilatados, infiltración de neutrófilos. CDC/Dr.
Marshall Fox

Paciente femenina de 53 años de edad, empleada por 10 años en el
departamento de procesos de molido en el hilado del pelo de cabra. Lesiones
de ántrax cutáneo el la mejilla derecha; lesiones vistas el día 4. CDC
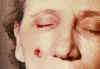
Lesión observada en el día 5 CDC
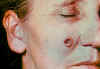
Lesión observada en el día 6. CDC
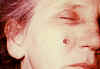
Lesión observada en el día 8. CDC
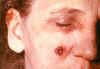
Lesión mostrada en el día 11. CDC
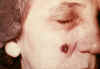
Lesión mostrada en el día 13. CDC
|
| |
| |
|
Cipro
Bayer |
Los factores de virulencia de
B. anthracis incluyen un número de
exotoxinas y la cápsula.
Exotoxina:
Un complejo protéico heterogéneo, lábil al calor, codificado por
plásmido,
que consta de 3 componentes:
(1) Factor Edema (EF)
(2) Factor Letal (LF)
(3) Antígeno Protector (PA).
In vivo,
estos tres factores son sinérgicos (para efectos tóxicos). El antígeno
protector se une a la superficie de los receptores en las células
eucariontes y posteriormente se procesa por una proteasa celular. La
fracción C- terminal larga del PA permanece unida al receptor y luego se
une ya sea EF ó LF, el cual entra a la célula por
endocitosis.
El factor edema EF cuando está dentro de la célula se une a calmodulina y
como actúa como adenilato ciclasa calmodulina-dependiente. El mecanismo de
activación del factor letal (LF) involucra la activación de macrófagos y la
producción de citocinas, las cuales causan necrosis, fiebre, choque y la
muerte. De manera individual, no se les conoce actividad tóxica a ninguna de
las tres proteínas. Los anticuerpos contra los antígenos protectores,
previenen la unión de PA con las células y evitan la entrada de EF y LF.
Cápsula:
La cápsula consiste de un polipéptido de ácido D-glutámico codificado por un
plásmido y no es susceptible de ser fagocitado. No es un buen
inmunógeno,
y aún cuando
se
produzcan anticuerpos, éstos no son protectores contra la enfermedad
Diagnóstico
El diagnóstico clínico del ántrax puede ser confirmado por examen directo de
frotis o por cultivo. Los frotis frescos de fluido vesicular, fluidos
obtenidos de abajo de la escara, sangre, bazo o aspirado de nódulos
linfáticos se fijan y se tiñen con azul de metileno policromático y se
examinan en búsqueda de los característicos bacilos de extremos romos, de
color negro azuloso, con una cápsula de color rosa. En caso de que el
hallazgo sea negativo, la muestra puede cultivarse en placas de agar sangre.
Los microorganismos cultivados se tiñen como bacilos largos Gram-positivos.
La penicilina, la 4-quinolona y el Ciprofloxacín (Cipro),(ver
información en la caja) son los antibióticos de elección. Los
anticuerpos contra el complejo de la toxina son neutralizantes y
protectores. Existen dos vacunas disponibles.
Una es para inmunizar al ganado vacuno y otros animales herbívoros y la otra
para humanos |
|
TUTORIAL WEB
Patología del ántrax por inhalación
Armed Forces Institute of Pathology
|
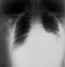 Mediastino ensanchado y efusión pleural por inhalación de ántrax en
radiografía de tórax CDC
Mediastino ensanchado y efusión pleural por inhalación de ántrax en
radiografía de tórax CDC
|
 Ántrax, coágulo de sangre que pasó a través del ano. ©
Bristol Biomedical Image Archive, University of Bristol.
Utilizada con el permiso.
Ántrax, coágulo de sangre que pasó a través del ano. ©
Bristol Biomedical Image Archive, University of Bristol.
Utilizada con el permiso. |
 Infección de macrófagos o de células de parénquima por
Listeria monocitogenes
Infección de macrófagos o de células de parénquima por
Listeria monocitogenes
 Listeria monocitogenes
– procarionte en forma de bastón, agente que causal la
listeriosis, la meningitis y el envenenamiento por alimentos
contaminados. ©
Dennis Kunkel Microscopy, Inc.
Utilizada con permiso.
Listeria monocitogenes
– procarionte en forma de bastón, agente que causal la
listeriosis, la meningitis y el envenenamiento por alimentos
contaminados. ©
Dennis Kunkel Microscopy, Inc.
Utilizada con permiso.
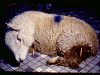 Oveja viva con listeriosis © Bristol
Biomedical Image Archive, University of Bristol. Utilizada con permiso.
Oveja viva con listeriosis © Bristol
Biomedical Image Archive, University of Bristol. Utilizada con permiso.
 Microorganismo Listeria monocytogenes en un neutrófilo (frotis de sangre
) © Bristol Biomedical Image Archive, University of Bristol. Utilizada
con el permiso.
Microorganismo Listeria monocytogenes en un neutrófilo (frotis de sangre
) © Bristol Biomedical Image Archive, University of Bristol. Utilizada
con el permiso.
 Electron micrograph of a flagellated Listeria monocytogenes bacterium, Magnified
41,250X
Electron micrograph of a flagellated Listeria monocytogenes bacterium, Magnified
41,250X
CDC/Dr. Balasubr Swaminathan; Peggy Hayes; Elizabeth White
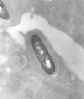 Micrografía electrónica de un flagelo de la bacteria Listeria
monocytogenes amplificado 41,250X
Micrografía electrónica de un flagelo de la bacteria Listeria
monocytogenes amplificado 41,250X
CDC/Dr. Balasubr Swaminathan; Peggy Hayes; Elizabeth White
|
LISTERIOSIS
Morfología y Fisiología
L. monocytogenes, es un micrororganismo coco bacilo Gram-positivo
intracelular facultativo, que crece frecuentemente en forma de cadenas cortas.
Es diferente de otros Gram-positivos, debido a que contiene una molécula,
química y biológicamente similar al lipopolisacárido clásico: el LPS “listerial”.
El microorganismo forma colonias beta hemolíticas en placas de agar sangre y
colonias translúcidas de color azul-verde en medios sólidos sin colorantes.
Desde que se infecta la célula (macrófagos y células del parénquima), el
microorganismo escapa de las vacuolas del huésped (o fagosoma) y lleva a cabo
una rápida división en el citoplasma de la célula huésped, antes de llegar a ser
encapsulada por filamentos cortos de actina. Mediante la reorganización de
dichos filamentos, se forma una larga cauda de actina que comienza y se extiende
desde un solo extremo de la bacteria, impulsandola hacia el otro extremo. La
cauda es la mediadora de los movimientos con los que el microorganismo se
desplaza a través del citoplasma, cruzándolo hasta alcanzar la superficie de la
célula huésped. En la periferia de la célula, se forman protuberancias que
pueden penetrar hacia las células vecinas y de este modo permitir que la
bacteria las invada. Debido a este modo de transmisión de célula a célula, el
microorganismo nunca esta expuesto de manera extracelular a los agentes
antibacterianos humorales (por ejemplo, complemento, anticuerpos). L.
monocytogenes se elimina solamente mediante los macrófagos activados.
Epidemiología y síntomas
Listeria monocytogenes es un microorganismo ubicuo que se encuentra en el
suelo, en vegetación, agua, y en el tracto gastrointestinal de animales. La
exposición al microorganismo puede generar abortos o bien la enfermedad
asintomática en humanos. El mas alto riesgo de esta enfermedad lo corren,
principalmente el feto, los neonatos, los pacientes con cáncer e individuos
inmuno-comprometidos. En los Estados Unidos, un número reciente de brotes
han señalado como fuentes de contaminación de humanos a quesos, ensalada de
col (col), leche y carne. El microorganismo puede crecer a 4ºC, lo que
significa que se puede replicar continuamente en la comida refrigerada. Para
el aislamiento en el laboratorio pueden emplearse técnicas de
enriquecimiento en frío.
La listeriosis ha sido clasificada en dos formas: 1) enfermedad neonatal y
2) enfermedad del adulto.
Enfermedad neonatal: la enfermedad neonatal puede suceder
en dos formas: el inicio temprano de la enfermedad, la cual se adquiere in utero
a través de la placenta y la enfermedad del inicio tardío, esta se adquiere
durante o después del nacimiento. La infección adquirida In utero (infantiséptica
granulomatosa) causa abscesos y granulomas en órganos múltiples y frecuentemente
resulta en un aborto. La exposición a través de la vagina da lugar a la
enfermedad de inicio tardío que resulta en meningitis o meningoencefalitis con
sépsis en el termino de 2 a 3 semanas.
Enfermedad del adulto: La infección en adultos normales,
da lugar a una espécie como de gripe con auto-resolución y/o disturbios
gastrointestinales leves. La fiebre y los escalofríos se deben a la bacteremia.
En individuos inmunosuprimidos esto puede producir una enfermedad grave, que
conduce a la meningitis. Es una de las causas que conducen a meningitis
bacteriana en pacientes con cáncer o en los receptores de transplante renal. En
los ancianos, los síntomas tempranos pueden pasar inadvertidos y la infección
puede conducir a manifestaciones agudas de sepsis (fiebre elevada, hipotensión).
Una complicación de la bacteremia es la endocarditis.
Patogénesis
La listeriolisina O, una β-hemolisina, relacionada con la estreptolisina y la
pneumolisina, es una toxina que producen las cepas virulentas. Con ella causa
daño a la vacuola fagocítica, escapando de ella y por lo tanto es un instrumento
para la transmisión célula-célula del microorganismo. La toxina es inmunogénica
y lábil frente al oxígeno.
Diagnóstico
La listeriosis se diagnostica cuando se observa monocitosis sangre y de fluido
cerebro espinal. El microorganismo se puede aislar en la mayoría de los medios
de cultivo de laboratorio.
Tratamiento y control
Los tratamientos con penicilina (ampicilina) por sí sola o en combinación con
gentamicina han sido efectivos. La inmunidad es mediada por células.
|
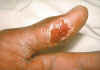 Dedo pulgar con úlcera cutánea de tularemia.
CDC/Emory U./Dr. Sellers
Dedo pulgar con úlcera cutánea de tularemia.
CDC/Emory U./Dr. Sellers
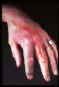
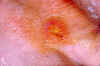 Lesión de tularemia en la piel del dorso de la mano derecha. CDC/Dr.
Brachman
Lesión de tularemia en la piel del dorso de la mano derecha. CDC/Dr.
Brachman
 Bacteria Francisella tularensis teñida con azul de metileno CDC/Dr. P. B.
Smith
Bacteria Francisella tularensis teñida con azul de metileno CDC/Dr. P. B.
Smith
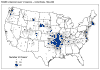 Reporte de casos de tularemia en
los Estados Unidos 1990-2000 CDC
Reporte de casos de tularemia en
los Estados Unidos 1990-2000 CDC
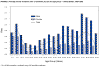 Tasa de incidencia anual de tularemia grupos por edades y género-
Estados Unidos 1990-2000
CDC
Tasa de incidencia anual de tularemia grupos por edades y género-
Estados Unidos 1990-2000
CDC
|
TULAREMIA
Morfología y Fisiología
La Francisella tularensis es un coco bacilo pequeño, Gram negativo, inmóvil,
encapsulado y pleomórfico (filamento corto). Es un parásito intracelular
facultativo, crece mal o de forma pobre en la mayoría de los medios de cultivo
de laboratorio, requiere de agar sangre especial, glucosa y cisteína para su
aislamiento. La manipulación de la muestra debe realizarse con precaución debido
a que tiene una dosis infecciosa baja.
Epidemiología y Síntomas
La Francisella tularensis es el agente causal de la Tularemia (enfermedad
obligatoriamente reportable en los Estados Unidos). A diferencia de la plaga, la
Tularemia aparece rutinariamente en los 50 estados que componen a los Estados
Unidos. Los reservorios primarios son los conejos, liebres y garrapatas. El
hombre adquiere la tularemia por picadura/mordedura de insectos (primariamente
garrapatas, pero también venados, ácaros, moscas negras, o bien mosquitos) o
durante la manipulación ocupacional de los tejidos de animales infectados. La
enfermedad en el humano (fiebre del conejo ó de la mosca del venado) se
caracteriza por una ulceración focal que se inicia en el sitio de entrada del
microorganismo y que se amplía hacia los nódulos linfáticos regionales.
Un inóculo tan pequeño como entre 10 a 50 bácilos causaran la enfermedad en el
humano, si estos son inhalados o introducidos de forma intradérmica, mientras
que para una infección vía oral se requiere de un inóculo grande (~108
microorganismos). El periodo de incubación es de 3 a 10 días. En el sitio de
entrada se presenta una pequeña pápula en la piel. La ulceración se acompaña de
fiebre, escalofríos, malestar, fatiga y generalmente linfadenopatía.
Generalmente se presenta bacteremia y luego el bacilo crece intracelularmente en
el sistema retículo endotelial. La diseminación del microorganismo a través de
la circulación sanguínea permite que se desarrollen lesiones focales en
numerosos órganos de la economía. Normalmente el paciente podría mostrar uno de
los síndromes clínicos más severos. La forma ulcero glandular es una de las más
comunes (70-85%) en la cual aparece una pápula ulcerada dolorosa con un centro
necrótico y una periferia levantada, que se presenta como el sitio de infección.
Otras formas son glandulares (linfo adenopatía libre de úlcera) pneumónica,
tifoidal, ocuglandular, y raramente orofaringea (faringotonsilitis con
linfodenopatía).
Patogénesis
La cápsula del microorganismo lo hace resistente a la fagocitosis.
Intracelularmente, el microorganismo resiste a morir por fagocitosis y se
multiplica. La mayor parte de los síntomas se deben a una hipersensibilidad
mediada por células.
Diagnóstico
El F. tularensis es difícil de visualizar en manchas directas. El microorganismo
puede ser aislado del esputo, o del aspirado inoculado de nódulos linfáticos en
agar sangre chocolate. Los cultivos en agar sangre son frecuentemente negativos.
El microorganismo crece lentamente por lo cual se debe de incubar por varios
días. La identificación del microorganismo se confirma con antisuero específico.
Prevención y Tratamiento
La estreptomicina es el fármaco de elección para todas las formas de tularemia.
En los pacientes sin tratamiento, los casos tienen una tasa de fatalidad del
5-15%. Está disponible una vacuna preparada con el microorganismo vivo atenuado
pero su uso se restringe solamente a las personas bajo un alto riesgo de
contraer la enfermedad. La inmunidad parece estar mediada por células. Se debe
evitar la manipulación de animales infectados, evitar cuidadosamente las
garrapatas y utilizar fuentes de agua sanitizada.
|
|
CDC
FAQ - Tularemia |
 Erisipela- infección aguda pero de lento desarrollo en la piel originada por
un bacilo Gram positivo (Erysipelothrix rhusiopathiae).
©
Mount Allison Science Image Collection
Erisipela- infección aguda pero de lento desarrollo en la piel originada por
un bacilo Gram positivo (Erysipelothrix rhusiopathiae).
©
Mount Allison Science Image Collection |
ERISIPELOSIS
Esta en una enfermedad ocupacional de los carniceros, procesadores de carne,
granjeros, trabajadores de aves de corral, manipuladores de pescado: los que
trabajan con cerdo y pescado presentan mas alto riesgo. El agente causal de esta
enfermedad es Erysipelothrix rhusiopathiae, es un bacilo Gram positivo,
anaeróbico, el cual infecta a través de abrasiones de la piel al manipular
productos de origen animal y suelos contaminados. Generalmente, el
microorganismo produce una lesión inflamatoria de color
violáceo
en la piel y dedos
de la mano, que
presenta un borde levantado. La lesión se extiende
hacia su
periferia y se
observa decoloración del área central. La lesión
es
dolorosa,
pruritica y causa
una sensación de palpitación o una sensación de ardor o que se quema la piel.
La lesión no es supurativa
y es por tanto distinguible de
erisipela estafilocócica. La infección cutánea difusa y la septicemia por
erisipelosis son raras. El microorganismo se cultiva fácilmente en la mayoría de
los medios de laboratorio. Es fácilmente tratable con penicilina.
|
|
|
 Regreso
a la Sección de Bacteriología de Microbiología e Immunología On-line Regreso
a la Sección de Bacteriología de Microbiología e Immunología On-line
Favor de reportar cualquier problema al
Richard Hunt
|

 Brucella
abortus - Gram-negativo, coco-bacilo procarionte; ocasiona abortos
espontáneos en bovines debido a su rápido crecimiento con la presencia de
eritritol (producido en la placenta).
SEM x 29,650 ©
Dennis Kunkel Microscopy, Inc.
Utilizado
con el permiso
Brucella
abortus - Gram-negativo, coco-bacilo procarionte; ocasiona abortos
espontáneos en bovines debido a su rápido crecimiento con la presencia de
eritritol (producido en la placenta).
SEM x 29,650 ©
Dennis Kunkel Microscopy, Inc.
Utilizado
con el permiso Ropa de plaga.
El pico era llenado de aceites perfumados y vinagre para
evitar el olor de las victimas de la plaga. Aunque los médicos en 1300 no
conocían el origen de la plaga, las ropas pudieron haber sido efectivas al
menos para mantener alejadas las pulgas y el pico pudo haber sido un
obstáculo para el ingreso de las pulgas.
Izquierda:
Bubonic Plague by Ely Janis
Derecha: © Bristol Biomedical Image Archive, University of Bristol.
Utilizado con el permiso.
Ropa de plaga.
El pico era llenado de aceites perfumados y vinagre para
evitar el olor de las victimas de la plaga. Aunque los médicos en 1300 no
conocían el origen de la plaga, las ropas pudieron haber sido efectivas al
menos para mantener alejadas las pulgas y el pico pudo haber sido un
obstáculo para el ingreso de las pulgas.
Izquierda:
Bubonic Plague by Ely Janis
Derecha: © Bristol Biomedical Image Archive, University of Bristol.
Utilizado con el permiso.
 Macho de Xenopsyllas cheopsis (pulga de la rata
oriental) devorando sangre CDC
Macho de Xenopsyllas cheopsis (pulga de la rata
oriental) devorando sangre CDC
 Tinción de Wayson en Yersinia pestis. Note las característica
apariencia de alfiler de seguridad de bacteria. CDC
Tinción de Wayson en Yersinia pestis. Note las característica
apariencia de alfiler de seguridad de bacteria. CDC Histopatología
del bazo debido a la plaga - Necrosis y Yersinia pestis fatal en el
humano.
CDC/Dr. Marshall Fox
Histopatología
del bazo debido a la plaga - Necrosis y Yersinia pestis fatal en el
humano.
CDC/Dr. Marshall Fox
 Fragilidad capilar es una de las manifestaciones de la infección por la
plaga, se muestra como evidencia el brazo de una persona infectada. CDC
Fragilidad capilar es una de las manifestaciones de la infección por la
plaga, se muestra como evidencia el brazo de una persona infectada. CDC Paciente con la plaga mostrando un nódulo linfático axilar inflamado CDC
Paciente con la plaga mostrando un nódulo linfático axilar inflamado CDC Buen crecimiento de Yersinia pestis en un medio de cultivo estándar de
laboratorio, después de 48-72 horas,
Buen crecimiento de Yersinia pestis en un medio de cultivo estándar de
laboratorio, después de 48-72 horas,  Antrax cutáneo. DOD Anthrax Program
Antrax cutáneo. DOD Anthrax Program
 Lesión cutánea de ántrax en la cara de un hombre CDC
Lesión cutánea de ántrax en la cara de un hombre CDC

 Mediastino ensanchado y efusión pleural por inhalación de ántrax en
radiografía de tórax CDC
Mediastino ensanchado y efusión pleural por inhalación de ántrax en
radiografía de tórax CDC
 Ántrax, coágulo de sangre que pasó a través del ano. ©
Bristol Biomedical Image Archive, University of Bristol.
Utilizada con el permiso.
Ántrax, coágulo de sangre que pasó a través del ano. ©
Bristol Biomedical Image Archive, University of Bristol.
Utilizada con el permiso.  Infección de macrófagos o de células de parénquima por
Listeria monocitogenes
Infección de macrófagos o de células de parénquima por
Listeria monocitogenes
 Dedo pulgar con úlcera cutánea de tularemia.
CDC/Emory U./Dr. Sellers
Dedo pulgar con úlcera cutánea de tularemia.
CDC/Emory U./Dr. Sellers
 Erisipela- infección aguda pero de lento desarrollo en la piel originada por
un bacilo Gram positivo (Erysipelothrix rhusiopathiae).
©
Mount Allison Science Image Collection
Erisipela- infección aguda pero de lento desarrollo en la piel originada por
un bacilo Gram positivo (Erysipelothrix rhusiopathiae).
©
Mount Allison Science Image Collection





























