 Bu ince kesitli transmisyon elektron mikrografisi (TEM) "İnsan İmmun
yetmezliği virüsü"(HIV) virüs partiküllerinin veya virionların, bir dizi
ince yapı detaylarını göstermektedir
Bu ince kesitli transmisyon elektron mikrografisi (TEM) "İnsan İmmun
yetmezliği virüsü"(HIV) virüs partiküllerinin veya virionların, bir dizi
ince yapı detaylarını göstermektedir
CDC/ Dr. A. Harrison; Dr. P. Feorino
 HIV'in elektron mikrografisidir (büyütmek
için tıklayın) - Koni şeklindeki çekirdekler çeşitli yönlerde kesitli. Viral
genomik RNA kor bölgesinin elektron-yoğun
geniş ucunda bulunmaktadır. CDC/Dr. Edwin P. Ewing, Jr. epe1@cdc.gov
HIV'in elektron mikrografisidir (büyütmek
için tıklayın) - Koni şeklindeki çekirdekler çeşitli yönlerde kesitli. Viral
genomik RNA kor bölgesinin elektron-yoğun
geniş ucunda bulunmaktadır. CDC/Dr. Edwin P. Ewing, Jr. epe1@cdc.gov
 HIV protein konumları şeması
HIV protein konumları şeması
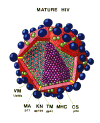
HIV'in Kesit şeması. From Dr. Milan V.Nermut of the
National Institute for Biological Standards and Control. Herts, U.K.
Computer graphics by A.Davies
Şekil 14 - HIV yapısı
 Şekil 14a
Şekil 14a
gag geni
 Şekil 24A
Şekil 24A
HIV-1 genomu
 Şekil 24B
Şekil 24B
gp160nin yapısı.
A. gp160 doğrusal domain yapısı üst kısmında gösterilir. Gp160 gp120 (yüzey
protein) ve gp41 (transmembran füzyon proteini) halinde bölünür.
B. gp120/gp41 trimeri viral membranla birliktedir.
C. Gp120 çok sayıda hipervariable domain (V1-V5) içerir. kırmızı çubuklar
disülfid köprüleri göstermektedir
|
VIRUSUN YAPISI HIV, diğer
retrovirüslere benzer yapıya sahip retrovirüstür (onkojenik virüslere bakınız).
YÜZEY YAPISI
Viral membran
Membran hücre yüzeyinden tomurcuklanmanın bir sonucu olarak konaktan
türetilir (Şekil 15). Bazı konak proteinler viral membrane dahil olur. Bu
lipit zarf organik çözücülere duyarlı virüs haline getirir.
Yüzey glikoproteini
Gp160 env (zarf) geni tarafından kodlanır. Gp160 gp120 (SU) ve gp41 (TM)
oluşturmak için Golgi cisimciğinde konak enzimler tarafından çeviri sonrası
bölünür. Gp41 zar içine gömülüdür, gp120 böyle değildir ama kovalent olmayan
etkileşimleri ile, gp41'e tutunur (Şekil 14). gp120'de şeker zincirleri çok
sayıda vardır (Bir aşı için bir sorun teşkil edebilir). Gp120 hücre üzerinde
bir reseptör ile enfekte edilmesi ile etkileşen bir proteindir. Gp41, gp120
hücreye bağlanmasından sonra maruz kalınan fusogendir.
İÇ YAPISI
İç Yapı proteinleri
Bunlar gag (grup spesifik antijen) geni tarafından kodlanır (Şekil 14a). P17
matriks (MA) protein hatları viral membran iç yüzeyi, bu da kovalent bağlı
miristik asit ile bağlanmıştır. Diğer proteinler nükleokapsid ile
ilişkilidir. Grup spesifik antijen, bir poliprotein olarak yapılır ve pol
geni tarafından kodlanan viral olarak kodlanmış bir proteaz tarafından virüs
tomurcuklanmasından sonra ya da sırasında ayrılır.
Diğer iç proteinler
Bu pol (polimeraz) geni tarafından kodlanır. Entegrasyon ve replikasyon
katılan enzimler şunlardır:
- Reverse transkriptaz - RNA genomu çift sarmallı DNA'ya kopyalar.
Aynı zamanda, bu yaran polimerizasyon ilk tur sonrasında oluşturulan RNA
/ DNA hibritinden RNA'yı ayıran, RNase H aktivitesini içermektedir.
- İntegraz - konak hücre kromozomuna iki iplikçikli DNA'yı entegre
eder
- Proteaz - pol ve gag-kodlanmış poliproteinlerini parçalar.
Retrovirüs yapısı ve replikasyonu hakkında daha fazla bilgi için,
onkojenik virüsler bakınız
Genom
Diğer retrovirüslere gibi, genom diploid pozitif sense RNA
HIV Rous sarkoma virüsü (RSV) gibi basit retrovirüsler daha karmaşık bir
yaşam döngüsüne sahip, ve HIV'in daha karmaşık bir şekilde replikasyonunu
kontrol edebildiği görünüyor olduğundan, daha genetik bilgi bekliyor
olabiliriz ama bu böyle değildir. HIV genomu yaklaşık 9749 nükleotittir
diğer retrovirüsler aynı boyutta örnek RSV.
HIV genomu, küçük proteinler için açıkça kodlayan ekstra açık okuma
çerçevelerine sahip ancak RSV'den daha karmaşıktır (Şekil 24a). Bu küçük
proteinlerine karşı olan antikorlar, HIV ile enfekte olmuş insanlarda
bulunurlar. Bunlardan bazıları protein sentezini kontrol proteinleridir.
HIV genomu dokuz açık okuma çerçevelerini (dokuz primer çeviri ürünlere
yol açan) sahiptir ancak 15 protein birincil ürünlerin üçe bölünmesi sonucu
tümünden yapılır.
Daha önce gördüğümüz gibi, GAG geni ve GAG -POL genleri birlikte daha
sonra POL poliproteininin parçası olan virüs kodlamış proteaz tarafından
bölünen büyük poliproteinlerinden çevrilmektedir.
GAG poliprotein olgun virüste bulunan dört proteine bölünmektedir: MA (matriks),
CA (kapsid), NC (nükleokapsit), p6.
POL poliprotein üç proteine ayrılır: PR (proteaz), RT (reverz transkriptaz), IN
(integraz)
Env geni bir poliproteine (gp 160) çevrilmiştir sonra, golgi cisimciğinde
bulunan bir konak hücre proteaz (bir furin olarak da adlandırılır) tarafından
bölünür. Bu virüs kodlamış bir proteaz değildir. Gp160 ise SU (gp120) ile TM
(gp41) bölünmektedir. Gp120 kovalent olmayan bağlar ile gp41 bağlı kalır iken
ikincisi gp160'ın zar kısmını korur.
Gag, pol ve env'den türetilmiş dokuz proteine ek olarak, HIV
tarafından yapılan altı protein vardır. Diğerleri olgun virüsda bulunmaz iken bu
üçü (Vif, VPR ve Nef), virüs içine dahil edilmiştir: Tat ve Rev düzenleyici
protein ve Vpu'nun birleşmede dolaylı yardımı vardır. Bu proteinleri kodlayan
genler, aşağıda üç harfli adlarıyla bilinir:
TAT: Trans-Aktivator of Transkripsiyon
REV: Regulator of Virion protein ekspresyon
NEF: Negatif Regulatör Faktor
VIF: Virion Infektivity Faktor
VPU: Viral Protein U
VPR: Viral Protein R
Bu genler, küçük proteinleri kodlayan; TAT, örneğin, 88
aminoasitten oluşur. Bunlar, yapısal genler (özellikle ENV) ile üst üste ancak
farklı okuma çerçevesi vardır. Şekil 24'te gösterilen HIV gen organizasyonundan,
bazıları (yapısal olmayan genler) birden fazla eksonda kodlanır ve bu nedenle de
mRNA'lar, yapısal proteinler için mRNA alternatif birleşme yolu ile elde
edilebilir olduğu görülebilir. TAT ve REV genlerinde mutantlar her iki proteinin
de, virüs üretimi için gerekli olduğunu göstermektedir.
|
|
|
REV
REV yapısal proteinler (gag / pol / ENV) için sadece mRNA'da bir
elemana bağlanır ve yapısal -yapısal olmayan oranını kontrol proteini (TAT /
REV) sentezini düzenler. REV seviyeleri yüksek olduğunda, yapısal protein
sentezi artar ve yapısal olmayan, kontrol proteinlerin sentezi düşer. Böylece,
REV hem kendi ve TAT'in üretimini inhibe eder.
Normal sonuç homeostaz, istirahat CD4 hücrelerinde latentlik ve
düşük veya olmayan virüs üretimidir.
Görüldüğü gibi, HIV'in yaşam tarzında içsel sorun var. O haberci
RNA olarak genomik RNA kullanır. Bu RNA eklenmemiş ve çekirdek tercüme edilmiş
ve çekirdekten ayrılan eklenmemiş mRNA'ları önlemek için bir mekanizmaya
sahiptir. Bu sorunun üstesinden gelmek, REV'in fonksiyonudur.
|

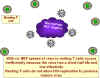
 Şekil 25 CD4e NEFin etkileri
Şekil 25 CD4e NEFin etkileri
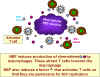 Şekil 26 NEF, infekte bir makrofaja T hücrelerini çeken sitokinleri uyarır
Şekil 26 NEF, infekte bir makrofaja T hücrelerini çeken sitokinleri uyarır
|
NEF
Nef proteini Enfeksiyonda erken sentezlenir. Küçük boyutuna
rağmen, NEF çeşitli işlevleri vardır.
-
diğer HIV parçacıklar tarafından süper-enfeksiyon
enfekte hücrenin yüzey CD4 antijenine bağlanma hücreyi öldürebilir
-
muhtemelen daha önemlisi hücre yüzeyinde CD4 antijen ya
da hücre yüzeyinde CD4 antijene bağlanan serbest gp120 aracılığı ile
bağlı olan virüs, hücreye bir immün saldırı oluşmasına neden olabilir ve
enfeksiyonlu hücre tahrip edilebilir.
İlk enfekte virüs sonucu NEF genin translasyonu hücre
yüzeyinde CD4 antijeninin içselleşmesine ve lizozomlarda tahribatına yol
açar (Şekil 25). Bu nedenle daha fazla, HIV veya gp120 infekte olmuş bir
hücrenin yüzeyine bağlanamaz!
-
CD4 antijeninin aşağı regülasyonu farklı bir mekanizma ile,
NEF MHC sınıf I moleküllerinin yüzey ifadesini azaltır. Bu enfekte olmuş
hücre tarafından antijen sunumunu değiştirir ve sitotoksik T-hücreleri
tarafından saldırıdan enfekte olmuş hücreyi korumak için önerilmiştir
-
NEF ismi negatif faktörden geliyor. Başlangıçta, bu NEF
yoksun viryonlar vahşi tipten daha iyi çoğaldığı göründü. Şimdi tersi için
ortak sonuç NEF varlığında üretilen virüs, yokluğunda üretilen virüstan
biraz daha fazla bulaşıcıdır.
-
NEF vivo HIV replikasyonu için önemlidir, ancak in vitro
hücre kültürü durumunda NEF'in çok az etkisi var gibi görünüyor. Bu uzun
süre karanlık kalmıştır. Son zamanlarda, bu soru çözülmüş gibi görünüyor.
Cevap, NEF-sentezleyen HIV ile enfekte olduğunda bunların salgı
özelliklerini değiştirebilen makrofajlarda bulunmuştur (makrofajlar vücuda
HIV getiren hücrelerdir ve enfekte olmuş bir hastada HIV başlangıç suşları
makrofaj-tropik olduğunu hatırlayalım).
-
NEF eksprese eden HIV enfekte makrofajlar MIP-1 alfa ve
MIP-1 beta salgılar. Makrofajların HIV enfeksiyonu için
ko-reseptörlerine bağlanan iki kemokini vardır, ancak burada başka
işlevi vardır. Onlar enfekte makrofajlardan istirahattr CD4 + T
hücrelere doğru (kemotaksisini) göçüne neden olur (Şekil 26).
Başlangıçta, HIV enfeksiyonlu hücreler çok sayıda değildir ve enfekte
edilmemiş T hücreleri enfekte olmuş hücrelerde çok yakın olmadığından bu
in vivo olarak önemlidir. Ayrıca, HIV bulaşıcı olmayan hale gelmeden
önce dolaşımda çok uzun bir yarı ömre sahip değildir. Enfekte hücrelere
karşı enfekte olmamış hücrelerin göçü onlar retiküloendotelial sistemi
ayrılmadan önce T hücreleri enfekte makrofajlar ile karşılaşma
olasılığını artırır. NEF hücrelerin zaten birbirine yakın olan hücre
kültüründe çok etkili olmamasını açıklıyor. Onlar enfekte makrofajlardan
istirahattr CD4 + T hücrelere doğru (kemotaksisini) göçüne neden olur (Şekil
26). Başlangıçta, HIV enfeksiyonlu hücreler çok sayıda değildir ve
enfekte edilmemiş T hücreleri enfekte olmuş hücrelerde çok yakın
olmadığından bu in vivo olarak önemlidir. Ayrıca, HIV bulaşıcı olmayan
hale gelmeden önce dolaşımda çok uzun bir yarı ömre sahip değildir.
Enfekte hücrelere karşı enfekte olmamış hücrelerin göçü onlar
retiküloendotelial sistemi ayrılmadan önce T hücreleri enfekte
makrofajlar ile karşılaşma olasılığını artırır. NEF hücrelerin zaten
birbirine yakın olan hücre kültüründe çok etkili olmamasını açıklıyor.
-
NEF eksprese eden HIV ile enfekte makrofajlar başka bir
şey yapar. istirahatteki T hücrelerini aktive ederek T hücrelerine
produktif enfekte ve yeni virüs dökmesini sağlayan henüz tespit
edilmemiş bir çekim faktörü yaparlar.
Makrofajların HIV yayılımı için neden hayati önem taşıdığını
bu bulgular açıklar.
Unutmayın, In vivo olarak HIV istirahat T hücrelerini
enfekte edebilir ancak hücre içinde replike olamaz . NEF hücreyi
etkinleştirmesine rağmen bu istirahat T hücresinde yapılamaz. Yukarıdaki
gözlemler, bu muammanın çözümü. Makrofajlar HIV ile enfekte ve herhangi bir
aktivasyon işlemi yapmadan NEF yaparlar. Bunun bir sonucu olarak, şimdi, bir
üretken enfeksiyonunu destekleyebilen istirahat T hücrelerini aktive eden
faktörler yaparlar!
|
|
|
VPU
T hücresinin aktivasyonu sonrası, virüs başka sorunla karşı
karşıya: CD4 antijeni ve gp120 aynı hücrenin endoplazmik retikulumda yapılıyor.
Bunların plazma membranına ulaşmadan önce birbirine bağlanma olasıdır ve bu
kompleksler genellikle indirgenmesi için hücre tarafından hedeflenir. Yapıldığı
gibi işlerin bu talihsiz durumunu durdurmak için, küçük HIV proteinlerinin bir
diğeri VPU, konak hücrenin CD4 antijeninin proteolizini destekler!
VPU aynı zamanda konak hücreden viral partikül salınmasını
artırır. Bunun nasıl olduğu açık değildir, ancak VPU konak hücrenin plazma
membranında bir iyon kanalını oluşturur ve Na + ve K + gibi küçük iyonlarını
ilettiğinden sitoplazma iyonik bileşimini değiştirebilir. Aynı zamanda, bir
hücresel proteine (VPU bağlama proteini veya UBP) bağlanır ve bu proteinin aşırı
ifadesi virüs salınımına VPU'nun artırıcı etkisini azaltır. UBP virüs hücre
yüzeyinde birleşmeden önce GAG proteinlerden birinin yerinden edilmesini
gerektiren birleşme için olumsuz bir faktör olabilir.
CD4 antijeni (VPU molekülünün farklı bölgelerinde farklı
işlevleri olan) yıkma ve viral salınmayı uyarma yeteneğinden VPU, hücre başına
HIV partiküllerinin sayısını artırarak virüsün patojenik etkisini arttırır gibi
görünmektedir.
VIF
In vivo enfeksiyon için gerekli olan VIF (viral enfeksiyon
faktörü) proteini, konak tarafından HIV enfeksiyonuna direnci bastırmada çok
önemli olabilir. VIF'in virüs üretiminin son aşamasında gerekli olduğu ve
insanlara bulaşmada önemli hücrelerden T hücreleri ve makrofajlarda, doğal
anti-viral aktivitelerini baskılayarak işlev gördüğü düşünüldü. VIF olmadan HIV
primer insan T-hücrelerinde bulaşıcı değildir.
VIF olmadığı zaman onları HIV'e karşı aktif hale getiren T
hücreleri nedir? APOBEC3G (orijinal olarak bir apolipoprotein B mesajcı RNA
düzenleme enzimi olarak keşfedilen) olarak adlandırılan bir enzim içeren
hücrelerde antiviral yolunu inhibe ettiğinden, VIF bulaşıcı virüsün üretimi için
gerekli olduğu düşünülmektedir. Bu enzim, aynı zamanda tek sarmallı DNA'yı
hedefleyen bir sitidin deaminazdır. VIF ters transkripsiyonun başlangıç ürünüdür
viral DNA'nın tek sarmal şeklinde düzenlenmesini engeller. İnfekte virusda VIF
delesyonu olduğunda bu düzenleme çok daha belirgindir. Bu nedenle, VIF viral
infektivitenin kaybına neden olabilecek yapısal protein, enzimler ve düzenleyici
proteinlerin değişimine yol açacak birçok mutasyonu önler.
VPR
VPR HIV patogenezini etkiler ve diğer hücrelerin daha az bir
ölçüde makrofajların enfeksiyonu için gereklidir. Ayrıca, HIV LTR uyarılı
transkripsiyonunu aktive eder. Bu enfekte olmuş hücrenin apoptozu ve hücre
siklusunun G2 safhasında konak hücre bölünmesinin tutulmasına neden olmaktadır.
Bu bir sitoplazmik-çekirdek servis proteini (nükleer gözenekler aracılığıyla
pre-entegrasyon kompleksi için) gibi davranır. VPR HIV ile enfekte olmuş
hastaların serumunda bulunur.
|

 Bu ince kesitli transmisyon elektron mikrografisi (TEM) "İnsan İmmun
yetmezliği virüsü"(HIV) virüs partiküllerinin veya virionların, bir dizi
ince yapı detaylarını göstermektedir
Bu ince kesitli transmisyon elektron mikrografisi (TEM) "İnsan İmmun
yetmezliği virüsü"(HIV) virüs partiküllerinin veya virionların, bir dizi
ince yapı detaylarını göstermektedir







