|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VİROLOJİ |
|
ENGLISH |
VIROLOJİ - BÖLÜM
DOKUZ
ANTİ-VİRAL KEMOTERAPİ
Dr Richard Hunt
Professor
University of South Carolina School of Medicine
Çeviren.
Prof. Dr. Selçuk Kaya
İzmir Katip Çelebi Üniversitesi, Tıp Fakültesi
|
|
En
Español |
|
SHQIP - ALBANIAN |
|
|
Let us know what you think
FEEDBACK |
|
SEARCH |

 |
|
|
|
ÖĞRETİM HEDEFLERİ
Şu anda, anti-viral maddeler olarak kullanılan ilaçlar ve nasıl etkili
maddeler olduğunu aydınlatmak. Bu ilaçların etki modları tartışılacaktır
|

|
|
|
Penisilin gibi antibakteriyel ilaçlar ökaryotik hücrelerde mevcut
olmayan hücre duvarı denilen bakteriyel yapıya karşı etkili olmalarıyla
büyük başarı sağladı. Tersine, çoğu antiviral ajan virus konak hücre
metabolic reaksiyonlarını kullandığı için terapotik kullanımları sınırlı
kalmıştır. Böylece antiviral ajanların çoğuna anti hücresel ajanlar
denildi. Konak hücre yanıtını uyarmak için aşı kullanılması alternative
yaklaşım olarak daha sık sürdürülmektedir. Yine de virus tarafından
kodlanan aktiviteler mevcuttur ve bu nedenle potansiyel virus spesifik
hedefler ön plandadır. Virülerle ilgili özellikli bir durum büyük bir
genoma sahip olmaları ve kendi replikasyon enzimlerini kodlamalarıdır.
Yine de ne yazık ki çoğu antiviral in-vitro olarak etkili olmasına
rağmen, in-vivo olarak etkisizdir.
İyi bir antiviral ilaç:
1- Virus spesifik fonksiyonlara etki etmeli;
2- Virüsün replike olmaması için hücresel fonksiyonlara etki etmelidir.
Antiviral ilaç sadece virus ile enfekte hücreleri öldürmeye spesifik
olmalıdır.Bu; virus enfekte hücreye kısıtlı ilaç aktivasyonu ile
yapılmaktadır.
İdeal bir ilaç şöyle olmalı:
- Suda çözünür
- Kan akımında sabit
- Hücreler tarafından kolay alınabilen
İdeal bir ilaç şöyle olmamalı:
- Toksik
- Karsinojenik
- Allerjik
- Mutajonik
- Teratojenik
Eğer alternatifi yoksa antiviral ajanın toksisitesi Kabul edilebilir.
Örneğin semptomatik kuduz veya hemorajik ateşte olduğu gibi.
Belli ki, iyi bir ilaç konak hücresine virusten daha fazla toksisite
göstermelidir. Selektivite ilaçların terapotik indeksine gore ölçülür.
Terapotik indeks (T.I): hücre için toksik olan minimum doz
virus için toksik olan minimum doz
Etkili ilaçların terapotik indeksi 100-1000 arası veya daha fazladır.
Tıpkı anti- bakteriyellerde olduğu gibi virüsün de zayıf noktasını
bulmalıyız. Bu, virüsün benzersiz bir enzimi olmalı ki böylece ilaç
konak hücresine toksik olmasın.
Virüslerin listesi kendi enzimleri ile kodlanmalarına gore
bilinmektedir. Bunların arasındaki diğer enzimler: proreazlar, mRNA cap
enzimleri, nöraminidazlar, ribonükleazlar, kinazlar ve kılıf
enzimleridir.
|
|
Moleküler Yapı açılır kutuları, kimyasal ve üç boyutlu
yapılarını gösterir |
| |
| Virus |
RNA/DNA polimeraz |
Diğer |
| Picorna |
+ |
+ |
| Reo |
+ |
+ |
| Toga |
+ |
+ |
| Orthomyxo |
+ |
+ |
| Paramyxo |
+ |
+ |
| Rhabdo |
+ |
+ |
| Arena |
+ |
? |
| Corona |
+ |
+ |
| Bunya |
+ |
? |
| Parvo |
- |
+ |
| Adeno |
+ |
+ |
| Herpes |
+ |
+ |
| Irido |
+ |
+ |
| Pox |
+ |
+ |
|
Hepatit B |
+ |
+ |
|
| |
Ilk lisanslı antiviral ilaç olan idoksüridin (1963) ,viral DNA sentezini inhibe
eden bir pirimidin analoğudur. Halen epitelyal herpetic keratitte topical olarak
kullanılmaktadır fakat; diğer ilaçlar daha az toksik olduğu için yerini diğer
ilaçlara bırakmıştır.
Spesifik olmadığı için toksiktir. İlaç virüste olduğu gibi konakta da DNA
polimerizasyonunu inhibe eder. Daha iyi antivirallerden biri de 1983 den beri
kullanılan pürin analoğu olan asiklovirdir. Herpes DNA replikasyonunu inhibe
eder. Ayrıca bir nükleozid analoğudur fakat idoksüridinle karşılaştırıldığında
spesifitesi yüksektir ve birçok toksik yan etkiler görülmez. Bu nedenden dolayı
aşağı bakınız.
|
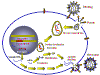 Şekil 1 İlaçlar için hücresel
Şekil 1 İlaçlar için hücresel
Hedeflar
|
ANTİVİRAL ETKİ YERLERİNE GÖRE YAŞAM
SİKLUSUNDAKİ OLASI FAZLARI Virüsun hayat siklusu; hücre
yüzeyine tutunma, replikasyon, protein sentezi vb. Gibi farklı aşamalar
içermektedir ve bu aşamaların hepsi antiviral ilaçların hedefi olabilir.
Hayat siklusu aşamaları içinde potansiyel teröpatik ajanlar tarafından
hedeflenenler:
- Virüsün hücre duvarına bağlılığı (belki de spesifik bir viral
reseptör ile yarışmasının sonucu olarak)
- Intraselüler keselere alınma (endozomlar)
- Virüsün soyulması (protein kılıfın kaybı, lipid membranın
endozom ile füzyonu) note: endozom/lizozom kompartmanı asidiktir ve
bu asiditenin inhibisyonu iyi bir hedef olabilir
- Viral DNA ‘nin konak hücresinin kromozomal DNA ‘sına
integrasyonu (nerede görülürse)
- Genomun yeni RNA veya DNA’ ya transkripsiyonu (polimerazlar
hedef)
- mRNA traskripsiyonu
- mRNA’nın işlenmesi (poliadenilazyonu, metilasyon,capping,
birleştirme)
- Protein translasyonu
- Proteinlerin posttranslasyonel modifikasyonu ( glikolizasyon,
fosforilasyon, yağ açilasyonu, proteolizis) bunlardan bazıları
fonksiyonel enfektif viral ürünler için esansiyeldir
- Komponentlerin tam virüsün içinde toplanması
Aşağıdaki bölümlerde bu yaşam döngüsü aşamalarının (Şekil 1) her birine
bakacağız.
|
|
|
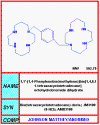 Şekil 1a
Şekil 1a
AMD3100
|
RESEPTÖRLERE BAĞLANMA VEYA İNTRASELÜLER
VEZİKÜLLER İÇİNE ALINMA Yakın zamana kadar, herhangi bir virus
tarafından bağlanan reseptörü durduran iyi ilaçlar yoktu. (Fakat aşağıda
influenza siyalidaz inhibitörüne bakınız) Bununla birlikte, olasılıkları
çönünebilir CD4 proteini gibi reseptörleri taklit eden peptidin kullanımını
içerir. HIV gp120’ ye bağlanırdı ve hücre yüzeyindeki reseptöre bağlanmasını
durdururdu. Fakat bir stabilite problem mevcuttur. Çözünür protein hızlıca
yıkılır ve dolaşımdan temizlenir, yani etkili konsantrasyon yararlı bir sure
içinde elde edilemez. Girişimsel proteinleri stabilize etmek için yapılmıştır
fakat çok az bir başarı elde edilmiştir. Enfekte hücreleri öldürmek için
toksinlere eş çözünür CD4 girişimleri olmuştur, yine çok az başarı sağlanmıştır.
Bazı olgularda, laboratuvar çalışmalarında çözünür CD4, virüsü daha enfeksiyoz
yapmaktadır. Bunun niçin olduğu bilinmiyor fakat muhtemel açıklama gp120’ ye
bağlanmanın ikincisinde konfarmasyonel bir değişikliğe neden olmasının, bunun
bir hücrenin HIV ile enfeksiyonunda CD4 antijeni ile birlikte ko-reseptör için
daha yüksek afinite sağlamasının önemli olduğu şeklindedir (bakınız HIV). Ayrıca,
çözünür CD4 gp120’ ye bağlı olmasının füzyonu desteklemesi muhtemeldir.
PRO 542 stabilize eklemek için, çözünür CD4’ ün genetik olarak bir
immunglobuline füzyon olmuş tetramerik formudur. Bu CD4- immunglobin füzyon
protein; insane CD4’ ü D1 ve D2 domainlerini ve ıgG2 ağır ile hafif zincir sabit
bölgelerini içerir. Gp120 için yüksek affiniteye sahiptir.
HIV’ in bir hücreyi enfekte etmesi için hem CD4 antijen ve bir ko-reseptörüne
hem bir kemokin reseptörüne bağlanmalıdır. Kemokin reseptörleri kemokinlere
bağlanır ve bu HIV gp120’ ye bağlanmayı engelleyebilir. Bir kemokin derives (RANTES)
virus bağlanmasına karşı bir ajan olarak kullanılmıştır. CCR5 kemokin
reseptörüne bağlanmaya ek olarak, doğal kemokinler gibi olan bu deriveler
endositoz ile ko-reseptörü down regüle ederek virüsün bağlanmasını
zorlaştırırlar. RANTES gibi kemokinler proinflamatuardır ve lökositler için
kemotaktiktir fakat bu özellikler N-terminal uçlarda kimyasal modifikasyon ile
azaltılabilir. Bazı kemokin deriveleri HIV bağlanmasına karşı harika
antagonisttirler ve vajinadan HIV’ e maruz kalan maymunları koruyabilir. Anti-
reseptör monoclonal antikorlar da virus bağlanmasını engellemek için
geliştirilmiştir. Koreseptörün transmembran dizisi analoğu olan peptidleri
kullanmak diğer bir yaklaşımdır. Bunlar koreseptör proteinin yedi transmembran
alfa heliksi arasındaki etkileşimi bozarlar.
AMD-3100
Kimyasal ismi: 1,4,8,11-Tetraazacyclotetradecane,
1,1'-(1,4-phenylenebis(methylene))bis-, octahydrochloride
HIV ko-reseptör etkileşimlerini bozan peptid yaklaşımlarına ek olarak; bazı
küçük molekül inhibitörleri geliştirilmiştir. Örneğin, AMD3100/JM-3100
ko-reseptörün CXCR4 (fusin) olarak bilinen, ligand bağlama bölgesine
bağlanarak ortaya çıkar ve CXCR4 ile gp120’ in V3 döngüsü arasındaki
etkileşimi bloke eder.
Maravirok
Kimyasal ismi:
4,4-difluoro-N-{(1S)-3-[exo-3-(3-isopropyl-5-methyl-4H-1,2,4-triazol-4-yl)-8-azabicyclo[3.2.1]oct-8-yl]-1-phenylpropyl}cyclohexanecarboxamide.
(Marka ismi selzentry, ABD dışında Celsentri)
Ağustos 2007 de HİV + hastalarda kullanılmak üzere onaylanmıştır. Bu ilaç
kemokin reseptörü olan CCR5 ile glikoprotein (gp)120 arasındaki etkileşimi
engeller. HİV farklı bir ko-reseptör olan CXCR4 ‘ ü de kullandığı için HIV
tropism testi ilacın etkinliğini belirlemede kullanılır. Bir çalışmada
geneleksel HAART tedavisine maravirok un eklenmesiyle üçlü kombinasyon
tedavisi, standart HAART tedavisiyle karşılaştırılmış ve HAART tedavisine
günde iki doz maravirok eklenen hastalarda standart HAART tedavisi alan
hastalara göre HİV RNA düzeyleri 50 kopya/ml daha az bulunmuştur.
VİRAL VE KONAK HÜCRE MEMBRANINA FÜZYON
HİV’in gp41 ile konak hücreye füzyonunu
bloke eden ajanlar
Enfuvirtid
Diğer isimler :DP-178, pentafusid, T-20, Fuzeon
Gp41 in peptid türevleri muhtemelen gp41 ile hücre membranı arasındaki
etkileşimi füzyon sırasında bloke ederek veya füzyon için gerekli olan iki
gp41 molekülünü bağlantısının sonucu olan yapısal değişikliği durdurarak
enfeksiyonu inhibe eder. Enfuvirtid, gp41’ in 127-162 arasındaki
rezidülerine karşılık gelen 36 aminoasitlik bir peptiddir ve bu yapısal
değişikliği bloke eder. Klinik çalışmalarda plazma viral yükünde neredeyse 2
log’ luk azalma elde edilmiştir. Bu ilaç 2003 yılında onaylanmıştır fakat,
yeni sonuçlar biyoyararlanımının düşük olduğunu ve direçli mutantların
ortaya çıktığını öne sürmüştür.
Gp41 üzerinde küçük molekül inhibitörünü tutmak için bir kavite
bulunmaktadır. Seçilmiş olan D-aminoasit içeren peptidler bu kaviteyi
doldurrak füzyonu inhibe eder.
Diğerleri
RFI-641
Kimyasal ismi: 4,4"-bis-{4,6-bis-[3-(bis-carbamoylmethyl-sulfamoyl)-phenylamino]-(1,3,5)
triazin-2-ylamino}-biphenyl-2,2"-disulfonic acid
RFI-641 RSV’ nin hücre membranına füzyonunu inhibe eder. Virüsün füzyon (F)
proteininin yapısını değiştirdiği görülmektedir ve in vivo olarak hayvan
modellerinde etkilidir. RSV A ve B suşlarına etkilidir. Bu ilaç ribavirinden
daha iyidir (RSV enfeksiyonun tedavisinde rutin olarak kullanılan tek ilaç)
ve RSV’ ye spesifik görünmektedir. İlacın şu anda toksisite ve verilme
problemleri nedeniyle rutin kullanımı terk edilmiştir. Oral olarak alınamaz
bu yüzden aerosol olarak verilir fakat yaşlı hastalarda bu bir problem
oluşturmaktadır. Belki yenidoğanlarda kullanılabilir ve türevleri daha az
toksik olabilir.
BMS-433771
Kimyasal ismi; 2H-Imidazo(4,5-c)pyridin-2-one,
1-cyclopropyl-1,3-dihydro-3-((1-(3-hydroxypropyl)-1H-benzimidazol-2-yl)methyl)-
BMS-433771 RSV füzyon inhibitörüdür. Viral F proteinin inhibe ederek çalışır.
RSV A ve B ‘ nin ikisi üzerine de etkilidir. İki kemirgen modelinde
enfeksiyondan önce oral olarak verildiğinde RSV’ ye karşı etkilidir.
Klinikte kullanılabilir.
|
 Şekil 2
Şekil 2
Arildone |
SOYULMA Virüsün soyulması (zarflı
virüslerde lipid zarfın kaybı veya zarfsız virüslerde nükleokapsid proteinlerin
kaybı) ph bağımlı füzyonun sonucu olarak düşük ph’ lı endozom veya lizozomlarda
ortaya çıkar. Note:bazı virüsler füzyon için asidik çevreye ihtiyaç duymazlar ve
plazma membranı ile kaynaşırlar. Bu herpes virus ve HİV ‘de görülen bir durumdur
ve sinsitya oluşumuna öncülük etmektedir.
|
 Şekil 3
Şekil 3
VP1 proteininin bir cebinde gömülü WIN V1 (oklar) ile insan rinovirüs |
Arildona ve WIN bileşikleri
Kimyasal ismi:
4-(6-(2-Chloro-4-methoxy)phenoxy)hexyl-3,5-heptanedione
Arildona ve WIN bileşkleri lipid
membranı olmayan picorna virüslerin soyulmasını inhibe eder. İlaç
virüsün VPI proteinin içine girer ve iyon transportunu bloke eder.
Plekonaril
Kimyasal ismi:
3-(3,5-Dimethyl-4-(3-(3-methyl-5-isoxazolyl)propoxy)phenyl)-5-(trifluoromethyl)-1,2,4-oxadiazole
Diğer isimleri:Win 63843, Picovir
WIN bileşikleri gibi çalışır. Nükleokapsid içindeki hidrofobik cebe
uyar ve RNA ‘dan nükleokapsid proteinlerinin sıyrılmasını durdurarak
virüsün replikasyonunu önler. Oral yoldan alınan bileşen çeşitli
enterovirüs ve rinovirüslere karşı geniş aktiviteye sahiptir fakat
semptamlar sırasındaki redüksiyon küçüktür ve bazı popülasyonlarda
görülür. Daha önce, oral formülasyon ile karşılaştırıldığında
plecoranil bir burun içi formülasyon olup, optimize edilmiş bir
dağıtım yaklaşımı temsil etmektedir.
|
|
MOLEKÜLER YAPI
Arildone
Pleconaril |
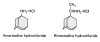 Şekil 4
Şekil 4
Amantadine (sol) Rimanadine (sağ)
|
Amantadine
Kimyasal ismi: tricyclo[3.3.1.1.3,7]decane-1-amine hydrochloride
Diğer isimler: Symmetrel, Mantadix, Amantan
Rimantadine
Kimyasal ismi: alpha-methyltricyclo[3.3.1.1.3,7]decane-1-methanamine
hydrochloride
Diğer isimleri: Flumadine
Aslen lizozomotropik olarak bilinmekte ve endositik veziküller ile ve
lizozomların asidifikasyonunu engellediği düşünülmekteydi. Şu an, virüsün
soyulmasından önce ortaya çıkan aşamada zarflı virüsün endozomunun
asidifikasyonu için gerekli olan M2 iyon kanalı isimli viral proteine etkili
olduğu bilinmektedir. Bu ilaçlar aynı zamanda influenza HA glikoproteinin
matürasyonuna etkilidir. Böylece sonraki kuşakların enfektivitesi
zayıflamıştır.
Bu ilaçlar influenza A’ ya karşı (influenza B‘ ye karşı değil) oral
profilakside iyidir. Immunsüprese hastalarda ve yaşlılarda aşıya alternatif
iyi bir seçenektir. Buna karşı batı ülkereinde çok fazla kullanılmamaktadır.
Profilaktif rimantadin Eski Sovyet Sosyalist Cumhuriyet birliği (SSCB)
ülkelerinin çoğunda kullanılmıştır. Her iki ilaçta ABD’ de lisans
almıştırKuş giribi pandemisi olasılığı nedeniyle henüz H5N1’ e karşı etkili
bir aşı olmadığından ve pandemik tür tespit edildikten sonra aşı
geliştirilmesi birkaç ay sürebileceğinden bu ilaçlar tekrar gündeme
gelmiştir.
2005-2006 influenza sezonunda H3N2 suşlarının %92’si, H1N1 suşlarının
%25’ inde olduğu gibi bu ilaçlara karşı dirence sebep olan mutasyona sahipti,
Benzer promlemler 2006-2007 yıllarında görüldü ve bu ilaçlar önerilmedi. Bu
ilaçlar dolaşımdaki major tiplerin direnç yüzdesi düşene kadar önerilmez.
|
|
WEB KAYNAKLARI
Antiviral İlaçlar ve
Grip
CDC |
|
MOLEKÜLER YAPI
Amantadine
Rimantadine |
 Şekil 5
Şekil 5
Asiklovir bir viral kinaz ile ilk asiklik GMP'ye ve daha sonra hücresel
kinazlar tarafından asiklik GDP ve asiklik GTP'ye fosforile olur
|
NUKLEIK ASID SENTEZI
Sahip olduğumuz en iyi antiviral ilaçlar bu gruptadır.
Selektiftirler çünkü:
- Virus muhtemelen, ilacı aktiflemek için kendi enzimlerinin
kullanır. Ve/veya
- Muhtemelen viral polimeraz konak enzimlerine göre ilaca çok daha
sensitiftir.
|
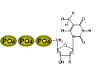 Şekil 6
Şekil 6
Üç fosfat timidine ilave edilir. İlki viral enzim ile ve kalan kısmı
hücresel enzimlerle ilave edilir
|
Timidin kinaz substratları
Herpes simplex (ve diğer) virüslerin
timidin kinazları (Şekil 6) virüsün fosforile nükleit asit
öncülerinin yüksek konsantrasyonda olmadğı hücrelerde çoğalmasına
izin verir. Bunlar genellikle kendi genomlarını replike etmeyen
hücrelerdir.(sinir hücreleri gibi) ancak bölünmeyen hücreler
fosforile olmayan nükleoisdlere sahiptir. Virüs kendi kinazları ile
hücrenin nükleosidlerini fosforilleyerek bölünmeyen hücrelerde
yaşayabilir.
Timidin dışında diğer nükleozidlerde de çalıştığı için enzimin
isimlendirilmesi kısmen yanlıştır. (timidin en iyi substrattır).
Demek ki enzim substrata spesifik değildir. Konak hücre diğer
nükleozidleri fosforile eden başka enzimlere sahip olduğundan,bu
hücrelerin timidin kinazı timidine çok spesifik olup bu durumla
çelişmektedir. Viral enzimin bu spesifiteden yoksun olması nükleozid
analoğu ilaçların çalışmasına izin vermekte ve onları
fosforillemektedir. Konak enzimi yüksek spesifitesinden dolayı bu
konuda daha az iyidir (çoğu kez ilacı fosforillemez).
Diğer avantajı viral enzimin ilacı
fosforillemekte oldukça iyi olduğu gerçeğidir. Biz nükleozid
analoğunu non-fosforile formda uygulayabiliriz. Bu kullanışlıdır
çünkü plazma membranı spesifik transport proteininden yoksun
olduğundan fosforile bileşiklere karşı geçirgenliği zayıftır; bu
yüzden fosforile ilacın hücre içine geçmesi zordur.
Hücrenin endojen enzimlerini fazla üretmesi veya kendi timidin
kinazları ile aktivasyon gerekliliği nedeniyle virüse karşı ilacın
kullanımını kısıtlar (şanslıysak ilaç daha düşük derecede aktive
olur).
Bu ilaçların en iyi kullanım
sonuçlarını özetleyecek olursak:
- Sadece virus enfekte hücrelerce
aktive olurlar
- Viral DNA polimerazın ilaca, konak
enziminden daha sensitive olmasından dolayı ilacın aktive formu
daha spesifik hale getirilir.
Çoğu nükleik asid sentezi inhibitörü
ilaç şekeri, bazı veye her ikisi değiştirilmiş nükleozid
analoglarıdır. Asiklovir bu grup ilaçlara en iyi örnektir ve herpes
virus enfeksiyonlarının tedavisinde kullanılır. Hücreye nükleozid
formunda plazma membranından girer,sonra herpes virus timidin kinazı
tarafından hücre içinde spesifik olarak fosforillenerek aktif forma
geçer. Sonra polimerizasyonu inhibe ederek DNA sentezini bloke eder,
bir zincir sonlandırıcıdır.
|
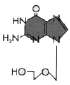 Şekil 7
Şekil 7
Asiklovir
|
DNA Sentez Inhibitorleri
(1) Şeker modifikasyonları
Asiklovir/asikloguanozin
Kimyasa ismi; 9-(2-hydroxyethoxymethyl)guanine, acycloguanosine (ACG)
Diğer isimleri: asiklovir, zovirax
Yukarıda bahsedildiği gibi bu ilaç çok selektifdir ve bizim iyi
antiviral ilaçlarımızdan biridir. Enfekte olmayan hücreler tarafından
active edilmediği için (çünkü ilaç çok spesifik olan hücretimidin kinazı
için zayıf substrattır.) enfekte olmayan hücrelere toksik değildir (bazı
renal disfonksiyonlar hariç )
Dahası herpes simplex virüsün DNA polimerazı, hücresel DNA polimerazdan
on kat daha sensitiftir. Bu ilaç yarışmalı inhibitördür- dGTP ile
yarışır- ayrıca daha önemli olan etkisi DNA’ nın içine birleştiğinde
zincir sonlandırıcı olmasıdır. Oral, topical veya intraveöz olarak
kullanılır.
HSV-1, HSV-2 ve VZV asiklovire duyarlıdır.
Asiklovir herpes simplex keratiti, latent HSV, herpes labialis,
genital herpese karşı etkilidir. Uzun sure kullanımından sonra asiklovir
direçnli mutantlar bir problemdir ve timidin kinaz veya polimeraz
genindeki değişikliklerin sonucu olarak görülür. Asiklovirin L-valin
esteri olan ön ilaç formu olarak adlandırılan valasiklovir ((VACV),
Zelitrex, Valtrex) mevcuttur. Oral olarak alınır.
|
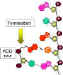 Şekil
8 Şekil
8
Zincir sonlanması
|
Pensiklovir
Kimyasal ismi:9-(4-hydroxy-3-hydroxymethyl-but-1-yl)guanine
Diğer isimleri: PCV, denavir, Vektavir
HSV-1, HSV-2, VZV’ ye karşı kullanılır. Asiklovire benzer etki gösterir.
Zincir sonlandırıcıdır. Çözünürlüğü olmadığı için sadece topical krem
olarak kullanılabilir.
Famsiklovir
Kimyasal ismi; diacetyl ester of
9-(4-hydroxy-3-hydroxymethyl-but-1-yl)-6-deoxyguanine
Diğer isimleri: FCV,Famvir
Pensiklovirin ön ilacıdır. İki ester grubunun hidrolizi ve oksidasyonun
sonucu olarak pensiklovire dönüştürülür. Esterifikasyondan dolayı suda
çözünebilir ve oral olarak kulanılabilir. HSV-1, HSV-2, VZV
enfeksiyonlarında kullanılır.
|
|
MOLEKULER YAPI
Acyclovir |
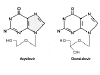 Şekil 9
Şekil 9
Asiklovir Gansiklovir
|
Gansiklovir
Kimyasal ismi; 9-(1,3-dihydroxy-2-propoxymethyl)guanine
Diğer isimleri:DHPG, GCV, Cymevene, Cytovene
Asiklovirle çok benzer bir ilaçtır, sadece fazladan OH vardır.
Ayrıca gansiklovirin L-valin esteri olan valgansiklovir olarak
adlandırılan ön ilacı da mevcuttur. Oral vangansiklovir
muhtemelen tedavi ve CMV enfeksiyonlarını önlemede iv
gansiklovirin yerini alacaktır. Gansiklovir CMV’ ye karşı etkili
olan bir ilaç seçeneğidir. Asiklovir CMV’ ye karşı kütürde bazen
etkilidir fakat gansiklovirin üstünlüğünden dolayı bu
enfeksiyoların tedavisinde fazla kullanılmaz.
Asiklovir gibi gansiklovir de viral
DNA polimerazı etkiler ve zincir sonlandırıcı olarak etki
gösterir. Herpes virus enfekte hücrelerde öncelikle viral
timidin kinaz tarafından fosforillenir sonra hücre kinazı ilacın
trifosfat formunu oluşturur, böylece ilaç, DNA zinciriyle
birleşir ve zincir sonlandırılır. Ancak CMV timidin kinaz
kodlamaz. Gansiklovir, CMV’ nin kodladığı enfekte hücrelere
spesifitesini açıklayan protein kinaz (UL97) tarafından
fosforillenir. Viral polimeraz gansiklovire konak enziminden 30
kat fazla affinite gösterir. Bu yüzden selektivitesi başarılıdır.
Normalde gansiklovir iv olarak 10
mg/kg/gün dozunda veya oral olarak 3000 mg/gün olarak
verilir.genellikle AIDS hastalarındaki CMV retinintinde
kullanılır ki onun Vitrasert olarak bilinen intraoküler (intravitreal)
implant vardır. Lokalize tedavi için 4,5 mg gansiklovir içerir.
|
|
MOLEKULER YAPI
Ganciclovir |
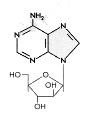 Şekil 10
Şekil 10
Ara-A
|
Adenozin arabinozid
Kimyasal ismi: 9-beta-D-Arabinofuranosyl-9H-purin-6-amine
Diğer isimleri: Vidarabin, ara-A
Asiklovir ve gansiklovir tam şeker halkasına sahip olmadıkları
için zincir sonlandırıcıdırlar. Uygun 3’ OH grubu DNA
uzamasındaki eksiklik sırasında fosfodiester bağ formunun
oluşumuna ihtiyaç duyar. Adenozin arabinozid tam şekere sahiptir
fakat riboz değil arabinozdur. Bu ilacın birkaç yan etkisi
mevcuttur ve sadece potansiyel ölümcül hastalıkta kullanılır. Ek
olarak kan akımından kolayca deamine olarak daha az efektif
formu olan ara- hipoksantine dönüşür.
|
 Şekil 11A
Şekil 11A
AZT
|
Zidovudin
Kimyasal ismi: 3′-azido-2′,3′-dideoxythymidine
Diğer ismi: Azidothymidine, AZT, Retrovir® - Şekil 11A
Bu ilaç da zincir sonlandırıcıdır. Hücre kinazı tarafından
fosforillenir ve kendi timidin kinazları olmadan virüslere karşı
kullanılır (HIV gibi). Spesifite hesaba katıldığında revers
transkriptaz (RNA bağımlı DNA polimeraz) ilaca insan DNA bağımlı
DNA polimerazından daha sensitiftir. Fakat bazı toksik etkiler
mevcuttur. Anti HIV tip 1 ve tip 2 ilacı olarak kullanılır (bakınız
HIV). RNA polimeraz 2’ nin retrovirüsün viral genomunun
sentezinde kullanılması ve virüsün yüksek oranda mutasyonunun
sonucu nedeniyle ilacın varlığının selektif baskısı direçli
viral mutantların çıkmasına hızla öncülük eder. Bunların hepsi
revers transkriptazda mutasyonlara sahiptir. Dirençli
mutantların çıkması nedeniyle AZT diğer ilaçlarla kombine olarak
verilir.
|
|
MOLEKÜLER YAPI
AZT |
|
 Şekil 11B
Şekil 11B
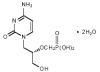
Sidofovir
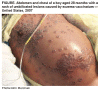 Şekil 11C
Şekil 11C
28 aylık çocukta Ekzema vaccinatum
|
Sidofovir
Kimyasal ismi:HPMPC
Diğer isimleri: Vistide
Sidofovir hem DNA zincir sonlandırıcı hem de DNA polimeraz
inhibitörüdür. Nükleozid monofosfattaki C-O-P zincirinin bir
fosfonat ( C-P) ile yer değiştirmesiyle oluşan enzimatik olarak
yarılanma ömrü uzun kararlı türevi sağlanmış bir asiklik
nükleozid fosfonattır (fosfat değil)
Fosfonometoksi- nükleozid formda verilir ve hücre içinde iki kez
hücresel kinazlar kullanılarak (pirimidin nükleozid monofosfat
kiraz ve pirimidin nükleozid difosfat kinaz. Nükleozid formda
kullanılan ve ilk fosfatı viral timidin kinaz tarafından eklenen
asiklovir ile karşılaştırıldığında viral kinaz kullanılmaz )
fosforillenerek aktif formu olan difosfata çevrilir.
Sidofovir, virus konsantrasyonu kadar sayıdaki DNA polimerazı
inhibe eder, bu değer insan DNA polimerazını inhibe etmek için
gerekenden oldukça azdır. Nefrotoksisite ve bazı diğer yan
etkileri olmasına rağmen gansiklovirden daha az yan etki
göstererek herpes virüslere karşı etkilidir. İlacın renal
tübüler sekresyonunu bloke etmek için beraberinde probenesid
verilmelidir.
Sidofovir CMV enfeksiyonlarının tedavisinde oldukça
yararlıdır ve AIDS hastalarında CMV retinitinin tedavisinde
endikedir. Asiklovir dirençli herpes enfeksiyonlarının
tedavisinde yararlı olabilir. Ayrıca pox virüslere molloscum
contagiosum virus dahil, bir polyoma virus olan BK virüse,
adenovirüslere karşı etkilidir. Her ne kadar gerçekleştirilmiş
bir kontrol çalışması olmasada immunkompromize hastalarda
adenovirus kaynaklı gastroenteritlerin tedavisinde umut
vericidir ve HAART tedavisine ek tedavi olarak progresif
multifocal lökoensefalopati (PML) olan AIDS hastalarının
tedavisinde kullanılmıştır. Ikinci olarak diğer insan polyoma
virüsü olan JC’ den kaynaklanır. Sidofovir mart 2007’ de
deneysel bir ilaç olan ST-246 İle beraber aşı egzeması olan 2
yaşında bir erkek olgunun tedavisinde kullanıldı. Canlı çiçek
hastalığı virüsü içeren aşı, genellikle immunkompremise olan
taşıyıcılara geçebilmesi çiçek aşısının beklenmeyen bir yan
etkisidir. Bu vakada, egzemadan dolayı virus hastanın deri
hücrelerine girmeyi başarmış ve çoğalmış, başlangıçta yaygın
rash a sebep olmuş sonra merkezi çukurlaşan büller yapan çiçek
hastalığı enfeksiyonu görülmüştür. Rash hastaların keratinize
derilerin %50’ sini kapsamaktadır. Aşı egzeması ölümcül (fatal)
olabilmesine rağmen, bu hasta 48 saatten sonra taburcu
edilmiştir.
|
|
WEB KAYNAKLARI
Sidofovir
Medicinenet |
|
VAKA RAPORU
Askeri bir
Çiçek Aşısı ile kişisinin Vaccinia Virüsü'nün ev halkına bulaştırması |
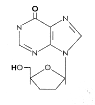 Şekil 12
Şekil 12
DDI
|
Diğer şeker modifikasyonları
Dideoksinozin
Kimyasal ismi: 2′,3′-dideoxyinosine
Diğer isimleri: DDI ,didanozin, videx
AZT direçli HIV hastalarına karşı kullanılmak ve AZT ile
kombinasyon tedavisinde lisanslıdır.
|
|
MOLEKÜLER YAPI
DDI |
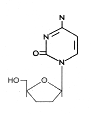 Şekil 13
Şekil 13
DDC
|
Zalsitabin
Kimyasal simi: 2′,3′-dideoxycytidine
Diğer isimleri: Dideoksitosin, DDC, Hivid
DDC de HIV hastalarında AZT ile kullanımında lisanslıdır.
Ayrıca AZT ilebirlikte, viral poilmeraza spesifitesi eksik
olduğundan ve hızlı ortaya çıkan direçli HIV mutant türleri
nedeniyle toksisite bildirilmektedir.
Stavudin
Kimyasal ismi: 2′,3′-didehydro-2′,3′-dideoxythymidine
Diğer isimleri: d4T, Zerit
Kombinasyon tedavisinde özelliklle de ilerlemiş HIV
hastalığında kullanılır.
Lamivudin
Kimyasal ismi: (−)-β-L-3′-thia-2′,3′-dideoxycytidine
Diğer isimleri: 3tc, Epivir, Zeffix
HIV-1, 2 ve ayrıca hepatit B virüse karşı etkilidir. Her
ikisinde de revers transkripsiyon sırasında zincir
sonlandırıcı olarakk görev yapar. HIV için 3TC, AZT ile
combine ilaç (combivir) olarak veya AZT ve abakavir ile (Trizivir)
verilebilir.
Abakavir
Kimyasal simi:
1S,4R)-4-[2-amino-6-(cyclopropylamino)-9H-purin-9-yl]-2-cyclopentene-1-methanol
succinate
Diğer isimleri: ABC, Ziagen
Emtrisitabin
Kimyasal ismi:
(−)-β-L-3′-thia-2′,3′-dideoxy-5-fluorocytidine
Diğer isimleri: FTC, Emtriva
HIV ve HBV’ ye karşı etkili diğer revers transkriptaz
inhibitörüdür.
Tenofovir disoproxil
Kimyasal ismi: Fumarate salt of
bis(isopropoxycarbonyloxymethyl) ester of
(R)-9-(2-phosphonylmethoxypropyl)adenine
Diğer isimleri: PMPA, Viread
Tenofovir; retroviral ve hepatit B revers transkriptaza
karşı etkilidir ve bir zincir sonlandırıcıdır. Sıklıkla
Lamivudin ve nükleozid olmayan revers transkriptaz (efavirenz)
ile combine olarak kullanılır. Lamivudin ve abakavir ile
combine olarak kullanılmamalıdır. HIV enfeksiyonu
tedavisinde lisanslı olmasına ilaveten, tenofovir ayrıca
hepatit B tedavisinde de uygundur.
|
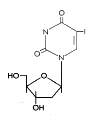 Şekil 14
Şekil 14
IDU
|
(2) Baz modifikasyonları
Bunlar, viral DNA polimeraz tarafından DNA
ile birleşmiş pirimidin analoglarıdır. Unstabil baz çiftlerine ve
mutant proteinlerdeki mis-translasyon sonuçlarına şekil verirler.
Hücre içi fosforilasyondan sonra viral DNA polimerazın yarışmalı
inhibitörleridir.
Bromovinil
Deoksirudin (brivudin)
Kimyasal ismi: E)-5-(2-bromovinyl)-2′-deoxyuridine,
bromovinyldeoxyuridine
Diğer isimler: BVDU, Zostex, Zonavir, Zerpex
BVDU, HSV tip 1 ve VZV tedavisinde kullanılır. Spesifitesinden
dolayı ilaç başlangıçta viral timidin kinaz ile fosforillenir.
HSV keratiti ve genital herpesi de içeren çeşitli HSV ve VZV
enfeksiyonlarında kullanılır. Oral veya topikal verilebilir.
Iodo-
deoksirudin (idoksuridin)
Kimyasal ismi: 5-iodo-2′-deoxyuridine
Diğer isimleri: IDU, IUdR, Herpid, Stoxil, Virudox
BVDU ile benzerdir ve şu anda başlıca HSV keratitinde göz
damlası veya topikal krem olarak kullanılır.
Triflurotimidin (trifluridin)
Kimyasal ismi: 5-trifluoromethyl-2′-deoxyuridine
Diğer isimleri: TFT, Viroptic
Etki biçimi BVDU ve IDU ile benzerdir. Bu da viral timidin kinaz
tarafından active edilir. HSV keratitinde topikal krem veya göz
damlası olarak kullanılır.
|
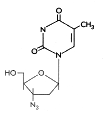
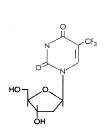 Şekil 15
Trifluorothymidine
Şekil 15
Trifluorothymidine
|
(3) Non-nukleozid reverz
transkriptaz inhibitorleri
(Bakınız Şekil 16)
HIV tedavisinde AZT ve diğer nükleozid analogları ile olan problemlerden
dolayı aynı enzimi, yani revers transkriptazı inhibe eden farklı
yaklaşımlar geliştirildi. Alternatif ilaçlar, revers transkriptazın
fonksiyonunu kaybetmeden taşıyabileceği mutasyonların sayısı limitli
olduğundan olduğundan kombinasyon tedavisinde kullanışlı olabilir.
Açıkça, revers transkriptazın non-nükleozid non- kompetatif inhibitörüne
dirençli olan mutasyonlar, enzimi kompetatif nükleozid analoğuna
dirençli yapan mutasyondan farklı bir yerde olabilir.
Non-nükleozid inhibitörleri sahip olduğumuz en potent ve selektif ,nanomolar
konsantrasyonlarda çalışan revers transkriptaz inhibitörleridir. Kültür
hücreleri (antiviral aktivitesi sitotoksik konsantrasyondan 10.000
-100.000 kat düşük konsantrasyon) ile yapılan testlerde minimal
toksisitesi olduğu ve AZT gibi nükleozid analogları ile sinerjistik
olarak çalıştığı gösterilmiştir. Dahası, üstelik nükleozid analoğu
dirençli HIV’ e karşı da etkili. Bu nedenle; bu ilaçlar yüksek töropatik
indekse sahiptir ve biyoyararlanımları iyidir böylece antiviral
konsantrasyonlara hızlıca ulaşılabilir. Revers transkriptaz
molekülündeki allosterik cebi hedef alan non-kompetatif revers
transkriptaz inhibitörleridir.
|
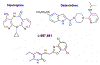 Şekil 16
Şekil 16
Yarışmasız reverz transkriptaz inhibitorleri
|
Şaşırtıcı olmayan biçimde, bu ilaçlar
revers transkriptazı hedef aldığı için kültür hücrelerinde sadece birkaç
geçit olmasına rağmen hızla dirençli mutantlar ortaya çıkar. Hastalarda
da dirençli mutantlar ortaya çıkar. Bu nedenle monoterapide kullanımları
sınırlıdır ancak dirençli virüsler diğer non nükleozid revers
transkriptaz inhibitörlerine çapraz direnç göstermesine rağmen nükleozid
analog inhibitörlerine göstermez. Ayrıca bu ilaçların yüksek
konsantrasyonlarda direncin üstesinden gelebileceğini gösteren bazı
kanıtlar vardır.
Kimyasal olarak farklı olan ajanlardan
oluşan bir derleme:
Nevirapin
Kimyasal ismi:
11-cyclopropyl-5,11-dihydro-4-methyl-6H-dipyrido[3,2-b:2′,3′-f][1,4]diazepin-6-one
Diğer isimleri: NVP veya BIRG-587, Viramun
Monoterapide bu ilaç HIV virion miktarında ilk düşüşe neden olur
fakat direnç meydana gelir ve virus titreleri tekrar yüksek
derecelere çıkar. Bu ilaç AIDS hastalarının tedavisinde
onaylanmıştır.
Delavirdin
Kimyasal ismi:
1-(5-methanesulfonamido-1H-indol-2-yl-carbonyl)-4-[3-(1-methylethyl-amino)pyridinyl)piperazine
monomethane sulfonate
Diğer isimleri: Reskriptor
Heteroaril piperazin bileşiğidir. Bu ilacın AZT ve 3TC ile kombine
terapisinde kullanılmasıyla CD4 hücrelerinde önemli artış
gözlenmiştir. Önceden AZT ile tedavi edilen çok düşük CD4 hücresi
olan hastalarda umut verici sonuçlar mevcuttur. AZT ve 3TC ile
kombinasyonda DLV, AZT direncinin ortaya çıkmasını geciktirebilir.
Ilaç hızlı emilir. DLV, AZT gibi nükleozid analogları ile combine
olarak ve aşağıda bahsedilecek olan proteaz inhibitörleri ile
kullanılır.
|
|
MOLEKÜLER YAPI
Nevirapine
Efavirenz |
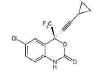 Şekil 17
Şekil 17
Efavirenz
(Sustiva)
|
Efavirenz
Kimyasal ismi:(−)6-chloro-4-cyclopropylethynyl-4-trifluoromethyl-1,4-dihydro-2H-3,1-benzoxazin-2-one
Diğer isimler: Sustiva, Stocrin, DMP-266
Efavirenz diğer ilaçlarla kombine kullanılır, viral yükü en
az proteaz inhibitörü indinavirin nükleozid revers
transkriptaz inhibitörleri ile eşdeğer kombinasyonu kadar
iyi süprese edebilir. Viral yükteki azalmayı değerlendiren
bir kıyaslamada, efavirenz + AZT+ 3TC ve indinavir+AZT+3TC
ile tedavi edilen control grubu karşılaştırıldığında 2-24
haftalar arasındaki tüm noktalarda efavirenz kombinasyonun
control koluna gore viral yükü gönüllülerin önemli ölçüde
yüksek kısmında 400 kopya altına süprese ettiği görülmüştür.
|
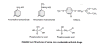
Şekil 17
Foscarnet
|
4) Diğer non-nukleozid
polimeraze inhibitorleri
Foskarnet
Kimyasal isim: trisodium phosphonoformate
Diğer isimleri: Foscavir, PFA, fosfono formic asid
DNA polimerazın yarışmalı inhibitörüdür. Pirofosfat kısmına bağlanır. Viral
DNA polimeraz, hücre DNA polimerazından 10-100 kat düşük konsantrasyonda
inhibe edilir, bir miktar seçicilik verir. AIDS hastalarında ve
immunkompremize diğer hastalarda CMV retinitinde iv olarak kullanılır.
Enfekte virus asiklovir gibi diğer ilaçlara direnç kazandığında
kullanışlıdır.
|
|
MOLEKÜLER YAPI
Foscarnet |
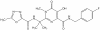 Şekil 19a
Şekil 19a
Isentress (Raltegravir)
 Şekil
19b Şekil
19b
Ribavirin
|
DNA INTEGRASYONU
Retrovirüsler RNA genomlarını, revers transkriptazı kullanarak kopyalarlar. DNA
sirküler provirus olarak kalabilir ya da hücresel DNA ile birleşebilir. Ikinci
bahsedilen şey, genomic ve messanger RNA transkripsiyonu için gereklidir. Bu
nedenle integrasyon, viral replikasyon için gereklidir. Viral DNA integrasyonu,
pol geni tarafından kodlanmış integraz enzimi tarafından gerçekleştirilir.
Replikasyon için integrasyon gerekliliği, integrazın selektif ilaç hedefi
olabileceği anlamına gelir. Yakın zamanda spesifik bir integraz inhibitörü
onaylanmıştır.
Raltegravir
Kimyasal isim: is
N-[(4-Fluorophenyl)methyl]-1,6-dihydro-5-hydroxy-1-methyl-2-[1-methyl-1-[[(5-methyl-1,3,4-oxadiazol-2-yl)carbonyl]amino]ethyl]-6-oxo-4-pyrimidinecarboxamide
monopotassium salt.
Diğer isimleri: Isentress® , MK-0518 - şekil 19a
Isentress, proteaz inhibitörleri gibi diğer ilaçlara dirençli hastalarda
HAART rejiminin parçası olarak kullanılabilir. 24 haftadan uzun periyotta
HAART tedavisinde Sustiva ile karşılaştırılmıştır. Ilacı kullananların %80’
den fazlasında kanda virus seviyelerinde hemen hemen hiç saptanamayacak
düzeye düşüş görülmüştür. HIV enfekte çocuklarda onaylanmamıştır.
RNA SENTEZ INHIBITORLERİ
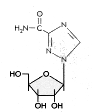
Ribavirin
Kimyasal isim: 1-β-D-ribofuranosyl-1H-1,2,4-triazole-3-carboxamide
Diğer isimleri: Virazol, Virazid, Viramid, şekil 19b
Bu ilaç pirimidin veya pürin değildir. In vitro olarak ve zayıf düzeyde in
vivo olarak non- kompetatif şekilde influenza RNA polimerazını inhibe eder.
Guanozin analoğu gibi etki edebilir ve mRNA 5’ cap formasyonunu inhibe eder.
Cap normalde metil guanozin içerir. Ancak ribavirinin polio virus
enfeksiyonlarına karşı kullanıldığı bilinir ve bu virus metil guanozin cap e
sahip değildir, bu yüzden ribavirinin etkisinde başka mekanizmalar olmalıdır.
Muhtemelen bu ilaç, viral RNA içinde hücrede enfeksiyon için onu yetersiz
hale getiren yeni dizi oluşturan mutasyonlar ortaya koyar.
Aerosol formu RSV ‘ ye karşı kullanılır ve Lassa ateşine
karşı iv olarak kullanılır. HIV’ e karşı ilk kombinasyon tedavisi
denemelerinde, ribavirinin AZT’ nin etkilerinin antagonize ettiği
bulunmuştur.
Neplanokin A
Kimyasal ismi4-Cyclopentene-1,2-diol, 3-(6-amino-9H-purin-9-yl)-5-(hydroxymethyl)-,
(1S,2R,3R)-
Diğer isimleri: dihidropropil adenine, Vidarabin
Bu ilaç, S-adenozilhomosistein hidrolazın potent bir inhibitörüdür. Ayrıca m
RNA keppingini inhibe edebilir. S-adenozilhomosistein hidrolaz
inhibitörlerinin antiviral etkisini pox, paramikso, rabdo, filo, bunya,
arena ve reovirüslere karşı gösterdiği kanıtlanmıştır. Ayrıca tat
transaktivasyon sürecini inhibe ederek HIV replikasyonuna karışır.
Sofosbuvir
Bu ilaç (Gliead sciences) hepatit C virüsünün RNA polimeraz enzimini inhibe
eder. Yeni sentezlenen viral RNA içine katılmış bir zincir sonlandırıcı
nükleotid analoğudur. Etkisi, hastanın hangi hepatit C genotipi ile enfekte
olduğuna gore değişir. US’de hastaların yaklaşık ¼’ ü hepatit C genotip 2 ve
3 ile enfektedir. Bu hastalar interferon olmadan ribavirin ve sofosbuvir
kombinasyonu ile tedavi edilir. Interferon enjeksiyon şeklinde uygulanmak
zorunda olduğu için, bu hepatit C’ nin oral tedavisinde bir ilk olacaktır.
US’ de hepatit C hastalarının %70’ den fazlası genotip 1 ile
enfektedir. 12 haftadan uzun süreli sofosbuvir ile beraber interferon+
ribavirine gereksinim duyarlar. Klinik denemelerde, önceden tedavi almamış
hastaların %90’ ında interferon ve ribavirin sofosbuvir ile kombine
alındığında tedavi sonunda virüsün kanda saptanamadığı gösterilmiştir.
|
|
MOLEKÜLER YAPI
Ribavirin |
|
|
RNA BÖLÜNME ENZİMLERİ
Ribozimler, nükleid asitlerin spesifik bölücüleri arasında katalitik olan RNA
molekülleridir. Heptazim, çok iyi korunan bölgelerde hepatit C RNA’ sını
parçalayan bir ribozimdir (böylece direnç gelişme ihtimali azalır). Hepatit C
virüsünün bilinen tüm tiplerini tanır ve keser, böylece viral replikasyonu
durdurur. Heptazim, klinik denemelerde başarılı olamamıştır.
|
| |
PROTEIN SENTEZ INHIBITORLERİ
Virüsler konak hücre translasyon mekanizmalarını kullandığı için viral protein
sentez inhibitörü olan ilaçların gelişmesinde yavaş ilerlenmiştir. Bu sınıfta
tek bir ilaç mevcuttur.
Fomivirsen
Kimyasal ismi: Antisense oligonükleotid
Diğer isimleri: ISIS 2922, Vitravene
Fomivirsen, fosforothiote stabilize ettiği 21 nükleozitten oluşan antisense
oligonükleotiddir. CMV retinitinde intraoküler enjeksiyon olarak
uygulanabilir. CMV mRNA’ sının en yakın ilk iki proteinini özellikle hibride
ederek translasyonunu önler.
|
 Şekil 20
Şekil 20
Retrovirüs proteaz etkinliğinin bir işlemi olarak proteaz POL
poliproteinin bir parçası olarak başlar ve daha sonra bir poliproteini
böler
|
PROTEIN İŞLEME INHIBITORLERİ
Proteaz inhibitörleri
Çoğu virus yapmış oldukları proteinleri bölmelidir. Yüzey
glikoproteinleri için, genellikle sekretuar yolakta (golgi cisimciği gibi)
konak proteazı ile gerçekleşir. Polimeraz veya retrovirüsler ve diğer bazı
virüslerin grup spesifik antijenleri (GAGs) gibi internal proteinler için
pol geni tarafından kodlanan bir viral proteaz mevcuttur.
HIV aspartil proteazın aktif bölgeye yönelik inhibitörleri, bilinen konak
proteolitik enzimleri ile benzer olmayan şekilde geliştirilmiştir ve bu
nedenle inhibitörler viral proteinlere spesifite göstermelidir. HIV
proteazın etkisi viral infektivitede çok önemlidir. Şu anda biz sonsuz
olarak hastalığın ilerlemesini baskılayan bir ilaç rejimi için umutluyuz (Ayrıca
bakınız anti HIV ilaçları).
Anti HIV proteaz inhibitörlerinin hepsi substrat analoğudur. Teker teker
bireysel olarak kullanıldığında, viral yükü başlangıçtaki değerinin 30-100
arasında aşağı çekebilir fakat bu inhibitörlerin suboptimal dozlarında, tek
başına kullanıldığında birkaç aydan sonra supresyon kaybı sonucu olabilir ve
proteaz genindeki çoklu mutasyon birikimi, yüksek düzey ilaç direnci verir.
Ancak, sürekli suprese olan hastalarda, direnç mutasyonları gelişmez. İlacın
seçici baskısı altında bu tarz mutasyonların gelişmesi için replikasyon
sürdürüldüğünden dolayı gibi görünmektedir.
|
|
|
Şekil 21
Saquinavir
|
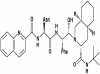
Sakinavir (SQ)
Kimyasal ismi:
cis-N-tert-butyl-decahydro-2-[2(R)-hydroxy-4-phenyl-3(S)-[[N-2-quinolylcarbonyl-L-asparaginyl]-amino]butyl]-(4aS–8aS)-isoquinoline-3(S)-carboxamide
methane sulfonate
Diğer isimleri: Invirase (sert jel kapsül), Fortovase, yumuşak jel
kapsül, (Hoffman- La Roche).
HIV proteaz tarafından tanınan bir protein yerleştiren, bölünmenin bir
hidroksietilamin geçiş konumu analoğudur. Mevcut proteaz
inhibitörlerinin en az biyoyararlanımı ve en az etkili olanıdır. Yine de
SQ+AZT+ddC T4 hücre sayısı 50-300/mm3 olan bireylerde T4 hücrelerinde
yükselişle birlikte viremiyi azaltır.
Ritonavir
Kimyasal ismi
[5S-(5R,8R,10R,11R)]-10-hydroxy-2-methyl-5-(1-methylethyl)-1-[2-(methylethyl)-4-thiazolyl]-3,6-dioxo-8,11-bis(phenylmethyl)-2,4,7,12-tetraazatridecan-13-oic
acid 5-thiazolylmethyl ester
Diğer isimleri: Norvir (Abbot Labs).
Bu ilaçlar AIDS tanımlayıcı durumları ve placebo ile
karşılaştırıldığında %58 oranında ölümü azaltır. Hastaların %25’ inde
bulantıya neden olur. Üçlü ilaç, HAART tedavisinin parçası olarak
kullanılır.
Indinavir
Kimyasal ismi
[(1S,2R,5(S)-2,3,5-trideoxy-N-(2,3-dihydro-2-hydroxy-1H-inden-1-yl)-5-[2-[[(1,1-dimethylethyl)amino]carbonyl]-4-pyridinylmethyl)-1-piperazinyl]-2-(phenylmethyl-
-erythro)pentonamide
Diğer isimleri: Crixivan (Merke)
Indinavir+ 2 anti-RT ilaç (HAART), hastaların %85’ inde PCR’ ın virüsü
saptayamayacağı ölçüde HIV’ i azaltır.
Amprenavir
Kimyasal ismi:
3S)-tetrahydro-3-furyl-N-[(S,2R)-3-(4-amino-N-isobutylbenzene-sulfonamido)-1-benzyl-2-hydroxypropyl]carbamate
Diğer isimleri: Agenerase, Prozei (Glaxo)
HAART tedavisi kombinasyonunda kullanılan diğer proteaz inhibitörüdür.
Nelfinavir
Kimyasal ismi
3S-(3R,4aR,8aR,2′S)]-2-[2′-hydroxy-3′-phenylthiomethyl-4′-aza-5′-oxo-5′-[2′-methyl-3′-hydroxyphenyl)-pentyl]-3-(N-(tert-butyl)-carboxamide)-decahydro
isoquinoline methane sulfonate
Diğer isimleri: Viracept
Lopinavir
Kimyasal ismi:
N-(4(S)-(2-(2,6-dimethylphenoxy)-acetylamino)-3(S)-hydroxy-5-phenyl-1(S)-benzylpentyl)-3-methyl-2(S)-(2-oxo(1,3-diazaperhydroinyl)butanamine
Diğer isimleri: ABT-378/r, Kaletra
Lopinavir, ritonavir ile combine 4/1 oranında diğer bir proteaz
inhibitörüdür. Bu da HAART’ ın bir parçası olarak kullanılır.
Atazanavir
Kimyasal ismi -[4-(pyridin-2-yl)phenyl]-5(S)-2,5-bis-{[N-(methoxycarbonyl)-
-tert-leucinyl]amino}-4(S)-hydroxy-6-phenyl-2-azahexane
Diğer isimleri: CGP 73547, BMS-232632, Reyataz (Bristol- Myers Squibb)
Bevimirat
Kimyasal ismi: 3-O-(3′,3′-dimethylsuccinyl) betulinic acid
Diğer isimleri: PA-457 (Panacos Pharmaceuticals)
Yukarıda tanımlanan proteaz inhibitörleri, HIV aspartil proteazın
genel inhibitörleridir. Bevimirat daha spesifiktir, ayrıca virüsün
olgunlaşması ile ilgilidir.
Bulaşıcı virionun içine hücreden tomurcuklanan HIV virüsünün montajı,
Gag proteinlerinin prekürsörü olan Pr55Gag’ a bağlıdır. Pr55Gag hücreden
tomurcuklanan virus içine monte olur ve aynı zamanda viral proteazın
Pr55Gag’ ı; immatür kapsid proteini, matrix proteini, nükleokapsid
protein ve p6’ yı içeren birkaç küçük protein böldüğü bir olgunlaşma
süreci görülür. İmmature kapsid protein (p25), matür kapsid proteinine
(p24) bölünür. Bu olgunlaşma süreci matür virionun electron yoğun konik
çekirdeğinin şekillendiği bir yapısal yeniden düzenleme ile sonuçlanır.
Bevirimat p25’ in p24’ e matürasyonu sırasında görülen bölünmeyi inhibe
eder. Kusurlu, enfeksiyoz olmayan virus parçaçıklarının oluşumunun
sonucu p25’in p24’ e bölünmesi kesintiye uğrar.
|
|
MOLEKÜLER YAPI
Indinavir |
HAART (Yüksek etkin antiretroviral
tedaviler)
Kombinasyon tedavisi (üçlü ilaç birleşimi, HAART) oldukça effektiftir ve
hastaların viral yükünü ölçülebilir seviyelerin altına düşürüebilir. Bu, HIV
replikasyonunun durdurulabildiği anlamına gelir. Bu tür bir HAART birleşimi
iki nükleozid revers transkriptaz inhibitörü zidovudin (AZT), lamivudin
(3TC) ve bir proteaz inhibitörü indinavirden meydana gelir. Tedavi öncesi 11
milyon kopya/ml kadar yüksek olabilen viral RNA düzeyleri, birkaç hafta
içinde bu ilaç kombinasyonu ile ölçülemeyecek düzeylere (biz 20 kopya/ml
kadar düşük düzeyleri ölçebiliriz) kadar düşer. Bulgular, bu hastalarda
virüsü replike eden NO? olduğunu ve bunun birkaç yıl sürdüğünü akla getirir.
Tedavi sonlandırıldığında, virus hafıza T hücrelerinde ve muhtemelen diğer
hücrelerde latent olduğu için geri gelir.
Diğer üçlü ilaç kombinasyonu iki nükleozid revers transkriptaz inhibitörü
(tenofovir), emtrisitabin ve non-nükleozid reverz transkriptaz inhibitörü
efavirenz (sustiva)’ den meydana gelir.
Tüm bu komplike ilaç rejimlerinin sorunu uyumdur. HAART bileşenleri
farklı zamanlarda alınmalıdır. Bazen gecenin ortasında yanı sıra gündüz
sırasında, farklı gıdalar ile alınması gerekir. Örneğin, sakinavirin yüksek
yağlı yemeklerle 2 saat içinde alınmaması ilacın emilememesine yol açar.
Diğer taraftan indinavir minimal gıda ile alınmalıdır.
1 hafta üç ilacı almada başarısız olan hastalarda, viral yükde yükselme
görülmüştür. Proteaz inhibitörü tedavisine uyumsuzluk; ortaya çıkan yeni
visürün alınan inhibitörlere ve ayrıca diğer proteaz inhibitörlerine
dirençli olması nedeniyle ciddi endişe uyandırmaktadır. Yeni dirençli
mutantlar diğerlerine iletilebildiği için büyük bir problemdir. Bu nedenle
uyumsuz olduğu bilinen bir hastaya, direnç bu derece hızlı ortaya
çıkabildiği ve başka kişilere yayılabildiği içim ilaç tarif edilmemelidir.
HAART çok pahalıdır. Örneğin zidovudine/lamivudin/proteaz inhibitörü
kombinasyonu yıllık 12.000 dolara mal olmaktadır.
|
|
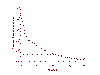 Şekil 22
Şekil 22
HAART tedavisi sonrası PCR ile serum HIV RNA seviyesi ölçümü
|

Şekil 23
X-ışını kristalografisinden türemiş bu şemada dimerik HİV aspartil
proteazı (şeritler) görülmektedir. Aspartat kalıntıları top ve sopalarla
olarak gösterilir. Dört aspartat enzimin aktif yerinde kümelenmiş
olduğunu unutmayın. Bir proteaz inhibitörü, aktif siteye bağlantı
gösterilmektedir
|
İlaç tedavisi ile HIV
enfeksiyonunda kür sağlayabilir miyiz?
Birkaç yıl önce bu olasılık alay olurdu. Daha sonra mevcut ilaçlar, viral
yükü sadece küçük bir düzeye kadar azaltırdı ve eğer ikili ilaç kombinasyonu,
CD4 hücrelerinde 50/cu yükselişi ve viral yükte 1,5 log düşüşü sağlıyorsa
iyi etki ettiği düşünülürdü. Şimdi bunların çok küçük değişiklikler olduğu
düşünülmekte. Eğer, üçlü ilaç tedavisi doğru bir şekilde alınırsa hastalarda
HIV replikasyonu durdurulabilir gibi görülmektedir. Onu latent formda
saklayan hücrelerin dönüştürülmesiyle virüsü elimine etmeyi başarabiliriz.
HIV’ in latent rezervuarları kesin olarak var olduğu için bunun zor
olabileceğini gösteren kanıtlar vardır. Bir CD4 hücresi timustan ayrıldığı
zaman, bir antijenle karşılaşabilir, aktif hale getirir ve daha sonra ölür
fakat bu hücrelerin küçük bir kısmı hafıza T hücreleri olur. Dinlenme
durumuna döner. Vücutta yıllarca kalabilirler ve HIV ile enfekte olurlarsa
provirüse saklanacaklardır. Bu hücreler bu nedenle hastalarda, HIV için bir
rezervuar oluştururlar. Bu küçük kısım hücrede enfeksiyon oranı yüksek
görülmemektedir, sığınan latent viral DNA da 1/10.000’ den azdır. Bunun
anlamı vücuttaki 1000 trilyon lenfositten sadece 10 milyonunun latent olarak
enfekte olduğudur. Fakat bu yıllarca devam edebilir ve üçlü tedavi
kombinasyonu ile dokunulmaz olacaktırlar. 3 yıldan daha uzun sure kombine
tedavi ile tedavi edilen bireylerde, latent olarak enfekte hücrelerin oranı
aynı kalmaktadır (1/10.000). ilginç olarak arşiv virüsü, hastaları enfekte
edenle aynı direnç patentine sahiptir. Bunun anlamı üç yıldan daha uzun sure
içinde muhtemelen HIV replikasyonunun yeni dizileri olmamıştır. Kötü haber
hücrelerin bu rezervuarı yıllarca sürebilir.
|

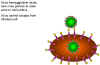
 Şekil 24
Şekil 24
İnfluenza virüsünün yaşam döngüsünde, nöraminidaz gerekliliği
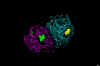
 Şekil 25
Şekil 25
İnfluenza virüsü nöraminidazı Relenza ile kompleksi. Sol: Enzim iplikler
olarak gösterilir. Relenza boşluk doldurur. Her zincirdeki dimere tek N-asetil
glukozamin kalıntısı top ve çubuk olarak gösterilir. Sağ: Enzim,
molekülünün yüzeyinde bulunan bir yarığın aktif sitede inhibitörü boşluk
dolu gösterilir.
|
PROTEIN MODIFIKASYON INHIBITORLERİ
- Glikolizasyon
2-deoksi-glukoz ve D-glukozamin in vitro olarak glikolizasyona engel olur.
Fakat şaşırtıcı olmayan biçimde in vivo olarak etkisi düşüktür.
Castanospermin (bir tür Avustralya kestanesinden türetilen doğal bir ürün)
HIV ve diğer retrovirüslerin glikolizasyonuna engel olur. Bu sinsityumlarda
belirgin bir azalmaya yol açar. Bir anti HIV ajan olarak bu ilaca olan ilgi
azalmıştır.
- Fosforilasyon
Proteinlerin fosforilsyonunu değiştirerek virüsleri hedef alan hiçbir iyi
ilaç bulunamamıştır.
- Siyalizasyon
İnfluenza virüslerin yüzeyinde iki glikoprotein bulunur: hemaglütinin ve
nöraminidaz (siyalidaz). Ikincisinin birkaç fonksiyonu vardır. Solunum
yolunda mucus sekresyonlarının dolaşmasına izin verir böylelikle yeni
hücreleri enfekte edebilir. Siyalik asit influenza reseptörü olduğu için,
enfekte hücrenin yüzeyinden ve virüsten siyalik asidin uzaklaştırılması
gerekmektedir, böylece viral partiküller kaçabilir. Nörominidaz bu nedenle
virüsün hücreden hücreye yayılmasında çok önemlidir.
Zanamivir
Kimyasal ismi: 4-guanidino-2,4-dideoxy-2,3-didehydro-N-acetylneuraminic
acid,
5-acetylamino-4-[(aminoiminomethyl)amino]-2,6-anhydro-3,4,5-trideoxy-D-glycero-D-galacto-non-2-enonic
acid
Diğer isimleri: CG 167, Relenza
Zanamivir 1997 sonbaharında açıklanan influenzaya karşı kullanılan bir
antiviral ajandır. Influenza A ve B virüsünün nöraminidazının güçlü bir
inhibitörüdür. Önceden mevcut olan, influenza tip B ‘ ye karşı
rimantadin gibi ilaçlar kadar önemlidir. Zanamivirin dizaynı
nöraminidazın üç boyutlu yapısına dayanır. Toplumdan edinilmiş tip A ve
B influenzanın zanamivir ile tedavisi, eğer ilaç erken başlanırsa sağlam
çalışma grubunda major semptomların süresini yaklaşık bir gün düşkün
hastalarda yaklaşık 3 gün kısaltır. İnfluenza B’ nin tedavisi ve
korunmada onaylanmış anti viral ilaç olmadığı için, zanamivir
influenzanın kontrolünde bir boşluğu doldurabilir. Fakat tip B olguların
sadece %35 kadarıdır. Diğer taraftan birçok zorluğu olduğunu kanıtlayan
bir yaklaşım olarak solunum yoluna ulaşması için aerosole ihtiyaç
duyulması dezavantajıdır.
Oseltamivir
Kimyasal ismi: ethyl ester of
(3R,4R,5S)-4-acetamido-5-amino-3-(1-ethylpropoxy)-1-cyclohexane-1-carboxylic
acid
Diğer isimleri: GS 4104, Ro 64-0796, Tamiflu
Diğer bir nöraminidaz inhibitörü olan oseltamivir, oral olarak
verilebilen bir karbo siklik siyalik asid analoğudur.
DİĞER HEDEFLER
Retrovirus hayat döngüsünde, enfeksiyoz virus partikülünün oluşumu için
gerekli olan spesifik proteazın hedeflenmesi oldukça başarılıdır. Önceden revers
transkriptaz inhibitörleri de başarılıydı. Fakat nükleozid analogları aynı
zamanda konağın DNA polimerazını da inhibe ettikleri için bazı yan etkilere
neden olurlar. Aksine non-nükleozid revers transkriptaz inhibitörlerinin
teropatik indeksi harikadır. Her iki durumda da monoterapi dirençli mutantların
hızlı çıkmasına yol açar. Virüsün yaşam düögüsüne karşımak için diğer muhtemel
birçok hedef inceleme altındadır ve şiphesiz amaç spesifitedir. Retrovirüsler
için yukarıda tariff edilen ilaçlara ek olarak integraz inhibitörleri geniş
kapsamlı incelenmektedir fakat henüz klinik olarak rutin tedavide değildir.
Diğer ilginç yaklaşımlar sayfanın altında bulunabilir.
|
|
WEB KAYNAKLARI
Neuraminidase Inhibitors for Treatment of Influenza A and B
Infections |
|
MOLECULAR
STRUCTURE
Castanospermine
Zanamivir Relenza
Oseltamivir |
|
|
|

 |
 Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, Viroloji Bölümüne Dönünüz
This page last changed on
Monday, June 06, 2016
Page maintained by
Richard Hunt
|


 Şekil 1 İlaçlar için hücresel
Şekil 1 İlaçlar için hücresel Şekil 1a
Şekil 1a Şekil 3
Şekil 3 Şekil 5
Şekil 5 Şekil 6
Şekil 6 Şekil 7
Şekil 7 Şekil
8
Şekil
8 Şekil 9
Şekil 9 Şekil 10
Şekil 10 Şekil 11A
Şekil 11A Şekil 12
Şekil 12 Şekil 13
Şekil 13 Şekil 14
Şekil 14 Şekil 15
Trifluorothymidine
Şekil 15
Trifluorothymidine Şekil 16
Şekil 16 Şekil 17
Şekil 17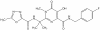 Şekil 19a
Şekil 19a Şekil 20
Şekil 20



 Şekil 24
Şekil 24





