|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGIE |
IMMUNOLOGIE |
MYCOLOGY |
PARASITOLOGY |
VIROLOGIE |
|
VIDEO LECTURE |
IMMUNOLOGIE – CHAPITRE
DIX
COMPLEXE MAJEUR D’HISTOCOMPATIBILITE (MHC ou CMH) ET T-CELL RECEPTORS (TCR)
- ROLE DANS LES REPONSES IMMUNES
Gene Mayer,
Ph.D.
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Jennifer Nyland, Ph.D.
Assistant Professor of Pathology, Microbiology and Immunology
University of South Carolina
Denis
Hudrisier, Ph.D.
Centre national de la recherche scientifique (CNRS) · Institute of
Pharmacology and Structural Biology
Université de Toulouse
|
|
EN ANGLAIS |
|
IN
PORTUGUESE |

 |
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
|
OBJECTIFS
DU COURS
Donner une vision générale du rôle du complexe majeur
d’histocompatibilité dans les réponses immunes.
Décrire la structure et la fonction des molécules du CMH de classe I et
de classe II
Discuter la nature du polymorphisme des molécules du CMH de classe I et
de classe II
Décrire la structure du récepteur à l’antigène des lymphocytes T (TCR)
Décrire la base génétique de la génération de la diversité des TCR
Discuter les rôle du complexe CD3 et des molécules de co-stimulation
Décrire la nature de la synapse immunologique
Discuter les paramètres de l’activation des cellules T
|
SURVOL HISTORIQUE
Les interactions cellule-cellule dans la réponse immunitaire adaptative sont
d'une importance capitale pour la protection contre les agents pathogènes. Ces
interactions sont orchestrées au niveau de la synapse immunologique dont les
principaux composants sont le récepteur à l’antigène des lymphocytes T (TCR) et
le complexe majeur d'histocompatibilité (CMH). La fonction principale du TCR est
de reconnaître l'antigène dans le cadre du CMH pour transmettre un signal
d'activation à l'intérieur de la cellule. Comme la liaison du peptide au CMH
n'est pas covalente, il y a plusieurs facteurs facilitant la stabilisation de la
synapse immunologique.
Les produits des gènes codés dans le CMH ont d'abord été identifiés comme étant
important dans le rejet de tissus transplantés. Par ailleurs, les gènes du CMH
se sont avérés très polymorphes (c'est à dire que, dans la population, il y
avait de nombreuses formes alléliques des gènes). Des études menées avec des
souches pures de souris ont montré que les gènes du CMH ont également été
impliqués dans le contrôle de la réponse immunitaire à la fois humorale et à
médiation cellulaire. Par exemple, certaines souches de souris pouvaient
répondre à un antigène particulier, mais d'autres souches ne le pouvaient pas
alors que ces souches ne diffèrent que par un ou plusieurs des gènes codés dans
le CMH. Des études ultérieures ont montré qu'il y avait deux sortes de molécules
codées par les gène du CMH : CMH de classe I et CMH de classe II qui sont
reconnues par les différentes classes de cellules T. Les molécules de classe I
ont été retrouvés sur toutes les cellules nucléées (sauf les globules rouges),
tandis que les molécules de classe II ont été trouvés seulement sur les cellules
présentatrices d'antigène, (APC) qui comprenaient les cellules dendritiques, les
macrophages, les lymphocytes B et quelques autres types cellulaires (Figure 1).
Il a fallu attendre la découverte de la façon dont le TCR reconnaît
l'antigène pour que le rôle des gènes du CMH dans la réponse immunitaire soit
compris. Il a été montré que le TCR montré reconnaissait des peptides
antigéniques en association avec des molécules du CMH. Les lymphocytes T
reconnaissent des portions de protéines antigéniques qui sont liées de manière
non covalente à des produits de gènes du CMH. Les lymphocytes T cytotoxiques (Tc)
reconnaîssent des peptides liés à la molécule de classe I du CMH alors que les
lymphocytes T auxiliaires (Th) reconnaissent des peptides liés à la molécule de
classe II du CMH. Les structures tridimensionnelles des molécules du CMH et le
TCR ont été déterminées par cristallographie aux rayons X pour obtenir une image
claire de la façon dont les TCR, les produits des gènes du CMH et l’antigène
pouvaient interagir ensemble.
|
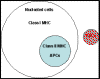 Figure 1
Figure 1
Distribution des molécules du CMH de classe I et de classe II sur les
cellules humaines
 Figure 2
Figure 2
La molécule du CMH de classe I possède trois domaines globulaires alpha
1 (jaune), alpha 2 (vert) and alpha 3 (bleu). Le domaine alpha 3 est
étroitement associé à la beta 2 microglobuline (rose), non codée par le
système du CMH. La beta 2 microglobuline est stabilisée par un pont
disulfure (rouge) et est structurée comme un domaine de type
immunoglobuline. Le site allo-antigénique qui porte les déterminants
spécifiques à chaque individu sont portés par les domaines alpha 1 et 2.
Le domaine alpha 2 possède aussi une chaîne de carbohydrates (bleu,
CHO). Il y a un groupement phosphate dans la partie cytoplasmique. La
papaïne clive la molécule au niveau de la surface externe de la membrane
plasmique.
|
STRUCTURE DES
MOLECULES DU CMH DE CLASSE I
La molécule
Les molécules du CMH de classe I sont composées
de deux chaînes polypeptidiques, une chaîne α longue et une chaîne β
courte appelée β2-microglobuline (Figure 2). La chaîne α possède
quatre régions.
-
Une région cytoplasmique, contenant de
sites de phosphorylation et de liaison à des éléments du
cytosquelette.
-
Une région transmembranaire contenant des
acides aminés hydrophobes permettant à la molécule d’être ancrée
à la membrane cellulaire.
-
Un domaine de type immunoglobuline
hautement conservé α3 qui se lie à la molécule CD8.
-
Un domaine hautement polymorphe formé par
les domaines α1 et α2 et qui forment le site de liaison du
peptide. La β2-microglobuline s’associe avec la chaîne α et
permet à la molécule de maintenir sa structure tridimensionnelle.
Le site de
liaison de l’antigène
Une analyse de la partie de la molécule du CMH
de classe I la plus variable démontre que la variabilité est plus
prononcée dans les domaines α1 et α2, qui forment la région de
liaison peptidique (Figure 3). La structure de la poche de liaison
peptidique, révélée par cristallographie aux rayons X, montre
l’existence d’une rainure composée de deux hélices α formant une
paroi de chaque côté et huit feuillets plissés β formant un plancher.
Le peptide est lié à la poche et les résidus de la poche sont en
contact avec le peptide (Figure 4). Ce sont les résidus qui sont les
plus polymorphes. La poche permet de loger des peptides d'environ
8-10 acides aminés de long. La liaison d’un peptide donné au site de
liaison dépend des acides aminés qui tapissent la poche à peptide.
Etant donné que les molécules de classe I sont polymorphes, des
molécules de CMH I différentes se lient à des peptides différents.
Chaque molécule de classe I ne lie que certains peptides et
disposera d'un ensemble de critères qu'un peptide doit avoir afin de
se lier à la poche. Ainsi, la Figure 5 montre qu’une molécule de CMH
classe I donnée se lie à des peptides qui ont une leucine (L) comme
acide aminé carboxy-terminal et une tyrosine (Y) ou une
phénylalanine (F) comme acide aminé présent en quatrième position à
partir de l’extrémité carboxy-terminale. Lorsque ces deux conditions
sont réunies, un peptide peut se lier à ce CMH, les autres acides
aminés pouvant être très divers. Une autre molécule de CMH de classe
I pourra se lier à tout peptide possédant une tyrosine (Y) comme
second acide aminé depuis l'extrémité amino-terminale et possédant
une valine (V), isoleucine (I) ou leucine (L) à l'extrémité
carboxy-terminale (figure 5). Ainsi, pour chaque molécule de classe
I, il y a certains acides aminés qui doivent être à un endroit
particulier dans le peptide pour que celui-ci puisse se lier à la
molécule du CMH en question. Ces sites dans le peptide sont appelés
les «motifs d'ancrage». Les extrémités du peptide sont enfouis à
l'intérieur des extrémités fermées de la poche de liaison peptidique
tandis que le centre est bombé pour être accessible au TCR.
Dans le locus chromosomique codant pour le CMH,
il y a 6 gènes qui codent pour des molécules de classe I HLA-A, HLA-B,
HLA-C, HLA-E, HLA-F et HLA-G. Parmi ceux-ci HLA-A, HLA-B et HLA-C
sont les plus importants et les plus polymorphes. Le tableau 1
montre le degré de polymorphisme de chacun de ces loci.
|
 Figure 3
Figure 3
La plus grande variabilité située au niveau des acides aminés
de la chaîne alpha est retrouvée dans les domaines alpha 1 et alpha 2 .
Le plus fort polymorphisme est retrouvé au niveau des acides aminés
formant le plancher et les bordures du site de liaison du peptide.
|
 Figure 4
Figure 4
a. Site de liaison peptidique des molécules du CMH de classe I.
b. Sillon de liaison montrant les résidus variables. Les résidus
variables sont regroupés au niveau du site de liaison peptidique.
 Figure 5
Figure 5
Résidus d’ancrage des peptides qui se lient au CMH de classe I (adapté
de Janeway et al. Immunobiology 6ème Edition)
|
| |
|
Table 1. Polymorphisme des gènes du
CMH de classe I |
| Locus |
Nombre
d’allèles
(allotypes) |
| HLA-A |
218 |
| HLA-B |
439 |
| HLA-C |
96 |
| HLA-E, HLA-F
and HLA-G |
Relativement peu d’allèles |
|
|
|
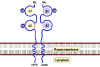 Figure 6
Les molécules du CMH de classe II sont formées par deux
polypeptides différents (alpha et beta) qui sont associés de façon non-covalente
et traversent la membrane plasmique, leurs extrémités N-terminales étant
dirigées vers l’extérieur de la cellule. Les domaines les plus proches
de la membrane plasmique de chaque polypeptide sont de type «
Immunoglobuline ». A l’exception du domaine alpha 1, tous les domaines
sont stabilisés par des ponts disulfures (rouge). Les deux chaînes alpha
et beta sont glycosylées. La chaîne beta est plus courte que la chaîne
alpha (masse moléculaire de la chaîne beta = 28,000 Da) et contient
l’essentiel du polymorphisme du CMH de classe II. Il y a aussi un
polymorphisme associé à la chaîne alpha du CMH II. Figure 6
Les molécules du CMH de classe II sont formées par deux
polypeptides différents (alpha et beta) qui sont associés de façon non-covalente
et traversent la membrane plasmique, leurs extrémités N-terminales étant
dirigées vers l’extérieur de la cellule. Les domaines les plus proches
de la membrane plasmique de chaque polypeptide sont de type «
Immunoglobuline ». A l’exception du domaine alpha 1, tous les domaines
sont stabilisés par des ponts disulfures (rouge). Les deux chaînes alpha
et beta sont glycosylées. La chaîne beta est plus courte que la chaîne
alpha (masse moléculaire de la chaîne beta = 28,000 Da) et contient
l’essentiel du polymorphisme du CMH de classe II. Il y a aussi un
polymorphisme associé à la chaîne alpha du CMH II.
 Figure 7
Figure 7
Le polymorphisme le plus fort pour la chaîne beta du CMH II se trouve au
niveau des résidus de la chaîne présents dans la région formant le site
de liaison du peptide.
|
STRUCTURE DES MOLECULES DU CMH DE CLASSE II
La molécule
Les molécules du CMH de classe II sont composées de deux chaînes
polypeptidiques α et β de taille sensiblement égale (Figure 6). Les
deux chaînes sont constituées de 4 régions:
- Une région cytoplasmique, contenant de sites de
phosphorylation et de liaison à des éléments du cytosquelette
- Une région transmembranaire contenant des acides aminés
hydrophobes permettant à la molécule d’être ancrée à la membrane
cellulaire
- Un domaine α2 hautement conservé et un domaine β2 hautement
conservé auquel se lie la molécule CD4
- Un site de liaison au peptide hautement polymorphe formé par
les domaines α1 et β1.
Le site de liaison de
l’antigène
Comme pour les molécules du CMH de classe I, l’analyse de la
partie de la molécule de CMH de classe II présentant la plus forte
variabilité a démontré que celle-ci était plus prononcée dans les
domaines α1 et β1 qui forment la poche à peptide (Figure 7). La
structure de la poche de liaison peptidique, révélée par
cristallographie aux rayons X, montre que, comme pour le CMH de
classe I, une rainure est formée par deux hélices α formant une
paroi de chaque côté et huit feuillets plissés β formant un plancher.
Les domaines α1 et β1 contribuent à la formation de la poche à
peptide. Le peptide est lié dans la poche et les résidus qui bordent
le site de liaison forment des contacts avec le peptide. Ce sont ces
résidus qui sont les plus polymorphes. La poche à peptide des
molécules du CMH de classe II est ouverte aux extrémités permettant
à des peptides plus longs (environ 13-15 acides aminés) de se fixer
dans la poche, certains acides aminés du peptide étant situés hors
du site de liaison. Le fait qu’un peptide puisse se lier ou non dans
la poche dépendra des acides aminés qui bordent le site de liaison.
Etant donné que les molécules du CMH de classe II sont polymorphes,
différentes molécules de classe II se lieront à différents types de
peptides. Comme pour le CMH de classe I, chaque molécule de CMH de
classe II liera certains peptides et possédera des critères que les
peptides devront respecter pour se lier dans le site de liaison (c’est
à dire un « motif d’ancrage »).
Dans la région chromosomique du CMH, il y a 5 loci qui codent pour
les molécules du CMH de classe II, chacun contenant un gène codant
pour une chaîne α et au moins un gène codant pour une chaîne β. Les
loci sont appelés HLA-DP, HLA –DQ, HLA-DR, HLA-DM, et HLA-DO. Parmi
ceux-ci, HLA-DP, HLA –DQ et HLA-DR sont les plus importants et les
plus polymorphes. La Table 2 montre le degré de polymorphisme de
chacun de ces loci.
|
| |
ASPECTS
IMPORTANTS DU CMH
-
Bien qu’il y ait un fort degré de polymorphisme
du CMH pour une espèce, un individu possèdera un maximum de 6
molécules de CMH de classe I et à peine plus de molécules de CMH de
classe II (en ne considérant que les loci majeurs).
-
Chaque molécule du CMH ne possède qu’un seul
site de liaison de peptide. Les différents peptides qui peuvent se
lier à une molécule de CMH donnée peuvent tous se lier au site de
liaison mais seulement un seul à la fois.
-
Comme chaque molécule du CMH est susceptible de
fixer des peptides différents, on dit que la liaison est dégénérée.
-
Le polymorphisme du CMH est déterminé seulement
au niveau germinal. Il n’y a pas de mécanismes de recombinaison
impliqués dans la génération de la diversité des molécules.
-
Les molécules du CMH sont membranaires; la
reconnaissance par les cellules T nécessite un contact
cellule-cellule.
-
Les allèles codant pour les molécules du CMH
sont co-dominants. Chaque produit de gène du CMH est exprimé à la
surface de chaque cellule nucléée.
-
Un peptide doit s’associer à une molécule
donnée du CMH exprimée par cet individu pour qu’une réponse
immunitaire ait lieu. C’est un premier niveau de contrôle.
-
Les cellules T matures doivent avoir un TCR
capable de reconnaître un peptide associé au CMH. Il s’agit du
second niveau de contrôle.
-
Les cytokines comme l’interféron-γ augmentent
le niveau d’expression du CMH.
-
Les peptides provenant du cytosol s’associent
aux molécules du CMH de classe I et sont reconnus par les cellules T
cytotoxiques. Les peptides provenant de vésicules s’associent aux
molécules du CMH de classe II et sont reconnus par les cellules T
auxiliaires.
-
Le polymorphisme du CMH est important pour la
survie des espèces.
|
Table 2. Polymorphisme des gènes du
CMH de classe II |
| Locus |
Nombre
d’allèles
(allotypes) |
HLA-DPA
HLA-DPB |
12
88 |
HLA-DQA
HLA-DQB |
17
42 |
HLA-DRA
HLA-DRB1
HLA-DRB3
HLA-DRB4
HLA-DRB5 |
2
269
30
7
12 |
| HLA-DM and
HLA-DO |
Relativement peu d’allèles |
|
| |
COMMENT LES PEPTIDES ONT-ILS ACCES
AU SITE DE LIAISON DU CMH?
Les peptides provenant du cytosol s’associent aux molécules du CMH de
classe I et sont reconnus par les cellules T cytotoxiques. Les peptides
pénètrent dans le reticulum endoplasmique (RE) et se fixent dans le site
de liaison vide des molécules du CMH de classe I. Ce complexe est alors
exporté vers la surface cellulaire en transitant par l’appareil de
Golgi. Les molécules du CMH de classe II sont exprimées en association
avec la chaîne invariante (Ii) tant qu’elles sont dans le RE et
l’appareil de Golgi. La chaîne Ii est clivée et séparée du complexe
lorsque celui-ci est dans une vésicule. Les peptides provenant de
vésicules s’associent alors aux molécules du CMH de classe II et les
complexes sont exportés vers la surface cellulaire où ils sont reconnus
par les cellules T auxiliaires.
ROLE DU TCR DANS LA REPONSE IMMUNE
Le TCR est une molécule de surface trouvée sur les lymphocytes T et
qui reconnaît l’antigène peptidique présenté dans le contexte d’une
molécule du CMH. Le TCR est organisé comme une immunoglobuline et est
membre de la superfamille des immunoglobulines. Il existe deux types de
TCR, le type prédominant αβ porté par des cellules T que l’on retrouve
surtout dans les organes lymphoides et le γδ retrouvé sur des cellules T
présentes surtout au niveau des muqueuses.
|
 Figure 8
Figure 8
Le récepteur hétérodimérique des cellules T (TCR) comporte deux
polypeptides transmembranaires, alpha et beta. Il existe deux domaines
dans la partie extracellulaire de chacune des 2 chaînes alpha et beta du
récepteur ressemblant aux domaines variables et constant des
immunoglobulines. Chaque domaine est glycosylé. IL y a une courte région
similaire à la région charnière des immunoglobulines qui connecte les
domaines de type immunoglobuline de la molécule à la partie
transmembranaire. Cette région contient des cystéines permettant de
former un pont disulfure entre les deux chaînes alpha et beta. Les
structures en hélices hydrophobes de la partie transmembranaire des deux
chaînes sont inhabituelles en cela qu’elles comportent des résidus
chargés positivement (acides aminés basiques). La chaîne alpha possède
deux résidus chargés positivement et la chaîne beta, un.
 Structure du TCR A6 lié à la molécule du CMH de
classe I complexée à un variant du peptide Y8a de la protéine Tax du
virus HTLV-I. Le peptide viral est en gris. La molécule du CMH de classe
I est représentée en bleu foncé, la beta 2 microglobuline en bleu clair.
Le TCR est représenté en vert et jaune. Y. H.Ding, B. M.Baker, D.
N.Garboczi, W. E.Biddison & D. C.Wiley MMDB Id: 11766 PDB Id: 1QSF Image
réalisée avec RasMol
Structure du TCR A6 lié à la molécule du CMH de
classe I complexée à un variant du peptide Y8a de la protéine Tax du
virus HTLV-I. Le peptide viral est en gris. La molécule du CMH de classe
I est représentée en bleu foncé, la beta 2 microglobuline en bleu clair.
Le TCR est représenté en vert et jaune. Y. H.Ding, B. M.Baker, D.
N.Garboczi, W. E.Biddison & D. C.Wiley MMDB Id: 11766 PDB Id: 1QSF Image
réalisée avec RasMol
 Figure 9
Figure 9
Réarrangement des gènes codant pour la chaîne beta du TCR.
 Structure cristallographique du complexe formé
entre un TCR humain, le peptide antigénique de la protéine HA du virus
de la grippe et la molécule du CMH de classe II. Les chaînes alpha et
beta des molécules du CMH de classe II sont représentées en bleu sombre
et clair. Le TCR est représenté en jaune et vert. Le peptide la grippe
est en gris. Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB
Id: 1FYT. Image préparée avec RasMol
Structure cristallographique du complexe formé
entre un TCR humain, le peptide antigénique de la protéine HA du virus
de la grippe et la molécule du CMH de classe II. Les chaînes alpha et
beta des molécules du CMH de classe II sont représentées en bleu sombre
et clair. Le TCR est représenté en jaune et vert. Le peptide la grippe
est en gris. Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB
Id: 1FYT. Image préparée avec RasMol |
STRUCTURE
DU T CELL RECEPTOR (TCR)
Le TCR est un hétérodimère composé d’une chaîne α et d’une chaîne β de
taille semblable (Figure 8). Chaque chaîne possède un domaine
cytoplasmique trop court pour pouvoir transduire un signal d’activation
pour la cellule. Chaque chaîne dispose d’une région transmembranaire
porteuse de résidus hydrophobes permettant l’insertion dans la membrane
cellulaire. Chaque chaîne possède un domaine constant et un domaine
variable similaires à ceux retrouvés dans les immunoglobulines. Le
domaine variable de chacune des chaînes contient des parties
hypervariables qui déterminent la spécificité pour l’antigène. Chaque
cellule T porte des TCR d’une seule spécificité (du fait d’une exclusion
allélique).
BASES GÉNÉTIQUES DE LA GÉNÉRATION DES RECEPTEURS
Les bases génétiques de la génération d’un large répertoire de
récepteurs à l’antigène pour les lymphocytes B a été précédemment
discuté (voir le chapitre consacré à la génétique des immunoglobulines).
La génération du répertoire de TCR met en jeu des mécanismes similaires.
Dans leur configuration germinale, les gènes codant pour la chaîne β du
TCR sont composés de segments de gènes V, D et J qui se réarrangent lors
de la différenciation des lymphocytes T pour produire différentes
chaînes β possibles (Figure 9). Dans leur configuration germinale, les
gènes codant pour la chaîne du TCR sont composés de segments de gènes
V et J qui se réarrangent lors de la différenciation des lymphocytes T
pour produire différentes chaînes possibles. La spécificité du TCR est
déterminée par la combinaison des chaînes α et β.
Il existe une population de lymphocytes T qui exprime un TCR composé de
chaînes γ et δ au lieu de α et β. Ces cellules T gamma/delta prédominent
dans les épithéliums des muqueuses et possèdent un répertoire
reconnaissant certains antigènes viraux ou bactériens. Les gènes codant
pour la chaîne δ ont des segments V, D et J alors que ceux codant pour
la chaîne γ ont seulement des segments V et J. Le répertoire TCR de ces
cellules est considérablement plus restreint que celui des cellules T
alpha/beta. A l’inverse des cellules T alpha/beta, les cellules T
gamma/delta reconnaissent l’antigène de façon CMH-indépendante.
ASPECTS IMPORTANTS DU TCR
-
Chaque cellule T porte des TCR d’une seule spécificité (du fait d’une
exclusion allélique).
-
Le TCR αβ reconnaît l’antigène peptidique seulement dans le contexte
d’une interaction cellule-cellule et sous une forme présentée par une
CMH donné.
-
Le TCR γδ reconnaît l’antigène de façon indépendante du CMH en réponse
à certains antigènes viraux ou bactériens.
|
TABLE 3
COMPARAISON DES PROPRIÉTÉS MAJEURES DES GENES ET DES PROTÉINES
D’IMMUNOGLOBULINES (Ig) ET DES T-CELL RECEPTOR (TCR) |
|
GENES |
|
Propriétés |
Ig |
TCR |
|
Beaucoup de VDJ, peu de C |
Oui |
Oui |
|
Réarrangements VDJ |
Oui |
Oui |
|
Les paires de V forment le site de reconnaissance de
l’antigène |
Oui |
Oui |
|
Hypermutation somatique |
Oui |
Non |
|
PROTEINES |
|
Formes transmembranaires |
Oui |
Oui |
|
Formes secrétées |
Oui |
Non |
|
Isotypes avec des fonctions diverses |
Oui |
Non |
|
Valence |
2 |
1 |
|
Adapté de Janeway et Travers,
Immunobiology |
|
|
|
|
 Figure 10 Figure 10
Le récepteur à l’antigène exprimé à la surface des lymphocytes T
contient 8 polypeptides :
(a) deux chaînes du TCR liées par un pont disulfure formant un
hétérodimère et reconnaissant le peptide associé au CMH.
(b) quatre chaînes, appelées collectivement CD3, qui s’associent à
l’hétérodimère du TCR et participe à son transport à la surface
cellulaire. Le complexe CD3 ainsi que l’homodimère formé par les chaînes
zeta transduisent le signal après la liaison de l’antigène au TCR.
|
TCR ET COMPLEXE CD3
Le TCR est étroitement associé à un groupe de 5 protéines collectivement
appelées « complexe CD3 » (Figure 10). Le complexe CD3 est composé d’une
chaîne γ, d’une chaîne δ, deux chaînes ε et deux chaînes ξ. Toutes les
protéines du complexe CD3 sont invariables et ne contribuent donc à la
spécificité de reconnaissance de l’antigène d’aucune façon. Le complexe
CD3 est nécessaire pour l’expression en surface du TCR lors du
développement des cellules T. De plus, le complexe CD3 transduit le
signal d’activation à la cellule faisant suite à l’interaction de
l’antigène avec le TCR.
|
 Figure 11
Figure 11
A. Molécules impliquées dans l’interaction entre les cellules T et les
cellules présentatrices d’antigène. Des cytokines produites par les deux
types cellulaires sont indiquées.

B. Ligands impliqués dans l’interaction entre les lymphocytes T
cytotoxiques et leurs cibles.
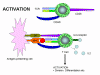 Figure
12a Figure
12a
L’activation des cellules T ne se produit que lorsque le TCR et des
molécules de co-stimulation interagissent avec leurs ligands respectifs.
 Figure 12b
Figure 12b
Une régulation négative se met en place lorsque CTLA-4 interagit avec
B7:
CTLA-4 génère des signaux négatifs d’activation
 Figure 12c
Figure 12c
L’engagement du TCR par le complexe antigène-CMH en absence de
co-stimulation peut conduire à l’anergie des cellules T.
 Figure 12d
Figure 12d
L’engagement de molécules de co-stimulation en absence d’engagement du
TCR ne conduit à aucune réponse
|
LA “SYNAPSE IMMUNOLOGIQUE”
L’interaction entre le TCR et les molécules de CMH n’est pas très forte. Des
molécules accessoires sont nécessaires pour favoriser la stabilité de
l’interaction (Figure 11a,b). Cela inclut:
-
La liaison de CD4 au CMH de classe II, qui permet l’interaction des Thelper
avec les APC.
-
La liaison de CD8 au CMH de classe I, qui permet l’interaction des CTL avec
les APC et leurs cellules cibles
-
La liaison de CD2 à l’intégrine LFA-3
-
La liaison de l’intégrine LFA-1 à ICAM-1
Les molécules accessoires sont invariables et elles ne contribuent donc pas à la
spécificité de reconnaissance de l’antigène qui est assurée par le seul TCR.
L’expression de molécules accessoires peut être augmentée en réponse à des
cytokines, ce qui représente l’une des actions possibles des cytokines dans la
modulation de la réponse immunitaire.
En plus des molécules accessoires qui contribuent à stabiliser l'interaction
entre le TCR et l'antigène associé aux molécules du CMH, d'autres molécules sont
également nécessaires pour l'activation des cellules T. Deux signaux sont en
fait requis pour l'activation des lymphocytes T : l'un est l'engagement du TCR
par le complexe Ag/CMH et l'autre, provient de l'engagement de molécules dites
de co-stimulation par leurs ligands. L'une des molécules co-stimulatrices les
plus importantes (mais pas la seule) est CD28 présente sur les cellules T qui
doit interagir avec B7-1 (CD80) ou B7-2 (CD81) présentes sur les APC. Comme les
molécules accessoires, les molécules de co-stimulation sont invariantes et ne
contribuent pas à la spécificité de l'interaction. Les interactions multiples du
TCR avec le complexe Ag/CMH, les molécules accessoires et de co-stimulation avec
leurs ligands ont lieu au sein d’uns structure subcellulaire appelée "synapse
immunologique".
Non seulement la co-stimulation est nécessaire à l'activation des cellules T,
mais, de plus, un manque de co-stimulation peut entraîner une anergie (c’est à
dire une incapacité de répondre à l'antigène) ou une régulation négative de la
réponse. La figure 12 montre les conséquences possibles de l’activation d’une
cellule T par l’un ou les deux signaux nécessaires à l'activation. L’engagement
du TCR avec le complexe Ag/CMH sans co-stimulation conduit à de l’anergie.
L’engagement de la seule molécule co-stimulatrice n'a aucun effet. L’engagement
du TCR avec le complexe Ag/CMH et des molécules de co-stimulation avec leurs
ligands conduit à l'activation. L’engagement du TCR avec le complexe Ag/CMH et
l'engagement par le ligand B7 de la molécule CTLA-4, similaire à CD28, conduit à
la régulation de la réponse. L’interaction CTLA-4/B7 envoie un signal
d'inhibition à la cellule T et non un signal d'activation. C'est l'un des moyens
que les réponses immunitaires sont régulées. CTLA-4 est exprimé sur les cellules
T tardivement dans une réponse immunitaire, ce qui permet de désactiver la
réponse.
ETAPES CLÉS DANS L’ACTIVATION DES LYMPHOCYTES T
-
Les APC doivent apprêter et présenter des peptides aux cellules T
-
Les cellules T doivent recevoir un signal de co-stimulation, habituellement
médié par CD28/B7
-
Les molécules accessoires sont nécessaires pour assister la liaison des
cellules T aux APC. (Interactions CD4/CMH classe II, CD8/CMH classe I,
LFA-1/ICAM-1 et CD2/LFA-3)
-
Les signaux émanant de la surface cellulaire doivent être transmis au noyau
via des messagers secondaires
-
Les cytokines, notamment l’IL-2, sont nécessaires pour permettre la
prolifération cellulaire.
|
TABLE 4
MOLECULES ACCESSOIRES AYANT DES FONCTIONS IMPORTANTES |
|
Sur les cellules T |
Ligand sur les cellules
partenaires |
|
CD4 sur les cellules T auxiliaires |
Molécules du CMH II |
|
CD8 sur les cellules T cytotoxiques |
Molécules du CMH I |
|
LFA-2 (CD2) |
LFA-3 |
|
LFA-1 |
ICAM-1, ICAM-2 |
|
LFA = Leukocyte
Function-associated Antigen |
|
ICAM = Intercellular Adhesion
Molecule |
|
|


|
 Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
This page last changed on
Tuesday, July 30, 2013
Page maintained by
Richard Hunt
Please report any problems to
richard.hunt@uscmed.sc.edu
|

 Figure 1
Figure 1 Figure 3
Figure 3 Figure 4
Figure 4 Figure 6
Les molécules du CMH de classe II sont formées par deux
polypeptides différents (alpha et beta) qui sont associés de façon non-covalente
et traversent la membrane plasmique, leurs extrémités N-terminales étant
dirigées vers l’extérieur de la cellule. Les domaines les plus proches
de la membrane plasmique de chaque polypeptide sont de type «
Immunoglobuline ». A l’exception du domaine alpha 1, tous les domaines
sont stabilisés par des ponts disulfures (rouge). Les deux chaînes alpha
et beta sont glycosylées. La chaîne beta est plus courte que la chaîne
alpha (masse moléculaire de la chaîne beta = 28,000 Da) et contient
l’essentiel du polymorphisme du CMH de classe II. Il y a aussi un
polymorphisme associé à la chaîne alpha du CMH II.
Figure 6
Les molécules du CMH de classe II sont formées par deux
polypeptides différents (alpha et beta) qui sont associés de façon non-covalente
et traversent la membrane plasmique, leurs extrémités N-terminales étant
dirigées vers l’extérieur de la cellule. Les domaines les plus proches
de la membrane plasmique de chaque polypeptide sont de type «
Immunoglobuline ». A l’exception du domaine alpha 1, tous les domaines
sont stabilisés par des ponts disulfures (rouge). Les deux chaînes alpha
et beta sont glycosylées. La chaîne beta est plus courte que la chaîne
alpha (masse moléculaire de la chaîne beta = 28,000 Da) et contient
l’essentiel du polymorphisme du CMH de classe II. Il y a aussi un
polymorphisme associé à la chaîne alpha du CMH II.  Figure 7
Figure 7 Figure 8
Figure 8 Figure 10
Figure 10 Figure 11
Figure 11 









