|
|
|
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
|
IMUNOLOGIA
– CAPÍTULO DEZ
COMPLEXO
PRINCIPAL DE HISTOCOMPATIBILIDADE (MHC) E RECEPTORES DE CÉLULA T – PAPEL NAS
RESPOSTAS IMUNES
Dr.
Gene Mayer
Professor Emeritus
University of South Carolina School of Medine
Tradução:
PhD. Myres Hopkins
|
|
EM INGLÊS |
|
|
Dê a
sua opinião
CONTATO |
|
BUSCA |
E-MAIL
DR MYRES HOPKINS |
|
ESCOLA DE MEDICINA DA
UNIVERSIDADE DA CAROLINA DO SUL |

 |
|
|
|
OBJETIVOS
Fornecer uma visão geral do papel do complexo principal de
histocompatibilidade nas respostas imunes.
Descrever a estrutura e função das moléculas de MHC classe I e II.
Discutir a natureza dos polimorfismos nas moléculas de MHC de classe I e
II.
Descrever a estrutura do receptor para antígenos em célula T.
Discutir a base genética da geração da diversidade de TCR.
Discutir o papel do complexo CD3 e moléculas co-estimuladoras.
Descrever a natureza da sinapse imunológica.Discutir os requisitos para
a ativação da célula T.
|
RESENHA HISTÓRICA
Produtos gênicos
codificados no Complexo Principal de Histocompatibilidade foram inicialmente
identificados como sendo importantes na rejeição a tecidos transplantados. Além
disso, genes no MHC foram considerados altamente polimórficos (i.e. na população
existem muitas formas alélicas diferentes dos genes). Estudos de endocruzamento
em camundongos mortraram que genes no MHC também estavam envolvidos no contrôle
tanto da respostas imune humoral como resposta na mediada por células. Por
exemplo, algumas linhagens de camundongos podiam responder a um antígeno
particular mas outras linhagens não e essas linhagens diferiam somente em um ou
mais genes do MHC. Estudos subsequentes mostraram que existiam dois tipos de
moléculas codificadas pelo MHC: Moléculas de classe I e de classe II. Moléculas
de classe I foram encontradas em todas a células nucleadas (não em células
vermelhas do sangue) enquanto que moléculas de classe II foram encontradas
somente nas células apresentadoras de antígenos (APCs), que incluem células
dendríticas, macrófagos, células B e alguns outros tipos (Figura 1).
Somente após a descoberta
de como o receptor de célula T (TCR) reconhece o antígeno é que o papel dos
genes de MHC na resposta imune foi compreendido. Foi demonstrado que o TCR
reconhece peptídios antigênicos em associação com moléculas de MHC. Células T
reconhecem porções de proteínas antigênicas que são ligadas covalentemente a
produtos dos genes de MHC. Células T citotóxicas (Tc) reconhecem peptídios
ligados a moléculas de MHC classe I e células T auxiliares (Th) reconhecem
peptídios ligados a moléculas de MHC classe II. As estruturas tridimencionais
das moléculas de MHC e TCR foram determinadas por cristalografia de raios X de
forma que pudemos ter uma visão clara de como os produtos de genes de TCR, MHC e
antígeno interagem.
|
 Figura 1
Figura 1
Distribuição das moléculas de MCH classe I e II nas células humanas
 Figura 2
Figura 2
A molécula de MHC classe 1 tem três domínios globulares:
alfa 1 (amarelo), alfa 2 (verde) e alfa 3 (azul). O domínio alfa 3 é
estreitamente associado com com a molécula não codificada pelo MHC beta
2 microglobulina (rosa). Esta última é estabilizada pela ponte
dissulfeto (vermelha) e é semelhante a um domínio de imunoglobulina na
estrutura tridimensional. Os sítios aloantigênicos que carreiam
determinantes específicos para cada indivíduo estão nos domínios alfa 1
e 2. O último também tem uma cadeia de carboidrato (azul, CHO). Existe
um fosfato no domínio citoplasmático. Papaína cliva próximo da
superfície externa da membrana plasmática. |
EStruturA DE MOLÉCULAS DE MHC CLASSE I
As moléculas de MHC classe I são compostas
de duas cadeias polipeptídicas: Uma longa cadeia
α
e uma curta cadeia β
chamada β2-microglobulina
(figura 2). A cadeia α
tem quatro regiões: Primeiro, uma região citoplasmática, contendo
sítios de fosforilação e de ligação a elementos do citoesqueleto.
Segundo, uma região transmembrana contendo aminoácidos hidrofóbicos
pelos quais a molécula é ancorada na membrana celular. Terceiro, um
domínio altamente conservado tipo imunoglobulina
α3
ao qual se liga CD8. Quarto, uma região de ligação a peptídio altamente
polimórfica formada a partir dos domínios
α1
e α2.
A β2-
microglobulina se associa com a cadeia
α
e auxilia a manter a conformação apropriada da molécula.
. Uma
análise de qual parte das moléculas de MHC classe I é mais variável
demonstra que a variabilidade é mais pronunciada nos domínios
α1e
α2,
que compreende a região de ligação ao peptídio (Figura 3). A estrutura
da fenda de ligação, revelada pela cristalografia de raios X, mostra que
é composta de duas α
helices formando uma parede de cada lado e oito lâminas de folha-beta
formando um assoalho. O peptídio é ligado no interior da fenda e os
resíduos que a cobrem fazem contato com o peptídio (Figura 4). Esses
são os resíduos que são mais polimórficos. A fenda irá acomodar
peptídios com comprimento de aproximadamente 8-10 aminoácidos. Se um
peptídio em particular vai ligar ou não à fenda vai depender dos
aminoácidos que cobrem a fenda. Devido ao fato de moléculas de classe I
serem polimórficas, moléculas de classe I diferentes se ligarão a
peptídios diferentes. Cada molécula de classe I irá se ligar somente a
certos peptídios e haverá um conjunto de requisitos que o peptídio deve
cumprir para se ligar à fenda. Por exemplo, Figura 5 mostra que uma
molécula de classe I irá se ligar a peptídios que tenham uma leucina (L)
como aminoácido no terminal carboxílico e tirosina (Y) ou fenilalanina
(F) como 4º aminoácido a partir do terminal carboxílico. Se essas duas
condições são cumpridas um peptídio irá se ligar, independentemente de
quaisquer que sejam os outros aminoácidos. Similarmente uma molécula de
classe I diferente irá se ligar a qualquer peptídio que tenha uma
tirosina (Y) como segundo aminoácido a partir do terminal amínico e uma
valina (V), isoleucina (I) ou leucina (L) no terminal carboxílico
(Figura 5). Assim, para cada molécula de classe I há certos aminoácidos
que precisam estar em locais determinados no peptídio para se ligar à
molécula de MHC. Essas regiões no peptídio são chamadas de “regiões de
ancoragem”.
No
MHC há 6 genes que codificam moléculas de classe I: HLA-A, HLA –B,
HLA-C, HLA-E, HLA-F e HLA-G. Entre estas HLA-A, HLA –B e HLA-C são as
mais importantes e são as mais polimórficas. A tabela 1 mostra o grau de
polimorfismo em cada um desses loci.
|
 Figura 3 A maior parte da variabilidade de aminoácidos em posições
diferentes ao longo da cadeia alfa de moléculas de MHC classe I ocorre
nas regiões alfa 1 e alfa 2. O maior polimorfismo é encontrado em
aminoácidos que limitam a parede e o assoalho da fenda que liga os
peptídios.
Figura 3 A maior parte da variabilidade de aminoácidos em posições
diferentes ao longo da cadeia alfa de moléculas de MHC classe I ocorre
nas regiões alfa 1 e alfa 2. O maior polimorfismo é encontrado em
aminoácidos que limitam a parede e o assoalho da fenda que liga os
peptídios. |
 Figura 4
Figura 4
a. Fenda de ligação ao peptídio de moléculas de MHC classe I.
b. Fenda ressaltando resíduos altamente variáveis. Os resíduos variáveis
se aglomeram em volta do bolso de ligação do peptídio.
 Figura 5
Figura 5
Regiões de ancoragem em peptídios que se ligam a moléculas de MHC classe
I (adaptado de Janeway et al. Imunobiologia 6th Edition).
|
| |
|
Tabela 1. Polimorfismo de genes de
MHC classe I |
| Locus |
Número
of alelos
(alotipos) |
| HLA-A |
218 |
| HLA-B |
439 |
| HLA-C |
96 |
| HLA-E, HLA-F
e HLA-G |
Relativamente poucos alelos |
|
|
CHIME

Apresentação do Chime mostrando as regiões de variabilidade de moléculas
de MCH I e a interação da cadeia alfa com outras sub-unidades do
complexo MHC I e o peptídio ligado (requer
plugin do Chime.
Baixe o Chime
aqui) |
 Figura 6
Moléculas de MHC classe II compreendem dois
peptídios não idênticos (alfa e beta) que são associados não
covalentemente e atravessam a membrana plasmática com o terminal N para
fora da célula. Os domínios mais próximos da membrana em cada cadeia
estão relacionados estruturalmente com imunoglobulinas. Com a exceção do
domínio alfa 1, todos os domínios são estabilizados por pontes de
sulfeto (vermelho). Ambas as cadeias alfa e beta são glicosiladas. A
cadeia beta é mais curta do que a cadeia alfa (MW de beta = 28,000) e
contém os sítios aloantigênicos. Há algum polimorfismo na cadeia alfa de
algumas moléculas de MHC II
Figura 6
Moléculas de MHC classe II compreendem dois
peptídios não idênticos (alfa e beta) que são associados não
covalentemente e atravessam a membrana plasmática com o terminal N para
fora da célula. Os domínios mais próximos da membrana em cada cadeia
estão relacionados estruturalmente com imunoglobulinas. Com a exceção do
domínio alfa 1, todos os domínios são estabilizados por pontes de
sulfeto (vermelho). Ambas as cadeias alfa e beta são glicosiladas. A
cadeia beta é mais curta do que a cadeia alfa (MW de beta = 28,000) e
contém os sítios aloantigênicos. Há algum polimorfismo na cadeia alfa de
algumas moléculas de MHC II
 Figura 7
Figura 7
O
maior polimorfismo de cadeia beta de moléculas de MHC classe II é
encontrado entre os aminoácidos na região de beta 1 que cobre a parede e
o assoalho da fenda que liga o peptídio. |
EStruTURA DE MOLÉCULAS DE mhc classe ii
Moléculas de
MHC classe II são compostas de duas cadeias polipeptídicas uma
α
e uma β de tamanho
aproximadamene igual (Figura 6). Ambas as cadeias têm quatro regiões:
primeiro, uma região citoplasmática contendo regiões de fosforilação e
elementos de ligação ao citoesqueleto; segundo, uma região transmenbrana
contendo aminoácidos hidrofóbicos pelos quais a molécula é ancorada na
membrana celular, terceiro, um domínio α2
altamente conservado e um domínio
β2
altamente conservado ao qual se liga CD4, e uma região de ligação a
peptídio altamente polimórfica formada pelos domínios
α1
e
β1.
Assim como no caso das moléculas de MHC Classe I, uma
análise de qual parte das moléculas
de MHC classe II é mais variável demonstra que a
variabilidade é mais pronunciada nos domínios
α1
e
β1,
que compreende a região de ligação ao peptídio (Figura 7). A estrutura
da fenda de ligação ao peptídio, revelada por cristalografia de raios X,
mostra que, como nas moléculas de MHC classe I, a fenda é composta de
duas
α
helices formando uma parede de cada lado e oito
oito
lâminas de folha-beta formando um assoalho.
Ambas as cadeias
α1
e
β1
contribuem para a estrutura da fenda de ligação ao peptídio. O peptídio
se liga à fenda e os resíduos que cobrem a fenda fazem contato com o
peptídio.
Esses são os resíduos que são mais polimórficos.
A fenda de moléculas de Classe II é aberta em um dos
lados de forma que esta pode acomodar peptídios mais longos de
aproximadamente 13-25 aminoácidos com alguns dos aminoácidos localizados
do lado de fora da fenda. Se um peptídio particular irá ligar à fenda ou
não vai depender dos aminoácidos que cobrem a fenda. Devido ao fato de
que moléculas de classe I são polimórficas, diferentes moléculas de
classe II irão ligar diferentes peptídios. Assim como no caso das
moléculas de classe I, cada molécula de classe II irá ligar somente
certos peptídios e haverá um conjunto de critérios que um peptídio deve
cumprir para se ligar à fenda ( (i.e. “regiões
de ancoragem”).
No MHC há 5 loci que codificam moléculas de classe II, cada um deles
contendo um gene para uma cadeia
α
e pelo menos um gene para uma cadeia β.
Os loci são designados como HLA-DP, HLA –DQ, HLA-DR, HLA-DM, e HLA-DO.
Dentre esses, HLA-DP, HLA –DQ, e HLA-DR são os mais importantes e os
mais polimórficos. Tabela 2 mostra o grau de polimorfirmo de cada um
desses loci.
|
| |
Important
Aspects of MHC
Although there is a high degree of polymorphism for a species, an
individual has maximum of six different class I MHC products and only
slightly more class II MHC products (considering only the major loci).
Each MHC molecule has only one binding site. The different
peptides a given MHC molecule can bind all bind to the same site, but
only one at a time.
Because each MHC molecule can bind many different peptides, binding is
termed degenerate.
MHC polymorphism is determined only in the germline. There are no
recombinational mechanisms for generating diversity.
MHC molecules are membrane-bound; recognition by T cells requires
cell-cell contact.
Alleles for MHC genes are co-dominant. Each MHC gene product is
expressed on the cell surface of an individual nucleated cell.
A peptide must associate with a given MHC of that individual, otherwise
no immune response can occur. That is one level of control.
Mature T cells must have a T cell receptor that recognizes the peptide
associated with MHC. This is the second level of control.
Cytokines (especially interferon-γ) increase level of expression of MHC.
Peptides from the cytosol associate with class I MHC and are recognized
by Tc cells. Peptides from within vesicles associate with class II
MHC and are recognized by Th cells.
Polymorphism in MHC is important for survival of the species.
|
Tabela 2. Polimorfismo de genes de
MHC classe II |
| Locus |
Número
de alelos
(alotipos)
|
HLA-DPA
HLA-DPB |
12
88 |
HLA-DQA
HLA-DQB |
17
42 |
HLA-DRA
HLA-DRB1
HLA-DRB3
HLA-DRB4
HLA-DRB5 |
2
269
30
7
12 |
| HLA-DM e HLA-DO |
Relativamente poucos alelos |
|
| |
|
|
 Figura 8
Figura 8
O heterodímero receptor de célula T compreende duas glicoproteínas
transmembrana e as cadeias alfa e beta. Há dois domínios na parte
externa de cada cadeia e estas se parecem com as regiões variáveis e
constantes da imunoglobulina. Há cadeias de açúcares em cada domínio.
Há uma pequena sequência semelhante à região de dobradiça que conecta os
domínios tipo domínio de imunoglobulina à sequência transmembrana. Esta
contém cisteínas que formam uma ponte dissulfeto. As estruturas
helicoidais hidrofóbicas transmembrana são peculiares por conterem
aminoácidos carregados positivamente (aminoácidos básicos). A cadeia
alfa tem dois resíduos carregados positivamente enquanto a cadeia beta
tem um.
 Estrutura de receptor de célula A6-T ligado a molécula de MHC classe I
complexada com um peptídio alterado Htlv-1 Peptídio Tax Y8a. O peptídio
HIV é mostrado em cinza. A molécula de MHC classe I está em azul escuro,
a microglobulina beta 2 associada está em azul claro. O receptor de
célula T está em verde e amarelo.
Y. H.Ding, B. M.Baker, D. N.Garboczi, W. E.Biddison & D. C.Wiley MMDB
Id: 11766 PDB Id: 1QSF Imagem preparada usando RasMol
Estrutura de receptor de célula A6-T ligado a molécula de MHC classe I
complexada com um peptídio alterado Htlv-1 Peptídio Tax Y8a. O peptídio
HIV é mostrado em cinza. A molécula de MHC classe I está em azul escuro,
a microglobulina beta 2 associada está em azul claro. O receptor de
célula T está em verde e amarelo.
Y. H.Ding, B. M.Baker, D. N.Garboczi, W. E.Biddison & D. C.Wiley MMDB
Id: 11766 PDB Id: 1QSF Imagem preparada usando RasMol
 Figura 9
Figura 9
Rearranjo dos genes de cadeia beta de TCR |
ESTRUTURA DO RECEPTOR DE CÉLULA t (TCR)
O TCR é um heterodímero composto de
uma cadeia α e uma
β de aproximadamente
igual tamanho (Figura 8). Cada cadeia tem uma cauda citoplasmática
curta mas de tamanho suficiente para transduzir um sinal de ativação
para a célula. Ambas as cadeias têm uma região transmembrana que
compreende os aminoácidos hidrofóbicos pelos quais a molécula é ancorada
na membrana celular. Ambas as cadeias têm uma região constante e uma
região variável semelhante às cadeias de imunoglobulina. A região
variável de ambas as cadeias contêm regiões hipervariáveis que
determinam a especificidade para o antígeno. Cada célula T carrega um
TCR de uma única especificidade (i.e. há exclusão alélica).
A base genética para a geração da grande variedade de
receptores de antígenos nas células B foi discutida anteriormente (veja
aula sobre genética das Ig). A geração da grande variedade de TCRs é
conseguida por mecanismos similares. Os genes da linhagem germinaativa
para os genes β de TCR
são compostos de segmentos gênicos V, D e J que se rearranjam durante o
desenvolvimento da célula T para produzir muitas cadeias β
de TCR diferentes (Figura 9). Os genes α
da linhagem germinativa para cadeia α
de TCR são compostos de segmentos V e J que se rearranjam para produzir
as cadeias α. A especificidade do TCR é
determinada pela combinação de cadeias α e
β.
Há uma pequena população de células T que expressam TCRs
que têm cadeias γ e
δ ao invés de cadeias α
e β. Essas células
gama/delta predominam no epitélio de mucosas e têm um repertório
tendencioso para antígenos bacterianos e virais. Os genes para cadeias
δ têm segmentos gênicos V, D e J enquanto que
genes para cadeias γ têm
apenas segmentos V e J mas o repertório é consideravelmente menor do que
o das células alfa/beta. As células gama/delta reconhecem antígenos de
maneira MHC-independente, ao contrário das células T alfa/beta.
|
TABELA 3
COMPARAÇÃO ENTRE AS PROPRIEDADES PRINCIPAIS DOS GENES E PROTEÍNAS DA
IMUNOGLOBULINA (Ig) E DOS RECEPTORES DE CÉLULAS T (TCR) |
|
GENES |
|
Propriedades |
Ig |
TCR |
|
Muitas VDJs, Poucas C's |
Sim |
Sim |
|
Rearranjo VDJ |
Sim |
Sim |
|
Pares V formam região de reconhecimento antigênico |
Sim |
Sim |
|
Hipermutação somática |
Sim |
Não |
|
PROTEÍNAS |
|
Formas transmembrana |
Sim |
Sim |
|
Formas secretoras |
Sim |
Não |
|
Isotipos com funções distintas |
Sim |
Não |
|
Valência |
2 |
1 |
|
Adaptado de Janeway e Travers,
Imunobiologia |
|
 Estrutura cristalina de um complexo de um receptor de célula T humana,
peptídio antigênico de influenza Ha e uma Molécula de MHC Classe II. As
cadeias alfa e beta das moléculas de MHC II estão em azul escuro e
claro. O receptor de célula T está em amarelo e verde. O peptídio de
influenza está em cinza.
Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB Id: 1FYT.
Imagem preparada usando RasMol
Estrutura cristalina de um complexo de um receptor de célula T humana,
peptídio antigênico de influenza Ha e uma Molécula de MHC Classe II. As
cadeias alfa e beta das moléculas de MHC II estão em azul escuro e
claro. O receptor de célula T está em amarelo e verde. O peptídio de
influenza está em cinza.
Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB Id: 1FYT.
Imagem preparada usando RasMol |
|
|
 Figura 10
Figura 10
O receptor de antígenos de superfície de célula T
compreende oito proteínas.
(a) Duas cadeias do receptor de célula T ligadas por pontes dissulfeto
que formam um heterodímero. Estas reconhecem peptídios associados com
moléculas de MHC.
(b) Quatro cadeias coletivamente denominadas de CD3, que se associam com
o dímero receptor de célula T e participam no seu transporte à
superfície da célula. O complexo CD3 junto com as cadeias zeta, que
formam um heterodímero, tranduzem o sinal depois que o antígeno é ligado.
|
COMPLEXO TCR E CD3
O TCR está íntimamente associado com
um grupo de 5 proteínas coletivamente chamadas de complexo CD3 (Figura 10).
O complexo CD3 é composto de uma cadeia γ, uma
δ, duas ε e 2 ξ. Todas
as proteínas do complexo CD3 são invariantes e elas não contribuem para a
especificidade de jeito nenhum. O complexo CD3 é necessário para a
expressão na superfície celular do TCR durante o desenvolvimento da célula
T. Além disso, o complexo CD3 transduz sinais de ativação para a célula após
a interação do antígeno com o TCR.
|
 Figura 11
Figura 11
A. Moléculas envolvidas na interação entre células T e células
apresentadoras de antígeno. Algumas citocinas produzidas por cada célula
são mostradas

B. Ligantes envolvidos na interação de células T citotóxicas e suas
células-alvos.
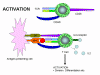



Figura 12
Moléculas envolvidas na interação entre células T e células
apresentadoras de antígeno. Algumas citocinas produzidas por cada célula
são mostradas
|
A “SINAPSE IMUNOLÓGICA”
A interação entre o TCR e moléculas
de MHC não é muito forte. Moléculas acessórias são necessárias para ajudar a
estabilizar a interação (Figura 11). Estas incluem: 1) CD4 ligando-se a MHC de
Classe II, que assegura que células Th somente interajam com APCs; 2) CD8
ligando-se a MHC classe I, que assegura que células Tc possam interagir com
células alvo; 3) CD2 ligando-se a LFA-3 e 4) LFA-1 ligando-se a ICAM-1. As
moléculas acessórias são invariantes e não contribuem para a especificidade da
interação, que é apenas determinada pelo TCR. A expressão de moléculas
acessórias pode ser aumentada em resposta a citocina, que é uma maneira pela
qual citocinas modulam as respostas imunes.
Além das moléculas acessórias que ajudam a estabilizar a interação entre o TCR e
antígeno em associação com moléculas de MHC, outras moléculas são também
necessárias para a ativação de células T. Dois sinais são necessários para a
ativação de células T – um é a união do TCR com Ag/MHC e o outro sinal vem da
união de moléculas co-estimulatórias com seus ligantes. Uma das mais importantes
(mas não a única) molécula co-estimulatória é CD28 em células T que precisam
interagir com B7-1 (CD80) ou B7-2 (CD81) em APCs . Assim como nas moléculas
acessórias, as moléculas co-estimulatórias são invariantes e não contribuem para
a especificidade da interação. As interações múltiplas do TCR com Ag/MHC e as
moléculas acessórias e co-estimulatórias com seus ligantes têm sido denominadas
de “sinapse imunológica”.
A co-estimulação não é somente necessária para a ativação das células T. Uma
falta de co-estimulação pode resultar em anergia (i.e., inabilidade de responder
a antígeno) ou regulação negativa da resposta. Figura 12 mostra os possíveis
resultados de uma célula T recebendo um ou ambos os sinais necessários para a
sua ativação. A união do TCR com Ag/MHC em condições de não co-estimulação leva
à anergia. A união somente da molécula co-estimulatória não tem efeito. A união
do TCR com Ag/MHC e as moléculas co-estimulatória com seus ligantes leva à
ativação. A união do TCR com Ag/MHC e a união do ligante B7 com CTLA-4,
moléculas similares a CD28, levam à regulação negativa da resposta. A interação
CTLA-4/B7 envia um sinal inibidor à célula T ao invés de um sinal ativador. Esta
é uma das maneiras pelas quais as respostas imunes são reguladas. CTLA-4 é
expressa nas células T mais tarde em uma resposta imune e isso ajuda a desligar
a resposta.
ETAPAS CHAVE DA ATIVAÇÃO
DE CÉLULAS T
-
APC deve processar e
apresentar peptídios às células T
-
Células T devem receber um sinal co-estimulador – usualmente vindo de
CD28/B7
-
Moléculas acessórias de adesão devem auxiliar a estabilizar a ligação de
células T e APC (CD4/MHC classe II, CD8/MHC classse I, LFA-1/ICAM-1 e
CD2/LFA-3)
-
Sinais de superfície celular devem ser transmitidos para o núcleo via
mensageiros secundários.
-
Citocinas, incluindo IL-2, ajudam a dirigir a divisão celular
|
TABELA 4
MOLÉCULAS ACESSÓRIAS IMPORTANTES |
|
Molécula de célula T |
Ligante na segunda célula |
|
CD4 em células T auxiliares |
Moléculas de MHC classe II |
|
CD8 em células T citotóxicas |
Moléculas de MHC classe I |
|
LFA-2 (CD2) |
LFA-3 |
|
LFA-1 |
ICAM-1, ICAM-2 |
|
LFA = Antígeno associado a função leucocitária |
|
ICAM = Molécula de adesão intercelular |
|
|


|
 Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Esta página foi modificada em
Página mantida por
Richard Hunt
Por favor, relate quaisquer problemas para
Richard Hunt
|

 Figura 1
Figura 1 Figura 3 A maior parte da variabilidade de aminoácidos em posições
diferentes ao longo da cadeia alfa de moléculas de MHC classe I ocorre
nas regiões alfa 1 e alfa 2. O maior polimorfismo é encontrado em
aminoácidos que limitam a parede e o assoalho da fenda que liga os
peptídios.
Figura 3 A maior parte da variabilidade de aminoácidos em posições
diferentes ao longo da cadeia alfa de moléculas de MHC classe I ocorre
nas regiões alfa 1 e alfa 2. O maior polimorfismo é encontrado em
aminoácidos que limitam a parede e o assoalho da fenda que liga os
peptídios. Figura 6
Moléculas de MHC classe II compreendem dois
peptídios não idênticos (alfa e beta) que são associados não
covalentemente e atravessam a membrana plasmática com o terminal N para
fora da célula. Os domínios mais próximos da membrana em cada cadeia
estão relacionados estruturalmente com imunoglobulinas. Com a exceção do
domínio alfa 1, todos os domínios são estabilizados por pontes de
sulfeto (vermelho). Ambas as cadeias alfa e beta são glicosiladas. A
cadeia beta é mais curta do que a cadeia alfa (MW de beta = 28,000) e
contém os sítios aloantigênicos. Há algum polimorfismo na cadeia alfa de
algumas moléculas de MHC II
Figura 6
Moléculas de MHC classe II compreendem dois
peptídios não idênticos (alfa e beta) que são associados não
covalentemente e atravessam a membrana plasmática com o terminal N para
fora da célula. Os domínios mais próximos da membrana em cada cadeia
estão relacionados estruturalmente com imunoglobulinas. Com a exceção do
domínio alfa 1, todos os domínios são estabilizados por pontes de
sulfeto (vermelho). Ambas as cadeias alfa e beta são glicosiladas. A
cadeia beta é mais curta do que a cadeia alfa (MW de beta = 28,000) e
contém os sítios aloantigênicos. Há algum polimorfismo na cadeia alfa de
algumas moléculas de MHC II Figura 7
Figura 7 Estrutura cristalina de um complexo de um receptor de célula T humana,
peptídio antigênico de influenza Ha e uma Molécula de MHC Classe II. As
cadeias alfa e beta das moléculas de MHC II estão em azul escuro e
claro. O receptor de célula T está em amarelo e verde. O peptídio de
influenza está em cinza.
Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB Id: 1FYT.
Imagem preparada usando RasMol
Estrutura cristalina de um complexo de um receptor de célula T humana,
peptídio antigênico de influenza Ha e uma Molécula de MHC Classe II. As
cadeias alfa e beta das moléculas de MHC II estão em azul escuro e
claro. O receptor de célula T está em amarelo e verde. O peptídio de
influenza está em cinza.
Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB Id: 1FYT.
Imagem preparada usando RasMol Figura 10
Figura 10 Figura 11
Figura 11 










