|
|
|
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
|
IMUNOLOGIA –
CAPÍTULO NOVE
CÉLULAS ENVOLVIDAS
NAS RESPOSTAS IMUNES E NO RECONHECIMENTO DO ANTÍGENO
Dr.
Gene Mayer
Professor Emeritus
University of South Carolina School of Medine
Tradução:
PhD. Myres Hopkins
|
|
EM INGLÊS
|
|
|
|
Dê a
sua opinião
CONTATO |
|
BUSCA |
|
E-MAIL
DR MYRES HOPKINS |
|
ESCOLA DE MEDICINA DA
UNIVERSIDADE DA CAROLINA DO SUL |
|

 |
|
|
|
OBJETIVOS
Fornecer uma visão geral dos tipos de interações celulares e moléculas
necessárias à imunidade específica
Descrever a imunidade específica e as células envolvidas
Célula
Sanguínea branca
(linfócito) em vaso capilar (MET x16,210)
©
Dennis Kunkel Microscopy, Inc.
Usado
com permissão |
VISÃO
GERAL
O sistema imune se desenvolveu para proteger o hospedeiro contra
patógenos e outras substâncias estranhas. A discriminaçãodo próprio e não
próprio é um dos marcos do sistema imune. Há dois locais principais onde os
patógenos residem: Extra-celularmente, nos espaços dos tecidos ou intra-celularmente,
dentro de uma célula hospedeira e o sistema imune tem maneiras diferentes de
lidar com patógenos nesses locais.
Patógenos extra-celulares
Anticorpos são a defesa primária contra patógenos extra-celulares e eles
funcionam de três maneiras principais:
Neutralização (Figura 1a)
Ao se ligarem com o patógeno ou à substância estranha os anticorpos podem
bloquear a associação do patógeno com seus alvos. Por exemplo, anticorpos contra
toxinas bacterianas podem impeder a ligação da toxina às células hospedeiras
próximas ao tornar a toxina inócua. Similarmente, anticorpos que se ligam a
patógenos virais ou bacterianos podem impeder a ligação do patógeno ao seu alvo
nas proximidades impedindo a infecção ou colonização.
Opsonização (Figura 1b)
Oanticorpo ao se ligar ao patógeno ou à substãncia estranha pode opsonizar o
material e facilitar sua captação e destruição pelas células fagocíticas. A
região Fc do anticorpo interage com os receptores Fc nas células fagocíticas
tornando o patógeno mais facilmente fagocitável.
Ativação do complemento (Figura 1c)
A cascata de ativação do complemento pelo anticorpo pode levar à lise de certas
bactérias e virus. Além disso, alguns componentes da cascata do complemento (ex.
C3b) opsoniza patógenos e facilita sua captação via receptores do complemento
nas células fagocíticas.
|
|
Figura 1
|
A

 Anticorpos ligando-se
e neutralizando uma toxina bacteriana, impedindo-a de interagir com
células hospedeiras e causar patologia. Toxinas não ligadas podem reagir
com receptores na célula hospedeira, enquanto que complexos toxina/anticopo
não podem. Anticorpos também neutralizam partículas virais inteiras e
células ao se ligarem a elas, inativando-as. O complexo antígeno/anticorpo
é eventualmente encontrado e degradado por macrófagos. Anticorpos
cobrindo um antígeno torna-o reconhecivel como sendo estranhos para
fagócitos (macrófagos e leucócitos polimorfonucleares), que o ingere e
destrói, sendo isso chamado de opsonização.
Anticorpos ligando-se
e neutralizando uma toxina bacteriana, impedindo-a de interagir com
células hospedeiras e causar patologia. Toxinas não ligadas podem reagir
com receptores na célula hospedeira, enquanto que complexos toxina/anticopo
não podem. Anticorpos também neutralizam partículas virais inteiras e
células ao se ligarem a elas, inativando-as. O complexo antígeno/anticorpo
é eventualmente encontrado e degradado por macrófagos. Anticorpos
cobrindo um antígeno torna-o reconhecivel como sendo estranhos para
fagócitos (macrófagos e leucócitos polimorfonucleares), que o ingere e
destrói, sendo isso chamado de opsonização.
B
 Opsonização e fagocitose de uma célula bacteriana
Opsonização e fagocitose de uma célula bacteriana
C
 Ativação do sistema do complemento por anticorpos cobrindo uma célula
bacteriana. Anticorpos ligados formam um receptor para a primeira
proteína do sistema do complemento, que eventualmente forma um complexo
protêico na superfície da bactéria que, em alguns casos, pode matar a
bactéria diretamente, mas de uma maneira geral é favorecida a sua
captação e destruição por fagócitos. Dessa forma, anticorpos apontam
patógenos e seus produtos para eliminação pelos fagócitos
Ativação do sistema do complemento por anticorpos cobrindo uma célula
bacteriana. Anticorpos ligados formam um receptor para a primeira
proteína do sistema do complemento, que eventualmente forma um complexo
protêico na superfície da bactéria que, em alguns casos, pode matar a
bactéria diretamente, mas de uma maneira geral é favorecida a sua
captação e destruição por fagócitos. Dessa forma, anticorpos apontam
patógenos e seus produtos para eliminação pelos fagócitos
|
 Figura 2
Figura 2
Mecanismo de defesa do hospedeiro contra infecção intracelular por
virus. As células infectadas por virus são reconhecidas pelas células T
especializadas chamadas linfócitos T citotóxicos (TCLs), que matam as
células infectadas diretamente. O mecanismo de morte envolve a ativação
de nucleases na célula infectada, que cliva o DNA do hospedeiro e o DNA
viral. |
Patógenos intracelulares
Como anticorpos não penetram nas células hospedeiras, eles
são ineficazes contra patógenos intracelulares. O sistema imune usa uma
abordagem diferente para lidar com esses tipos de patógenos. Respostas
mediadas por células são a defesa primária contra patógenos intracelulares e
a abordagem é diferente dependendo de onde está o patógeno na célula
hospedeira (i.e., no citosol ou no interior de vesículas). Por
exemplo, a maioria dos virus e algumas bactérias residem no citoplasma da
célula hospedeira. Entretanto, algumas bactérias e parasitas na verdade
vivem no interior de endossomas na célula hospedeira infectada. A defesa
primária contra patógenos no citosol é o linfócito T citotóxico (Tc ou
TCL). Contrariamente, a defesa primária contra um patógeno no interior de
vesículas é uma sub-divisão de linfócitos T auxiliares (Th1).
Linfócitos T citotóxicos (Figura 2)
TCLs são uma sub-divisão de linfócitos T que expressam um tipo
especial de antígeno nas suas superfícies chamado CD8. Essas
células reconhecem antígenos do patógeno que são exibidos na
superfície da célula infectada e matam a célula impedindo portanto
que a infecção se espalhe pelas células vizinhas. TCLs matam pela
indução de apoptose na célula infectada.
|
 Figura 3
Figura 3
Mecanismo de defesa do hospedeiro contra infecção intracelular por
micobactéria. Micobactéria que infecta macrófagos vive em vesículas
citoplasmáticas que resistem à fusão com lisossomos e à consequente
destruição da bactéria pela atividade bactericida do macrófago.
Entretanto, quando a célula T apropriada reconhece um macrófago
infectado ela libera moléculas ativadoras de macrófagos que induzem a
fusão lisossômica e a ativação das atividades bactericidas do macrófago |
Células T Auxiliares Th1
(Figura 3)
Células Th são uma sub-divisão de células T que expressam um tipo especial
de antígeno nas suas superfícies chamado CD4. Uma sub-população de células
Th, células Th1, é a defesa primária contra patógenos intracelulares que
vivem no interior de vesículas. Células Th1 reconhecem antígenos de
patógenos que são expressados na superfície das células infectadas e liberam
citocinas que ativam a célula infectada. Uma vez ativada, a célula infectada
pode então matar o patógeno. Por exemplo, Mycobacterium tuberculosis,
o agente causador da tuberculose, infecta macrófagos mas não é morto porque
ele bloqueia a fusão dos lisossomos com os endossomos nos quais ele reside.
Células Th1 que reconhecem antígenos de M. tuberculosis na superfície
de um macrófago infectado podem secretar citocinas que ativam macrófagos.
Uma vez ativado o macrófago, os lisossomos se fusionam com os endossomos e
as bactérias de M. tuberculosis são mortas.
Embora respostas imunes sejam dirigidas ao patógeno e para o local onde o
patógeno reside, a maioria dos patógenos pode emitir uma resposta mediada tanto
por anticorpos como por células, ambas as quais podem contribuir para que o
hospedeiro se livre do patógeno. Entretanto, para um patógeno em particular, um
anticorpo ou uma resposta mediada por célula pode ser mais importante para a
defesa contra o patógeno.
|
 Figura 4
Figura 4
Todas as células hematopoiéticas são derivadas de células-tronco
pluripotentes que originam duas linhagens principais: uma para células
linfóides e uma para células mielóides. A progenitora linfóide comum tem
a capacidade de se diferenciar tanto em células T como em células B,
dependendo do microambiente onde elas estão. Em mamíferos, células T se
desenvolvem no timo enquanto que células B se desenvolvem no fígado
fetal e na medula óssea. Uma AFC é uma célula formadora de anticorpos,
sendo o plasmócito a AFC mais diferenciada. Células NK também se derivam
de célula progenitora linfóide comum. As células mielóides se
diferenciam em células iniciadas à esquerda. O termo coletivo
“granulócito”
é usado para eosinófilos, neutrófilos e basófilos. |
Células do sistema imune
Todas as células do sistema imune se originam de uma célula
tronco hematopoiética que origina duas linhagens principais, uma de células
mielóides progenitoras e uma de células linfóides progenitoras (Figura 4).
Esses dois progenitores originam células mielóides (monócitos, macrófagos,
células dendríticas, megacariócitos e granulócitos) e células linfóides (células
T, células B e células assassinas naturais (NK), respectivamente. Essas células
constituemos componentes celulares dos sistemas imunes inato(não específico) e
adaptativo (específico).
Células do sistema imune inato
Células do sistema imune inato (monócito-macrófagos e PMNs), células NK,
basófilos, eosinófilos e plaquetas. O papel dessas células foi discutido
anteriormente (veja
imunidade não específica,
aula 1). Os receptores dessas células são receptores de padrões de
reconhecimento (PRRs) que reconhecem padrões moleculares gerais encontrados nos
patógenos (padrões moleculares associados a patógenos PAMPS).
Células que conectam os sistemas imunes inato e
adaptativo
Uma sub-divisão especializada de células chamadas células apresentadoras de
antígenos (APCs) são uma população heterogênea de leucócitos que têm papel
importante na imunidade inata e também age como um conector para o sistema imune
adaptativo ao participar na ativação de células T auxiliares (células Th).
Essas células incluem células dendríticas e macrófagos. Um aspecto
característico das APCs é a expressão de uma molécula de superfície codificada
por genes do complexo maior de histocompatibilidade, referidas como moléculas de
MHC classe II. Linfócitos B também expressam moléculas de MHC classe II e eles
também funcionam como APCs, embora eles não sejam considerados parte do sistema
imune inato. Além disso, algumas outras células ( e.g., células
epiteliais do timo) podem expressar moléculas de MHC classe II e podem funcionar
como APCs.
Células do sistema imune
adaptativo
Células que constituem o sistema imune adaptativo (específico) incluem os
linfócitos B e T. Após exposição ao antígeno, células B diferenciam em
plasmócitos cuja função primária é a produção de anticorpos. Similarmente,
células T podem se diferenciar em células T citotóxicas (Tc) ou células
auxiliares (Th) das quais existem dois tipos: Células Th1
e Th2.
Existem vários marcadores de superfície celular
que são usados em laboratórios clínicos para distinguir entre células B, T e
suas sub-populações. Estes estão sumarizados na Tabela 1.
|
| |
|
Tabela 1. Principais
marcadores para reconhecimento de células T e B |
| Marcador |
células
B |
Tc |
Th |
| CD3 |
- |
+ |
+ |
| CD4 |
- |
- |
+ |
| CD8 |
- |
+ |
- |
| CD19 e/ou CD20 |
+ |
- |
- |
| CD40 |
+ |
- |
- |
| Receptor de Ag |
BCR (Ig de
superfície) |
TCR |
TCR |
|
 Figura 5
Figura 5
Os receptores de antígeno de células B têm dois sítios de reconhecimento
de antígenos enquanto que aqueles de células T têm apenas um. |
ESpecificiDADE DA RESPOSTA IMUNE ADAPTATIVA
A especificidade na resposta
imune adaptativa reside nos receptores de antígenos nas células T e B, os
receptores TCR e BCR, respectivamente. TCR e BCR são semelhantes no fato de que
cada receptor é específico para um determinante antigênico mas eles diferen no
fato de que BCRs são divalentes enquanto que TCRs são monovalentes (Figura 5).
Uma consequência dessa diferença é que enquanto células B podem ter seus
receptores de antígenos em ligação cruzada com um antígeno, TCR não podem. Isso
tem implicações sobre como as células B e T podem se tornar ativadas.
|
| |
Cada célula B e T tem um receptor que é especifico
para um determinante antigênico particular e existe uma grande variedade de
receptores diferentes em ambas as células B e T. A questão sobre como esses
receptores são gerados foi o principal assunto para imunologistas por muitos
anos. Duas hipóteses básicas foram propostas para explicar a geração dos
receptores: a hipótese instrucionista (original) e a hipótese da seleção clonal.
Hipótese instrucionista
A hipótese instrucionista estabelece que existe apenas um receptor comum
codificado na linhagem germinativa e que receptores diferentes são gerados
usando o antígeno como molde. Cada antígeno faria com que o receptor comum fosse
dobrado para se amoldar ao antígeno. Enquanto essa hipótese era simples e
atraente, ela não era consistente com o que se sabia sobre o dobramento de
proteínas (i.e. dobramento de proteínas é ditado pela sequência de aminoácidos
na proteína). Além disso essa hipótese não explicava a discriminação do sistema
imune do próprio /não próprio. Ela não poderia explicar por que o receptor único
comum não se dobrava para acomodar antígenos próprios.
Hipótese da seleção clonal
A hipótese da seleção clonal estabelece que a linhagem germinativa codifica
muitos receptores de antígenos diferentes – um para cada determinante antigênico
para o qual um indivíduo será capaz de montar uma resposta imune. O antígeno
seleciona aqueles clones de células que têm o receptor apropriado. Os quatro
princípios básicos da hipótese da seleção clonal são:
-
Cada linfócito carrega um único tipo de receptor com uma especificidade única.
-
A interação entre uma molécula estranha e um receptor de linfócito capaz de
se ligar a esta molécula com alta afinidade leva à ativação do linfócito.
-
As células efetoras diferenciadas de um linfócito ativado irá carregar
receptores de especificidade idêntica àquela da célula parental da qual o
linfócito foi derivado.
-
Linfócitos carregando receptores para moléculas próprias são deletados nos
estágios iniciais do desenvolvimento da célula linfóide e estão portanto
ausentes no repertório de linfócitos maduros.
A hipótese da seleção clonal é geralmente aceita nos dias atuais como a hiótese
correta que explica como o sistema imune adaptativo opera. Ela explica muitas
das características da resposta imune: 1) a especificidade da resposta; 2) o
sinal necessário para a ativação da resposta (i.e. antígeno); 3) o período de
incubação da resposta imune adaptativa (tempo necessário para ativar as células
e para expandir os clones de células); e 4) discriminação do próprio/não próprio.
|
 Figura 6
Figura 6
Linfócitos circulantes encontram antígeno em tecidos linfóides
periféricos
 Figura 7
Figura 7
Linfócitos virgens dos tecidos linfóides primários tais como medula
óssea migram para tecidos linfóides secundários, i.e. o baço e os
linfonodos. Células apresentadoras de antígenos (APCs), incluindo
células dendríticas e fagócitos (monócitos) mononucleares, também
derivam de células-tronco da medula óssea. Essas APCs penetram nos
tecidos, englobam o antígeno e o transportam para os tecidos linfóides
para serem apresentados às células T e B. Linfócitos iniciados então
migram dos tecidos linfóides e se acumulam preferencialmente nos locais
de infecção e inflamação |
RECIRCULAÇÃO DE LINFÓCITOS
Como existem relativamente poucos linfócitos T ou B com um
receptor para um antígeno particular (1/10.000 – 1/100.000), as chances de um
encontro bem sucedido entre o antígeno e o linfócito apropriado são mínimas.
Entretanto, as chances de um encontro bem sucedido são muito aumentadas pela
recirculação dos linfócitos através dos órgãos linfóides secundários. Linfócitos
no sangue entram nos nódulos linfáticos e se infiltram através dos nódulos
linfáticos (Figura 6). Se eles não encontram um antígeno no nódulo linfático,
eles saem via vasos linfáticos e voltam ao sangue via ducto torácico. É estimado
que 1-2% dos linfócitos recirculam a cada hora. Se os linfócitos nos nódulos
linfáticos encontram um antígeno, que tenha sito transportado para o nódulo
linfático via vasos linfáticos, as células se tornam ativadas, dividem-se e
diferenciam-se para se transformarem em plasmócitos, Th ou célula Tc. Após
alguns dias as células efetoras podem sair dos nódulos linfáticos via vasos
linfáticos e retornam ao sangue via ducto torácico e daí encontram seus caminhos
para o local do tecido infectado.
Linfócitos não instruídos (virgens) entram nos nódulos
linfáticos deixando o sangue via vênulas endoteliais altas (HEVs).
Receptores-guias nos linfócitos dirigem as células para os HEVs. Nos linfonodos,
linfócitos com o receptor de antígeno apropriado encontram o antígeno, que foi
transportado aos linfonodos pelas células dendríticas ou macrófagos. Após a
ativação os linfócitos expressam novos receptores que permitem as células sairem
do linfonodo e se re-introduzirem na circulação. Receptores nos linfócitos
ativados reconhecem moléculas de adesão celular expressas nas células
endoteliais próximo ao local de uma infecção e quimiocinas produzidas no local
da infecção ajudam a atrair as células ativadas (Figura 7).
|
| |
IMUNIDADE:
CONTRASTES ENTRE NÃO-ESPECÍFICO E ESPECÍFICO
Não-específica
(natural, nativa, inata)
- Sistema existente
antes da exposição ao antígeno
- Não há discriminação entre antígenos
- Pode ser aumentada após exposição ao anígeno por meio do efeito de
citocinas
Específica (adquirida,
adaptativa)
- Induzida pelo
antígeno
- Aumentada pelo antígeno
- Demonstra discriminação refinada
As características
identificadoras do sistema imune específico são a memória e a especificidade.
- O sistema imune
específico "lembra" cada encontro com um micróbio ou antígeno estranho,
de forma que encontros subsequentes estimulam o aumento progressivo de
mecanismos eficientes de defesa.
- A resposta imune
específica amplifica os mecanismos de proteção da imunidade
não-específica, dirige ou concentra esses mecanismos no local de entrada
do antígeno, e assim torna-os mais capazes de eliminar antígenos
estranhos.
|
| Figure
8 |
CELULAS
DO SISTEMA IMUNE
Todos os tipos de células
do sistema imune se originam da medula óssea.
|
 Linfócito T humano (SEM x12,080)
©
Dennis Kunkel Microscopy,
Inc.
Utilizado com permissão
Linfócito T humano (SEM x12,080)
©
Dennis Kunkel Microscopy,
Inc.
Utilizado com permissão |
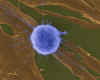 Linfócito T Humano Atacando Tumor de Fibroblasto / Cancer Cells (SEM
x4,000)
Linfócito T Humano Atacando Tumor de Fibroblasto / Cancer Cells (SEM
x4,000)
©
Dennis Kunkel Microscopy, Inc.
Utilizado com permissão
 Esfregaço sanguíneo mostrando um monócito (esquerda)
e dois neutrófilos
Esfregaço sanguíneo mostrando um monócito (esquerda)
e dois neutrófilos
© Bristol Biomedical Image Archive Utilizado com
permissão
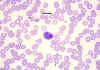
 Monócito, coloração pelo giemsa esfregaço de sangue periférico
Monócito, coloração pelo giemsa esfregaço de sangue periférico
©
Dr Peter
Darben,
Queensland University of Technology clinical parasitology collection. Utilizado
com permissão
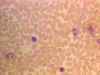
 Eosinófilo, coloração pelo giemsa esfregaço de sangue periférico
Eosinófilo, coloração pelo giemsa esfregaço de sangue periférico
©
Dr Peter
Darben,
Queensland University of Technology clinical parasitology collection. Utilizado
com permissão
 Esfregaço sanguíneo mostrando pequenos linfócitos
Esfregaço sanguíneo mostrando pequenos linfócitos
© Bristol Biomedical
Image Archive Utilizado com permissão
 Grande linfócito, coloração pelo giemsa esfregaço de sangue periférico
Grande linfócito, coloração pelo giemsa esfregaço de sangue periférico
©
Dr Peter
Darben,
Queensland University of Technology clinical parasitology collection. Utilizado
com permissão
 Neutrófilo
– electromicrografia. Note os dois lobos e os grânulos azurófilos
Neutrófilo
– electromicrografia. Note os dois lobos e os grânulos azurófilos
© Dr
Louise Odor, University of South Carolina School of Medicine
 Neutrófilo, coloração pelo giemsa esfregaço de sangue periférico
Neutrófilo, coloração pelo giemsa esfregaço de sangue periférico
©
Dr Peter
Darben,
Queensland University of Technology clinical parasitology collection. Utilizado
com permissão
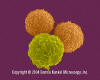 Linfócitos
T (células
pré-T) e granulócito (neutrófilo).
Linfócitos
T (células
pré-T) e granulócito (neutrófilo).
©
Dennis Kunkel Microscopy, Inc.
Utilizado com permissão
|
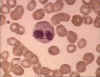 Eosinófilo em esfregaço sanguíneo
© Bristol Biomedical Image Archive Utilizado com permissão
Eosinófilo em esfregaço sanguíneo
© Bristol Biomedical Image Archive Utilizado com permissão |
 Pequeno Linfócido, coloração pelo giemsa esfregaço de sangue periférico
©
Dr Peter Darben,
Queensland University of Technology clinical parasitology collection. Utilizado
com permissão
Pequeno Linfócido, coloração pelo giemsa esfregaço de sangue periférico
©
Dr Peter Darben,
Queensland University of Technology clinical parasitology collection. Utilizado
com permissão |
| |
Existem duas linhagens principais
que se derivam da célula-tronco hematopoiética:
Linfócitos T (células T)
Linfócitos B (células B)
Células assassinas naturais (células NK)
Monócitos, macrófagos
Células de Langerhans, células dendríticas
Megacariócitos
Granulócitos (eosinófilos, neutrófilos, basófilos)
|
|


|
|
Seleção clonal
Os quatro princípios básicos da hipótese da seleção clonal |
|
Cada linfócito carrega um único tipo de receptor específico |
|
A interação entre uma molécula estranha e um receptor de linfócito capaz
de ligar essa molécula com alta afinidade leva à ativação do linfócito |
|
As células efetoras diferenciadas derivadas de um linfócito ativado irão
carregar receptores de especificidade idêntica àquela da célula parental
da qual o linfócito foi derivado |
|
Linfócitos carregando receptores específicos de moléculas próprias são
deletados em um estágio inicial do desenvolvimento e estão portanto
ausentes no repertório dos linfócitos maduros |
 Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Voltar
à Seção Imunologia do Microbiologia e Imunologia Online
Esta página foi modificada em
Página mantida por
Richard Hunt
Por favor, relate quaisquer problemas para
Richard Hunt
|

 Figura 2
Figura 2 Linfócito T humano (SEM x12,080)
©
Dennis Kunkel Microscopy,
Inc.
Utilizado com permissão
Linfócito T humano (SEM x12,080)
©
Dennis Kunkel Microscopy,
Inc.
Utilizado com permissão Eosinófilo em esfregaço sanguíneo
© Bristol Biomedical Image Archive Utilizado com permissão
Eosinófilo em esfregaço sanguíneo
© Bristol Biomedical Image Archive Utilizado com permissão Pequeno Linfócido, coloração pelo giemsa esfregaço de sangue periférico
©
Dr Peter Darben,
Queensland University of Technology clinical parasitology collection. Utilizado
com permissão
Pequeno Linfócido, coloração pelo giemsa esfregaço de sangue periférico
©
Dr Peter Darben,
Queensland University of Technology clinical parasitology collection. Utilizado
com permissão








