|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGIE |
IMMUNOLOGIE |
MYCOLOGY |
PARASITOLOGY |
VIROLOGIE |
|
VIDEO LECTURE
|
IMMUNOLOGIE - CHAPITRE DOUZE
IMMUNITÉ A MEDIATION CELLULAIRE:
Interactions cellule-cellule au cours des réponses immunes spécifiques
Gene Mayer,
Ph.D.
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Jennifer Nyland, Ph.D.
Assistant Professor of Pathology, Microbiology and Immunology
University of South Carolina
Denis
Hudrisier, Ph.D.
Centre national de la recherche scientifique (CNRS) · Institute of
Pharmacology and Structural Biology
Université de Toulouse
|
|
EN ANGLAIS |
|
|
|
EM PORTUGUES - PORTUGUESE |
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
Edité et illustré par Richard Hunt
LECTURES PROPOSEES
Male et al. Immunology
7ème édition Chapitres 8 et 10
|
|
|
|
OBJECTIFS DU COURS
Discuter le rôle central des cellules Th dans la réponse immunitaire
Décrire les interactions cellule-cellule se produisant lors de i) la
production d‘anticorps contre des antigènes T-dépendants, ii) la
génération des cellules T cytotoxiques et iii) l’activation des
macrophages et des cellules NK
3. Discuter les mécanismes de la cytotoxicité des CTL et des NK
4. Discuter les réponses contre des antigènes T-indépendants.
|
ROLE CENTRAL DES CELLULES TH DANS LES
REPONSES IMMUNITAIRES
Comme représenté dans la Figure 1, après que les cellules Th aient reconnu
l’antigène spécifique présenté par les cellules présentatrices d’antigènes,
elles peuvent initier plusieurs processus immunologiques importants. Ceux-ci
incluent 1) la sélection de mécanismes effecteurs appropriés (activation de
lymphocytes B ou génération de lymphocytes T cytotoxiques), 2) l’induction de la
prolifération de cellules effectrices appropriées et 3) l’augmentation des
activités fonctionnelles d’autres cellules (granulocytes, macrophages, cellules
NK).
On distingue quatre sous populations de cellules Th: les cellules Th0, Th1, Th2
et Th17. Lorsque les cellules naïves Th0 rencontrent un antigène dans les
organes lymphoïdes secondaires, elles sont capables de se différencier en
cellules Th1 inflammatoires, en cellules auxiliaires Th2 ou en cellules
pathogéniques Th17, identifiables par les cytokines qu’elles produisent (Figure
2). Les cellules Th0 deviennent des cellules Th1, Th2 ou Th17 en fonction des
cytokines présentes dans leur environnement, lui-même influencé par l’antigène.
Par exemple, certains antigènes stimulent la production d’IL-4, ce qui favorise
la génération de cellules Th2 alors que d’autres entraînent la production
d’IL-12, qui favorise la génération de cellules Th1. Les cellules Th1, Th2 et
Th17 agissent sur différents types de cellules et influencent ainsi le type de
réponse immunitaire comme indiqué dans la Figure 3 dans le cas des cellules Th1
et Th2.
Les cytokines produites par les cellules Th1 activent les macrophages et
participent à la génération de lymphocytes T cytotoxiques (CTL) conduisant à une
réponse immunitaire à médiation cellulaire. A l’inverse, les cytokines produites
par les cellules Th2 aident à l’activation des lymphocytes B, conduisant à la
production d’anticorps.
Issues d’une découverte récente, les cellules Th17 (désignées comme tel du fait
de leur production d’IL-17) se différencient (chez l’homme) en réponse à l’IL-1,
l’IL-6 et l’IL-23. Le TGF beta est important pour la différenciation des
cellules Th17 chez la souris mais pas chez l’homme. L’IL-17 accroît la sévérité
de quelques maladies auto-immunes comme la sclérose en plaque, des maladies
inflammatoires de l’intestin et la polyarthrite rhumatoïde.
Point important, chaque sous-population cellulaire de Th peut exercer une
influence inhibitrice sur les autres. L’IFN gamma produit par les cellules Th1
inhibe la prolifération des cellules Th2 et la différenciation des cellules Th17
alors que l’IL-10 produite par les cellules Th2 inhibe la production d’IFN gamma
par les cellules Th1. De plus, l’IL-4 inhibe la génération de cellules Th1 et la
différenciation de cellules Th17. Ainsi, la réponse immunitaire est orientée
vers le type de réponse requis pour lutter contre un pathogène donné: réponse à
médiation cellulaire pour les pathogènes intracellulaires ou réponse anticorps
pour les pathogènes extracellulaires.
|
|
MOTS CLES
Cellules Th1, cellules Th2 , modèle haptène-porteur, CD28, B7, CD40,
CD40 ligand, CD5, cellules B1, cellules B2, CTL, Fas ligand, Perforine,
Granzymes, Caspases, IFN-γ, Activation
|
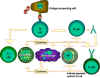 Figure 1.
Figure 1.
Les cellules Th sont au centre de l’immunité à médiation cellulaire. Les
cellules présentatrices d’antigènes présentent l’antigène aux cellules Th. Les
cellules Th reconnaissent des épitopes spécifiques qui sont identifiés comme des
épitopes cibles. Des mécanismes effecteurs appropriés sont alors mis en place.
Par exemple, les cellules Th aident les cellules B à fabriquer des anticorps
ainsi qu’à activer d’autres cellules. Les signaux d’activation produits par les
cellules Th consistent en des cytokines (lymphokines) mais des cytokines
similaires fabriquées par les macrophages et d’autres cellules participent aussi
à ce processus.
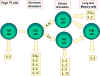 Figure
2 Figure
2
Différenciation des cellules Th murines. Les cellules Th de souris se
différencient en sous-populations qui synthétisent différents types de
lymphokines. Ceci se produit aussi chez l’homme.
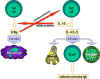 Figure 3
Figure 3
Sélection des mécanismes effecteurs par les cellules Th1 et Th2. En plus de
déterminer diverses voies effectrices selon les lymphokines produites, les
cellules Th1 inhibent les Th2 et vice versa.
|
|
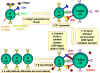
Figure 4
Molécules impliquées dans l’interaction
des cellules B et Th. L’antigène
 est
apprêté par les cellules B. Des molécules co-stimulatrices sont
exprimées. Le peptide antigénique apprêté est
apprêté par les cellules B. Des molécules co-stimulatrices sont
exprimées. Le peptide antigénique apprêté
 est
présenté en association avec le CMH de classe II. La cellule T reconnait
le complexe peptide-CMH et les co-stimulateurs. La cellule T exprime le
ligand de CD40. Celui-ci se lie au CD40 sur la cellule B et la cellule B
se divise et se différencie alors. Des anticorps sont produits par les
cellules B. est
présenté en association avec le CMH de classe II. La cellule T reconnait
le complexe peptide-CMH et les co-stimulateurs. La cellule T exprime le
ligand de CD40. Celui-ci se lie au CD40 sur la cellule B et la cellule B
se divise et se différencie alors. Des anticorps sont produits par les
cellules B.
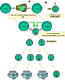 Figure 5
Figure 5
Coopération des cellules dans la réponse immune. Les
cellules présentatrices d’antigènes (cellules dendritiques) présentent
l’antigène apprêté aux cellules T naïves. Les cellules B apprêtent aussi
l’antigène et le présentent aux cellules T. Les cellules B vont ensuite
recevoir le signal des cellules T qui leur permet de se diviser et se
différencier. Quelques cellules B forment les cellules productrices
d’anticorps alors que d’autres forment les cellules B mémoires.
|
INTERACTIONS CELLULE-CELLULE LORS DES RÉPONSES ANTICORPS
CONTRE DES ANTIGENES EXOGENES T-DEPENDANTS
A. Modèle haptène-porteur
Historiquement, l’une des découvertes majeures en immunologie a été que
les cellules B et T étaient toutes deux nécessaires pour la production
d’anticorps dirigés contre une protéine complexe. La compréhension de ce
processus vient des études sur la formation d’anticorps anti-haptène.
Les études des conjugués haptène-porteur ont établit que:
-
Les cellules Th2 reconnaissent des déterminants de la protéine
porteuse et les cellules B reconnaissent des déterminants hapténiques
-
L’interaction entre les cellules B spécifiques de l’ haptène et les
cellules T spécifiques du porteur sont restreintes au CMH du soi
Les cellules B peuvent aussi bien reconnaître l’antigène que le
présenter
Les cellules B occupent une position unique dans les réponses immunes
parce qu’elles expriment des molécules d’immunoglobuline et du CMH de
classe II à leur surface cellulaire. Elles sont ainsi capables de
produire des anticorps ayant la même spécificité que celle exprimée par
leur immunoglobuline de surface. En plus, elles peuvent fonctionner
comme une cellule présentatrice d’antigène. Dans le cas des conjugués
haptène-porteur, le mécanisme envisagé est le suivant: l’haptène est
reconnu par l’immunoglobuline de surface, le complexe haptène-porteur
est internalisé par la cellule B, dégradé, et les fragments peptidiques
de la protéine porteuse sont présentés aux cellules Th. L’activation des
cellules Th conduit à la production de cytokines qui, en retour,
permettent aux cellules B spécifiques de l’haptène de s’activer pour
produire des anticorps anti-haptènes solubles. La Figure 4 résume les
interactions qui se produisent entre les cellules T et B.
Il faut noter que de multiples signaux sont apportés aux cellules B dans
ce modèle d’interaction entre cellules Th2 et B. A l’instar de
l’activation des cellules T où le signal issu de la reconnaissance entre
le TCR et le complexe CMH-peptide est par lui-même insuffisant pour
l’activation des cellules T, la liaison d’un antigène à
l’immunoglobuline de surface délivre un signal insuffisant aux cellules
B. Un second signal délivré par les molécules de co-stimulation est
requis: le second signal issu de l’interaction de CD40L présent sur les
cellules T avec CD40 exprimé sur les cellules B est le plus important.
B. Interactions Cellule-Cellule lors des réponses anticorps primaires
Les cellules B ne sont pas les meilleures cellules présentatrices
d’antigène dans la réponse primaire des anticorps. Les cellules
dendritiques ou les macrophages sont les plus efficaces. Néanmoins, avec
quelques modifications mineures, le modèle haptène-porteur pour
l’interaction cellule-cellule décrit ci-dessus s’applique aussi plus
globalement pour les interactions ayant lieu de lors de la réponse
primaire des anticorps (Figure 5). Dans une réponse primaire, les
cellules Th2 rencontrent en premier l’antigène présenté par les cellules
dendritiques et les macrophages. Les cellules Th2 “primées” (ou activées)
peuvent ensuite interagir avec les cellules B qui ont rencontré
l’antigène et qui présentent les peptides antigéniques en association
avec les molécules de CMH de classe II. Les cellules B ont besoin de
deux signaux pour leur activation: un signal consiste en la liaison de
l’antigène à l’immunoglobuline de surface et le second signal vient de
l’engagement de CD40/CD40L lors de l’interaction cellule-cellule entre
cellule Th2 et cellule B. Par ailleurs, les cytokines produites par les
cellules Th2 aident les cellules B à proliférer et à se différencier en
plasmocytes sécréteurs d’anticorps.
C. Interactions Cellule-Cellule lors des réponses anticorps secondaires
A la suite d’une réponse primaire, de nombreuses cellules T et B
mémoires sont produites. Les cellules B mémoires possèdent une
immunoglobuline de surface de haute affinité (en raison du phénomène de
maturation d’affinité), ce qui leur permet de lier et de présenter
l’antigène à des concentrations beaucoup plus faibles que celles
nécessaires pour les macrophages et les cellules dendritiques. De plus,
les cellules T mémoires sont beaucoup plus facilement activables que les
cellules T naïves. Ainsi ; les interactions B/Th sont suffisantes pour
générer des réponses anticorps secondaires. Il n’est pas nécessaire (bien
que cela puisse se produire) d’activer des cellules Th mémoires par des
antigènes présentées par les cellules dendritiques ou les macrophages.
D. Cytokines et commutation de classe
Les cytokines produites par les cellules Th activées ne stimulent pas
seulement la prolifération et la différenciation des cellules B: elles
participent aussi à la régulation de la classe d’anticorps produite.
Différentes cytokines influencent la commutation vers différentes
classes d’anticorps possédant des fonctions différentes. De cette façon,
la réponse anticorps s’adapte au pathogène rencontré (par exemple,
production d‘IgE lors d’infections parasitaires). Le Tableau 1
récapitule les effets des différentes cytokines sur les classes
d’anticorps produites.
|
Cytokine
|
IgG1
|
IgG2a
|
IgG2b
|
IgG3
|
IgA
|
IgE
|
IgM
|
|
IL-4
|
Induit
|
Inhibe
|
|
Inhibe
|
|
Induit
|
Inhibe
|
|
IL-5
|
|
|
|
|
Augmente
la production
|
|
|
|
IFN-gamma
|
Inhibe
|
Induit
|
|
Induit
|
|
Inhibe
|
Inhibe
|
|
TGF-beta
|
|
|
Induit
|
Inhibe
|
Induit
|
|
Inhibe
|
|
Régulation de la formation des isotypes d’anticorps par les cytokines
produites par les cellules T chez la souris.
Certains cytokines induisent (vert) ou inhibent (rose) la production de
certains isotypes d’anticorps. L’inhibition résulte généralement de la
commutation vers un isotype différent.
|
|
Table 1 |
|
| |
INTERACTIONS
CELLULE-CELLULE LORS DES RÉPONSES ANTICORPS CONTRE DES ANTIGENES EXOGENES T-INDEPENDANTS
Les réponses anticorps dirigées contre des antigènes T-indépendants ne
nécessitent pas d’interactions cellule-cellule. La nature polymérique de ces
antigènes permet l’agrégation des récepteurs antigéniques sur les cellules B
conduisant à l’activation. Aucune réponse secondaire, maturation d’affinité ou
commutation de classes ne se produit. Les réponses aux antigènes T-indépendants
sont généralement dues à l’activation d’une sous-population de lymphocytes B
appelée cellules B CD5+ (ou cellules B1) qui se distinguent des cellules B
conventionnelles qui sont CD5- (aussi appelées cellules B2).
Cellules CD5+ (B1)
Les cellules CD5+ sont les premières cellules B à apparaître au cours de
l’ontogenèse. Elles expriment des IgM de surface mais peu ou pas d’IgD et
produisent en premier lieu des anticorps IgM ne présentant que peu de
réarrangements somatiques. Les anticorps produits par ces cellules sont de
faible affinité et sont souvent poly-réactifs (ils se lient à plusieurs
antigènes différents). La plupart des IgM du sérum proviennent des cellules B
CD5+. Les cellules B CD5+ ne donnent pas lieu à des cellules mémoires. Une
caractéristique importante de ces cellules est qu’elles sont auto-renouvelables,
à l’inverse des cellules B conventionnelles, qui doivent être remplacées à
partir de la moelle osseuse. Les cellules B CD5+ sont retrouvées dans les tissus
périphériques et sont les cellules B prédominantes dans la cavité péritonéale.
Les cellules B1 constituent une ligne de défense majeure contre beaucoup de
pathogènes bactériens qui, de façon caractéristique, possèdent des
polysaccharides dans leur paroi cellulaire. L’importance de ces cellules dans
l’immunité est illustrée par le fait que beaucoup d’individus présentant des
défauts au niveau des cellules T demeurent capables de résister à de nombreux
pathogènes bactériens.
|
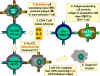 Figure 6
Figure 6
Les CTL peuvent se différencier en
réponse à l’antigène. Pour se différencier en lymphocyte T cytotoxique
fonctionnels, les pré-CTL CD8+ doivent recevoir deux signaux.
Premièrement, ils doivent reconnaître l’antigène présenté par les
cellules exprimant le CMH de classe I (cellules stimulatrices). Ensuite,
ils doivent être stimulés par les cytokines. L’IL-2, l’IFN gamma et
d’autres encore sont produites par les cellules T CD4+ suite à leur
interaction avec les cellules présentatrices d’antigène exprimant le CMH
II. Suite à ces deux signaux, le pré-CTL se différencie en CTL activé
qui peut alors lyser les cellules cibles portant le même antigène.
Adapté de Abbas, et. al. Cellular and Molecular Immunology. 3rd Ed., p.
292.
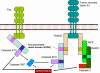 Figure 7
Figure 7
Les CTL tuent les cellules cibles par l’intermédiaire de
Fas ligand et du TNF
|
INTERACTIONS CELLULE-CELLULE DANS L’IMMUNITÉ A MÉDIATION CELLULAIRE. GENERATION
DES CELLULES T CYTOTOXIQUE EN REPONSE A DES ANTIGÈNES ENDOGENES CYTOSOLIQUES
Les lymphocytes T cytotoxiques ne sont pas pleinement matures lorsqu’ils
quittent le thymus. Ils possèdent un TCR fonctionnel qui reconnaît l’antigène
mais ils ne peuvent pas lyser une cellule cible. Ils doivent se différencier en
cellules T cytotoxique effectrices pleinement fonctionnelles pour réaliser cette
fonction. Les cellules T cytotoxiques se différencient à partir d’un “pré-CTL”
en réponse à deux signaux:
Stimulation par les cytokines produites par les cellules Th1, notamment IL-2
et l’IFN gamma. Ceci est illustré dans la Figure 6.
Caractéristiques de la lyse par les CTL
-
La lyse par les CTL est spécifique d’antigène. Pour être tuée par un CTL, la
cellule cible doit porter le même CMH de classe I associé à l’antigène que celui
qui déclenche la différenciation du pré-CTL.
-
Elle se déroule par apoptose
-
Mort déclenchée par Fas et TNF (Figure 7)
Une fois générés, les CTL expriment le FasL (Fas ligand) sur leur surface,
lequel pourra se lier au récepteur Fas présent sur la cellule cible. En plus, le
TNF alpha sécrété par les CTL peut se lier au récepteur TNF présent sur la
cellule cible. Les récepteurs Fas et TNF sont membres d’une même famille de
récepteurs, qui, lorsqu’ils rencontrent leur ligand forment des trimères. Ces
récepteurs contiennent des domaines de mort dans leur partie cytosolique, qui,
après trimérisation, peuvent activer les caspases inductrices de l’apoptose dans
les cellules cibles.
-
Mort déclenchée par les granules (Figure 8)
Les CTL pleinement différenciés possèdent de nombreux granules qui renferment de
la perforine et des granzymes. Lors du contact avec les cellules cibles, la
perforine est relâchée et polymérise pour former des canaux dans la membrane de
la cellule cible. Les granzymes, qui sont des protéases à serine, pénètrent dans
la cellule par ces canaux et activent les caspases et les nucléases qui
conduisent à la mort de la cellule cible par apoptose.
|
| |
Figure 8
Mécanismes de la destruction des cellules cibles par les CTL
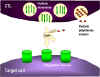 1. Les CTL dégranulent et relâchent des monomères de perforine à leur
voisinage. Des enzymes qui permettent la polymérisation de la perforine pour
former des canaux de poly-perforine sont aussi relâchées et, en présence de
Ca++, catalysent la formation de canaux dans la membrane des cellules cibles.
1. Les CTL dégranulent et relâchent des monomères de perforine à leur
voisinage. Des enzymes qui permettent la polymérisation de la perforine pour
former des canaux de poly-perforine sont aussi relâchées et, en présence de
Ca++, catalysent la formation de canaux dans la membrane des cellules cibles.
 2. Les CTL peuvent aussi relâcher des enzymes et des toxines qui
utilisent des les canaux de perforine pour endommager la cellule.
2. Les CTL peuvent aussi relâcher des enzymes et des toxines qui
utilisent des les canaux de perforine pour endommager la cellule.
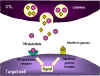 3. Des cytokines comme le TNF alpha et le TNF beta sont produites par
les CTL ou par des macrophages voisins. L’interféron gamma peut
également être produit par les CTL ou par d’autres cellules immunitaires.
Ces cytokines se lient à des récepteurs sur les cellules cibles et
déclenchent leur apoptose.
3. Des cytokines comme le TNF alpha et le TNF beta sont produites par
les CTL ou par des macrophages voisins. L’interféron gamma peut
également être produit par les CTL ou par d’autres cellules immunitaires.
Ces cytokines se lient à des récepteurs sur les cellules cibles et
déclenchent leur apoptose. |
|
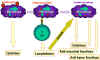 Figure 9
Figure 9
Les macrophages jouent un rôle central dans la réponse
immunitaire. Les macrophages apprêtent les antigènes et les présentent
aux cellules T qui, en retour, produiront des lymphokines activatrices
des macrophages leur permettant de réaliser de nouvelles fonctions
incluant la production de nouvelles cytokines.
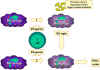 Figure 10
Figure 10
L’activation des macrophages fait suite à la mise en jeu
de nombreuses cytokines et autres facteurs.
Dans la voie 1, le TNF-alpha est produit par les macrophages suite à
leur activation par l’interféron gamma et l’interaction avec des
composants bactériens déclenchant la production de cytokines. Un exemple
de tel composant est le lipopolysaccharide bactérien. Dans la voie 2, le
TNF-alpha de la voie 1 conduit à la production d’oxyde nitrique par les
macrophages activés par l’interféron.
|
INTERACTIONS
CELLULE-CELLULE DANS L’IMMUNITÉ A MÉDIATION CELLULAIRE : ACTIVATION DES
MACROPHAGES EN REPONSE A DES ANTIGENES ENDOGENES VESICULAIRES
Les macrophages jouent un rôle central dans la
réponse immunitaire. Comme illustré dans la Figure 9, les macrophages
sont impliqués dans:
-
Les défenses immédiates, en tant qu’éléments de
l’immunité innée
-
La présentation des antigènes aux cellules Th
-
Différentes fonctions effectrices (comme la
production de cytokine, des activités bactéricides et tumoricides).
Par ailleurs, les macrophages jouent un rôle
important non seulement dans l’immunité mais aussi dans le remodelage
des tissus. Cependant, en raison de leurs activités puissantes, les
macrophages peuvent aussi endommager nos tissus.
La Table 2 résume les différentes fonctions des macrophages dans
l’immunité et l’inflammation.
Inflammation - Fièvre
Production de:
IL-6, TNF alpha, IL-1 (agents pyrétiques)
|
Dommages tissulaires
Hydrolases
Production de peroxyde d’hydrogène
Fragment C3a du complément
Production de TNF alpha
|
Immunité
Sélection des lymphocytes à activer:
La production d’IL-12 conduit à l’activation des Th1
La production d’IL-12 conduit à l’activation des Th2
Activation des lymphocytes:
Production d’IL-1
Apprêtement et présentation des antigènes
|
Action antimicrobienne
Production Oxygène–dépendante de:
peroxyde d’hydrogène
ions super-oxydes
radicaux hydroxyles
hypochlorite de sodium
Production Oxygène-indépendante de:
hydrolases acides
protéines cationiques
lysozyme
|
Remodelage des tissus
Sécrétion de différents facteurs:
Enzymes (elastase, hyaluronidase,collagénase)
Facteurs de stimulation des fibroblastes
Stimulation de l’angiogenèse
|
Activité anti tumorale
Facteurs toxiques
Peroxyde d’hydrogène
Fragment C3a du complément
Protéases
Arginase
Oxyde nitrique
TNF alpha
|
|
Table 2 |
Parmi ces fonctions, nombreuses sont celles qui ne
peuvent être effectuées que par des macrophages activés. L’activation
des macrophages peut être définie comme des modifications quantitatives
dans l’expression de divers produits de gènes permettant aux macrophages
ainsi activés d’effectuer des fonctions qui ne peuvent être effectuées
par des macrophages au repos.
L’activation des macrophages est une fonction importante des cellules
Th1. Lorsque les cellules Th1 sont activées par une APC tel qu’un
macrophage, elles produisent de l’IFN gamma qui est l’un des deux
signaux requis pour activer un macrophage. Le LPS bactérien ou le TNF
alpha produit par les macrophages exposés à des produits bactériens
constituent le second signal (Figure 10).
Les mécanismes effecteurs utilisés par les macrophages mettent en jeu la
production de:
-
TNF-α, qui peut induire l’apoptose
-
Oxyde nitrique et autres espèces réactives
azotées
-
Espèces réactives de l’oxygène
-
Protéines cationiques et enzymes hydrolytiques
L’activation des macrophages par les cellules Th1 est un élément
important pour la protection contre de nombreux pathogènes différents.
Par exemple, Pneumocystis carinii, un pathogène extracellulaire, est
contrôlé par des macrophages activés chez des individus normaux; par
contre, l’infection par cette bactérie est une cause commune de décès
chez les patients sidéens car ceux-ci sont déficients en cellules Th1.
De façon similaire, Mycobacterium tuberculosis, un pathogène
intracellulaire qui réside dans des vésicules n’est pas facilement
éliminé par les macrophages, sauf si ceux-ci sont activés de nouveau,
cette infection est particulièrement problématique chez les patients
sidéens.
|
| |
INTERACTIONS CELLULE-CELLULE DANS
L’IMMUNITÉ A MÉDIATION CELLULAIRE. ACTIVATION DES CELLULES NK
Les cytokines produites par les cellules activées de type Th1,
particulièrement l’IL-2 et l’IFN gamma, activent aussi les cellules NK
qui deviennent des « lymphokine-activated killer » (cellules LAK). Les
cellules LAK sont capables de tuer des cellules infectées par un virus
ou tumorales d’une manière non-restreinte au CMH. En effet, la
susceptibilité des cellules cibles à la lyse par les cellules NK ou les
cellules LAK est inversement proportionnelle à leur expression de
molécules du CMH de classe I (voir cours sur l’immunité innée). Les
mécanismes effecteurs utilisés par les cellules NK ou les cellules LAK
pour tuer les cellules cibles sont similaires à ceux utilisés par les
CTL (perforines et granzymes). Les cellules NK et LAK sont aussi
capables de tuer des cellules cibles recouvertes d’anticorps (cytotoxicité
ADCC).
|
|
|
|
|

 |
 Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
This page last changed on
Wednesday, July 31, 2013
Page maintained by
Richard Hunt
Please report any problems to
richard.hunt@uscmed.sc.edu
|

 Figure 1.
Figure 1.  Figure 6
Figure 6









