|
|
PRINCIPAUX EVENEMENTS
impliquées dans la réplication
La réplication virale implique les étapes suivantes:
Attachement
Le premier problème pour n'importe quel virus est de se fixer spécifiquement
à la surface d'une cellule hôte qui est permissive – c'est à dire une
cellule qui permettra la réalisation de toutes les étapes subséquentes du
cycle de réplication virale. Par exemple, pour un Norovirus – qui provoque
des gastroentérites virales - à l'intérieur de votre intestin, il est
essentiel de se fixer à la surface d'un entérocyte de la muqueuse de
l'intestin, et non pas à la surface d'une des millions de bactéries de la
flore intestinale, car les cellules bactériennes ne sont pas permissives
pour l'infection par des virus humains.
La fixation d'un virus sur la cellule hôte est effectuée par une interaction
spécifique entre une protéine d'attachement virale, et un récepteur
cellulaire. Le récepteur est souvent protéique, mais des structures en
carbohydrate, ou des glycolipides peuvent également servir de récepteurs aux
virus. Les cellules qui n'expriment pas le récepteur ne permettent pas
l'attachement des virus, et ne sont donc pas susceptibles à l'infection
virale. La présence du récepteur est un facteur important dans le tropisme
viral – c'est à dire, quelles cellules de l'hôte seront infectées par le
virus. Par exemple, le virus de l'immunodéficience humaine (VIH) utilise la
protéine membranaire CD4 comme récepteur, ce qui explique pourquoi le VIH
infecte les lymphocytes T CD4+ et pas des lymphocytes T CD8+.
Entrée
Le mécanisme par lequel le virus entre dans la cellule dépend de la
structure de la particule virale.
Virus Enveloppés
L’entrée de tous les virus enveloppés implique la fusion de l’enveloppe
virale avec l’une des membranes de la cellule hôte, afin de livrer le
contenu de la particule virale dans le cytoplasme. La fusion membranaire
peut avoir lieu :
A) Directement à la membrane plasmique (Figure 1),
suite à l’attachement du virus à son récepteur. C’est le cas du VIH,
par exemple.
B) Après l’internalisation de la particule virale par endocytose
(Figure 2).
Chez de nombreux virus, une réorganisation structurale importante
des glycoprotéines de l’enveloppe est nécessaire afin de permettre
la fusion membranaire. L’enveloppe de ce type de virus ne peut pas
fusionner directement avec la membrane plasmique. Dans un premier
temps, la particule virale est donc internalisée dans des endosomes,
puis la maturation de l’endosome active les domaines de fusion des
glycoprotéines virales, soit par la baisse du pH à l’intérieur de
l’endosome mature, soit par l’action des protéases endosomiales, qui
clivent les glycoprotéines virales et déclenchent leur activité de
fusion latente. Suivant la fusion de l’enveloppe virale avec la
membrane de l’endosome, le contenu de la particule virale est
libérée dans le cytoplasme.
Virus Nus
La capside de certains virus nus est capable de se réorganiser après la
fixation sur son récepteur, et de former un pore protéique qui traverse
la membrane cellulaire. Le génome du virus passe ensuite dans le
cytoplasme cellulaire. Ce processus peut avoir lieu directement à la
membrane plasmique, ou peut se déclencher seulement après l’endocytose
de la particule virale.
Chez d’autres virus nus, la capside entière traverse la membrane
cellulaire. Le plus souvent, cela se passe après l’internalisation des
particules virales dans des endosomes. Ensuite, les protéines de capside
déstabilisent, oui même détruisent la membrane endosomiale, permettant
ainsi le passage de la capside vers le cytoplasme.
Décapsidation
L’acide nucléique du génome viral doit maintenant être libéré de la capside
afin de permettre l’expression des gènes viraux et la réplication du génome
viral. Lors de la décapsidation, le génome et la capside virale sont
physiquement séparés, et puisque ces deux éléments doivent être réunis pour
former une particule virale infectieuse, la décapsidation définit le début
de la phase d’éclipse, pendant laquelle il est impossible de détecter des
particules virales infectieuses à l’intérieur de la cellule hôte.
Pour de nombreux virus (par exemple, les Picornaviridae), la décapsidation
coïncide avec l’étape d’entrée, tandis que pour d’autres il s’agit d’une
étape bien distincte. En particulier, pour tous les virus à ADN qui se
répliquent dans le noyau (par exemple, les Adenoviridae et les Herpesviridae),
la décapsidation a lieu seulement à l’arrivée des capsides virales aux pores
nucléaires, bien après l’entrée du virus dans la cellule.
Expression des gènes
viraux / Réplication du génome viral
Les stratégies utilisées pour l’expression et la réplication des génomes
viraux varient en fonction de la classe de Baltimore du virus. Certaines
d’entre elles seront présentées aux chapitres ultérieurs.
Assemblage et
maturation
L’expression des gènes viraux permet la synthèse des protéines virales, et
la réplication permet l’accumulation de multiples copies du génome viral.
L’association des protéines de structure virales avec l’acide nucléique
viral aboutit à l’assemblage de nouvelles particules virales. La phase
d’éclipse se termine donc avec l’étape d’assemblage. Il arrive souvent que
les particules virales formées initialement soient immatures – c’est-à-dire,
peu infectieuses ou instables. Une étape de maturation est alors nécessaire
afin de produire des particules virales infectieuses.
Libération
Les particules virales peuvent être libérées par la lyse cellulaire, ou dans
les cas des virus enveloppés, par bourgeonnement. Le processus de
bourgeonnement n’est pas forcément fatal pour la cellule hôte. Il est donc
possible pour certains virus enveloppés de maintenir une infection
productive de façon persistante.
Toutes les particules virales libérées d’une cellule infectée ne sont pas
forcément infectieuses. En effet, le rapport de particules non-infectieuses
aux particules infectieuses varie selon le virus.
Protéines structurales
et non-structurales
Toutes les protéines virales incorporées dans la particule virale sont
considérées comme des protéines de structures – même si elles ne contribuent pas
à la morphologie ou la stabilité de la particule. Les protéines non-structurales
sont celles qui sont exprimées dans la cellule infectée, mais qui ne sont pas
incorporées dans la particule virale.
|
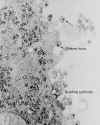
 Figure 5
Figure 5
Plages de lyse. Des dilutions en cascade d’un échantillon de
virus ont été étalées sur des cellules en monocouche. Plusieurs jours
d’incubation permettent une particule virale d’infecter une cellule et de la
tuer. Les virus libérés par la première cellule infectée se fixent sur les
cellules voisines, qui sont tuées à leur tour. La coloration permet de
visualiser les zones blanches où les cellules ont été tuées par l’infection
virale. Chaque "plage" de lyse résulte de la présence, à l’origine, d’une
seule particule virale dans l’échantillon. |
Effets des virus sur la synthèse
macromoléculaire de la cellule hôte
De nombreux virus inhibent la synthèse de l’ARN, de l’ADN ou des protéines de la
cellule hôte, afin de favoriser la production de protéines et d’acides
nucléiques viraux. Les mécanismes moléculaires déployés dans ce but sont très
divers, et varient selon le virus.
Effet cytopathogène (ECP)
La présence d’un virus provoque souvent des changements morphologiques chez la
cellule hôte. Quand les modifications provoquées par l’infection sont visibles
au microscope elles sont appelées, "l’effet cytopathogène" (ECP) du virus. Les
ECP peuvent comprendre des phénomènes relativement mineurs, comme le gonflement,
ou à l’inverse, le rétrécissement de la cellule; la formation de corps
d’inclusion à l’intérieur de la cellule; ou des effets drastiques comme le
détachement des cellules de la surface de la boîte de culture, la formation de
syncytia multinucléés, ou même la mort cellulaire.
L’infection virale induit souvent la mort cellulaire programmée, ou apoptose,
chez la cellule hôte. L’apoptose peut être considéré comme faisant partie de la
défense antivirale de l’hôte, car la mort d’une cellule infectée avant la
complétion du cycle de réplication virale empêchera la propagation de
l’infection. En particulier, si une cellule infectée meurt pendant la phase
d’éclipse, aucune particule virale infectieuse ne sera produite. Pour cette
raison, plusieurs virus codent pour des protéines non-structurales qui inhibent
ou retardent l’apoptose de la cellule infectée, afin de maximiser la production
de particules virales. En contraste, les virus dont le relargage se fait par
lyse de la cellule hôte peuvent provoquer la mort cellulaire à la fin du cycle
de réplication, afin de favoriser la libération des particules virales.
L’ECP dépend à la fois du virus, et de la nature de la cellule infectée.
Plusieurs virus provoquent des ECPs caractéristiques, qui constituent des
éléments d’identification des virus présents dans des échantillons cliniques
analysés aux laboratoires de virologie hospitaliers.
|
Points à retenir à propos
de l'infection de différents types cellulaires par des virus |
| |
Exprime le récepteur du virus? |
Possède la capacité de répliquer
le virus |
Permet l'entrée et la réplication
productive du virus |
| Cellule Permissive |
Peut-être |
OUI |
Peut-être |
| Cellule Susceptible |
OUI |
Peut-être |
Peut-être |
| Cellule Résistante |
NON |
Peut-être |
NON |
| Cellule Susceptible et Permissive |
OUI |
OUI |
OUI |
Techniques de détection et de
quantification des virus
Le seul moyen de visualiser les particules virales dans un échantillon
clinique, ou dans des cellules infectées, est la microscopie
électronique. Les autres techniques de détection et de quantification
des virus dépendent de la détection
1) des protéines virales par immunochimie (ELISA, ou tests rapides sur
bandelette), ou par hémagglutination
2) des acides nucléiques viraux par de la biologie moléculaire (PCR), ou
3) de la détection des effets provoqués par le virus sur des cellules
susceptibles (détection d’un ECP sur cellules en culture, ou
quantification du virus par plages de lyse).
Dans les deux premiers cas, les virus détectés peuvent être infectieux
ou non-infectieux. Seule la troisième catégorie de techniques renseigne
sur la présence des virus infectieux dans l’échantillon à analyser.
Quantification du titre infectieux par
plages de lyse
Le titre infectieux d’un virus peut être déterminé par le dénombrement des
plages de lyse formées sur un tapis cellulaire. Dans un premier temps,
l’échantillon est ensemencé sur des cellules adhérentes en monocouche dans une
boîte de culture. Après un temps d’incubation suffisant pour permettre
l’attachement et l’entrée du virus (de l’ordre d’une heure), le milieu liquide
est remplacé par un milieu semi-solide qui limite la diffusion des particules
virales. Quand les cellules infectées au début de l’expérience sont tuées par
l’ECP du virus, les particules virales qu’elles libèrent infectent seulement les
cellules à proximité, qui seront ensuite tuées à leur tour. Après plusieurs
cycles de réplication virale, les cellules mortes forment une plage de lyse, qui
est visualisée après coloration par un produit qui marque des cellules vivantes.
La plage de lyse apparaît comme une zone claire sur un fond coloré. Chaque plage
de lyse représente une particule virale infectieuse présente dans l’échantillon
initial.
Bien que cette technique soit applicable à de nombreux virus, les virus qui ne
provoquent pas la mort de la cellule infectée ne vont pas forcément former des
plages de lyse.
|

 Figure 1
Figure 1 Figure 5
Figure 5