|
x |
x |
|
 |
 |
|
DOENÇAS
INFECCIOSAS |
BACTERIOLOGIA |
IMUNOLOGIA |
MICOLOGIA |
PARASITOLOGIA |
VIROLOGIA |
|
|
VIROLOGIA - CAPÍTULO TRÊS
ESTRATÉGIAS DE REPLICAÇÃO DE VÍRUS DE DNA
Dr Margaret Hunt
Professor Emerita
Department of Pathology, Microbiology and Immunology
University of South Carolina School of Medicine
Tradução:
PhD. Myres Hopkins
|
|
EM INGLÊS |
|
En
Español |
|
NË SHQIPTARE |
Dê a
sua opinião
CONTATO |
|
BUSCA |
E-MAIL
DR MYRES HOPKINS |
|
|
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
OBJETIVOS
Análise descritiva das estratégias replicativas empregadas por vírus de
DNA animais
Identificação de prototipos virais associados a diferentes esquemas de
replicação de vírus de DNA
|
GENERALIDADES
Genomas virais
contém informações que:
-
garantem
a replicação de genomas virais
-
garantem
o empacotamento de genomas em virions
-
alteram a
estrutura e/ou função da célula hospedeira em maior ou menor grau.
ESTRATÉGIA VIRAL
Estratégia viral se
refere à maneira pela qual cada vírus realiza as funções acima. Visto que um
vírus é um parasita intracelular, ele tem que operar dentro dos limites
impostos pela célula hospedeira, ou contornar essas limitações.
ESTRATÉGIA DE REPLICAÇÃO DE VÍRUS DE DNA
Generalidades
-
O vírus precisa fazer
RNAm que pode ser traduzido em proteínas pela maquinária de tradução da
célula hospedeira.
-
O vírus
precisa replicar seu genoma.
-
Enzimas
do hospedeiro para a síntese de RNAm e para a replicação do DNA são
nucleares (exceto as que estão nas mitocôndrias) e assim, se um vírus quizer
se beneficiar dessas enzimas, ele tem que entrar no núcleo.
|
| |
VÍRUS NUCLEARES DE DNA
FAMÍLIA DOS
PARVOVÍRUS
Parvovirus são vírus muito pequenos (18 a 25nm de diâmetro), de fita simples de
DNA (parvum=pequeno). Eles têm um capsídeo icosaédrico e são não-envelopados. A
replicação do DNA ocorre no núcleo. O parvovírus humano B-19 replica em células
em divisão – principalmente em progenitores de eritrócitos na medula óssea – e
provocam a quinta doença (eritema infeccioso). Esta é normalmente uma doença
amena, mas o decréscimo na produção de eritrócitos pode vir a ser problema em
pessoas com vários tipos de anemia hemolítica severa.
|
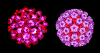 Figura 1
Figura 1
Vírus do papiloma
©
Dra.
Linda Stannard,
Universidade de Cape Town, África do Sul. Usado com permissão |
FAMÍLIA DO
PAPILOMAVIRUS
A
família do papilomavírus foi inicialmente agrupada junto com a família do
poliomavírus na família papovavírus (PApilloma, POlyoma, vírus VAcuolante símio
40) porque membros de ambas as famílias têm uma estrutura similar. Entretanto,
agora está claro que as duas famílias têm uma estratégia de replicação muito
diferente e porisso cada grupo ganhou o estatus de família.
|
PropRIEDADES DOS POLIOMavÍrus E PapilomavÍrus |
|
Eles são
pequenos: 40 - 60nm |
|
Eles são icosaédricos: principal proteína do capsídio é VP1, com menores
quantidades de VP2 e VP3 |
|
Eles são
não-envelopados |
|
Eles têm DNA circular, dupla-fita associados a histonas celulares (nucleossomos) |
Papilomavírus (figura 1)
são difíceis de crescer em cultura. Eles não vão ser discutidos posteriormente
nesta seção (mas veja a seção de
vírus de DNA
tumorais).
|
 Figura 2 Vírus SV40, um vírus polioma
©
Dr
J-Y Sgro,
Universidade de Wisconsin. Usado com permissão
Figura 2 Vírus SV40, um vírus polioma
©
Dr
J-Y Sgro,
Universidade de Wisconsin. Usado com permissão |
|
POLIOMAVÍRUS
Entre estes
se incluem o SV40, BK, JC e vírus do polioma. Todos têm mesma
estratégia de replicação do DNA. São vírus pequenos (~40nm de
diâmetro), icosaédricos, não-envelopados que se replicam no núcleo.
Depedendo da célula hospedeira, eles podem transformar a célula
(veja
aqui)
ou replicar o vírus e lisar a célula.
CICLO LÍTICO
Ligação, penetração e desnudamento
Proteínas do capsídio viral interagem com receptores na
superfície celular e a penetração é provavelmente via
endocitose. Vírions são transportados para o núcleo e
desnudados. O DNA (e histonas associadas) entram no núcleo,
provavelmente através de um poro nuclear.
Produção de RNAm e proteínas virais
A
expressão gênica é dividida nas fases inicial e tardia.
Genes
iniciais codificam
para enzimas e proteínas regulatórias necessárias para iniciar
os processos de replicação viral.
Genes
tardios codificam
para proteínas estruturais, proteínas necessárias para a
montagem do vírus maduro.
|
|

Figura 3
Expressão gênica inicial
Nota: - - - - indica regiões do transcrito primário que são removidas
no RNAm processado por splicing alternativo.
Modificado de Fiers et al.,Nature 273:113

Figura 4 Expressão gênica tardia
Nota: - - - - indica regiões do transcrito primário que são
removidas no RNAm processado por splicing alternativo. Setas em ponta de
lança indicam regiões traduzidas em proteínas
Modificado de Fiers et al.,Nature 273:113
|
FASE INICIAL DO
CICLO LÍTICO
Expressão gênica inicial
(figura 3)
O
promotor
inicial é reconhecido pela RNA polimerase IIdo hospedeiro (SV40
contém um potente acentuador).
Modificação pós-transcricional do RNA (5’ Cap, metilação,
poliadenilação, splicing, etc.) é realizado por enzimas do
hospedeiro. O transcrito inicial (transcrito primário) é feito e
este sofre processamento alternativo, resultando em RNAm para os
antígenos T
pequenos e grandes (essas proteínas têm mesmo terminal amínico,
mas terminais carboxílicos diferentes).
Os RNAm
são traduzidos no citoplasma.
Nota:
Transcritos primários que podem ser processados e codificam para
mais de uma proteína são encontrados em algumas famílias de
vírus e na célula hospedeira.
FASE TARDIA DO
CICLO LÍTICO
Por
definição a fase tardia se inicia com a replicação do genoma
viral.
Replicação do DNA
A
replicação do DNA do SV40/polyoma ocorre no núcleo.
Grande
antígeno T
é necessário para a replicação do DNA. Ele se liga à origem de
replicação.
Vírus do
polioma usam a DNA polimerase da célula hospedeira, que
reconhece a origem de replicação viral ‘se’ o antígeno T
estiver presente.
A
replicação do DNA é bidirecional (Há duas forquilhas
de replicação
por DNA genômico circular e a replicação envolve fitas de
replicação sentido/anti-sentido, fragmentos
de Okazaki,
DNA ligase,
etc.). Este processo de replicação do DNA é muito semelhante ao
que acontece na célula hospedeira – o que não é de surpreender,
pois o vírus está usando principalmente a maquinária hospedeira,
exceto pelo envolvimento do antígeno T.
Complexo
de histonas
hospedeiras, com DNA recém sintetizado.
Expressão gênica tardia
(figura 4)
RNAm
tardios são feitos após a replicação do DNA (uma grande
quantidade de DNA viral recém-sintetizado está agora disponível
como molde). RNAm iniciais ainda estão sendo transcritos, mas em
velocidade muito menor.
O
antígeno T está envolvido no controle do aumento da transcrição
do promotor tardio e da diminuição da transcrição do promotor
inicial. Ele também interage com proteínas hospedeiras e muda as
propriedades da célula hospedeira, agindo assim na transformação
celular e formação de tumor.
VP1, 2,
e 3 são feitas do mesmo transcrito primário, que realiza
splicing diferencial (figura 5). Isso faz com que o início da
leitura de VP1 seja diferente do de VP2 e VP3. Dessa forma, uma
região do DNA pode codificar para duas sequências de aminoácidos
diferentes, dependendo do códon de iniciação utilizado. Esta é
uma outra maneira pela qual vírus (e células) podem usar um
trecho pequeno de DNA para codificar para mais de uma sequência
protêica.
MONTAGEM
Os RNAm de VP1, 2 e 3 são traduzidos no citoplasma, as proteínas
são transportadas para o núcleo, e os
capsídios
são montados com DNA (e histonas da célula) dentro do capsídeo.
Grandes quantidades de capsídeos se acumulam no núcleo e formam
corpos de inclusão. Virions são liberados por lise celular.
|
 Figura 5
Figura 5
VP1, 2, e 3 são feitas do mesmo transcrito primário que faz splicing
diferencial. Isso faz com que o início da leitura de VP1 seja diferente do
de VP2 e VP3 |
 Figura 6
Figura 6
Expressão gênica pelo SV40.
Genes iniciais estão em vermelho, genes tardios estão em verde. Nota: -
- - - indica regiões do transcrito primário que foram removidas no RNAm
que foi processado por splicing alternativo. Área hachureada indica região
do RNA traduzido em diferentes fases de leitura, de acordo com as quais
transcrito produzido por splicing alternativo está sendo traduzido.
Modificado de Fiers et al.,Nature 273:11
|
|
ASPECTOS DIGNOS DE NOTA SOBRE A ESTRATÉGIA DOS VÍRUS POLIOMA |
|
Funções
iniciais e tardias |
|
Uso múltiplo da mesma sequência de DNA (splicing alternativo,
sobreposição de inícios de leitura) |
|
Proteína
multifuncional (Antígeno T) |
|
Pequeno genoma – portanto não é de surpreencer que o vírus codifica
para um número muito limitado de proteínas |
|
Célula hospedeira proporciona a maquinária de síntese de RNA,
maquinária de modificação do RNA, maquinária de síntese de DNA,
histonas para empacotamento do DNA |
|
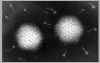 Figura 7a
Figura 7a
Estrutura do adenovirus
©
Dra.
Linda Stannard,
Universidade de Cape Town, África do Sul. Usado com permissão
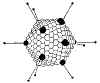 Figura 7b
Figura 7b
Estrutura do adenovirus |
ADENOVÍRUS
|
PROPRIEDADES DOS ADENOVÍRUS |
|
Maior que os papovavírus (70nm de diâmetro) |
|
Vírus não-envelopados, icosaédricos com fibras nos vértices (figura 7 e
8) |
Genoma 7 vezes maior que o do vírus do polioma
|
|
O DNA é linear, dupla fita, associado com proteínas básicas codificadas
pelo vírion (diferentemente dos vírus do papiloma e do polioma, os
adenovírus não usam histonas celulares para empacotar o DNA do vírion) |
|
| |
CÍCLO LÍTICO
Adsorção e penetração
Adenovirus
normalmente infectam células epiteliais. As fibras se ligam a receptor
na superfície das células e o vírus é englobado por endocitose. O vírus
aparenta ser capaz de lisar endossomas. O desnudamento ocorre em etapas.
O DNA é liberado no núcleo (provavelmente em um poro nuclear) (figura
9).
Fase
inicial
Transcrição
inicial: O adenovírus usa a RNA polimerase da célula hospedeira e RNAm
iniciais são transcritos a partir de regiões dispersas em ambas as fitas
(figura 10). Múltiplos promotores permitem maior flexibilidade de
controle. RNAm são processados pela célula hospedeira,
5’ Cap,
metilação, poliadenilação
e (às vezes) sistemas enzimáticos de splicing, sendo então exportados
para o citoplasma e traduzidos.
|
| |
A

B
 Figura 8
Modêlos do virion do adenovirus. A: Uma reconstrução de imagem
tridimensional da partícula intacta do adenovírus vista em conjunto com um
icosaedro
tri-axial (© EMBL Virus Structure Resource). B:
Uma seção estilizada da partícula do adenovírus baseada na compreensão atual
dos seus componentes polipeptídicos e DNA. Nenhuma seção real do icosaedro
conteria todos os componentes. Os constituintes virais são designados por
seus números de polipeptídeo com exceção da proteína terminal (TP).
Adaptado de Fields et al., Fundamental Virology (1996).
Figura 8
Modêlos do virion do adenovirus. A: Uma reconstrução de imagem
tridimensional da partícula intacta do adenovírus vista em conjunto com um
icosaedro
tri-axial (© EMBL Virus Structure Resource). B:
Uma seção estilizada da partícula do adenovírus baseada na compreensão atual
dos seus componentes polipeptídicos e DNA. Nenhuma seção real do icosaedro
conteria todos os componentes. Os constituintes virais são designados por
seus números de polipeptídeo com exceção da proteína terminal (TP).
Adaptado de Fields et al., Fundamental Virology (1996).
|
| |
As proteínas
iniciais incluem as que:
- são
necessárias para a transcrição (proteína E1A é necessária para a transcrição dos
outros genes iniciais; como resultado disso esses outros genes são às vezes
referidos como genes "tardios iniciais" e E1A é referido como um gene "inicial
imediato").
- são
necessárias para a síntese de DNA do adenovírus (inclui DNA polimerase)
- alteram a expressão dos genes da célula hospedeira.
Isso inclui genes cujos produtos interferem na resposta antiviral do
hospedeiro e/ou interfere na regulação do ciclo celular
|
| |
 Figura
9 Representação diagramática da captação e desnudamento de partículas de
adenovírus.
Adaptado de Zinsser Microbiology 20th Ed. Figura
9 Representação diagramática da captação e desnudamento de partículas de
adenovírus.
Adaptado de Zinsser Microbiology 20th Ed.
 Figura 10
Figura 10
Mapa de transcrição do adenovírus. Genes inicias são mostrados em vermelho.
Verde indica genes tardios. Linhas azuis indicam DNA. Colchetes indicam a
posição de promotores. Transcritos primários são feitos a partir de cada
promotor e em seguida sofrem splicing alternativo, o diagrama acima não mostra o
transcrito primário. Mostra apenas aquelas regiões presentes nos produtos do
splicing alternativo. Regiões ausentes indicam íntrons removidos.
Adaptado de Broker, T.R. In Processing of RNA. (Apirion, D
ed) 181-212, 1984
|
 Figura 11
Replicação do DNA do adenovírus por um mecanismo de deslocamento
Figura 11
Replicação do DNA do adenovírus por um mecanismo de deslocamento |
Fase
tardia
Replicação do DNA:
O adenovírus
codifica para sua própria DNA polimerase (que é uma das proteínas iniciais).
O DNA é replicado por um mecanismo de deslocamento de fita (figura 11). Não
há fragmentos de Okazaki,
ambas as fitas são sintetizadas de forma contínua.
DNA polimerases não
podem iniciar síntese de novo, elas precisam de um primer. No caso do
adenovírus, a proteína (TP) codificada pelo vírus age como um primer. Ela
está ligada covalentemente à ponta 5’ de todas as fitas de DNA de todos os
adenovírus.
|
 Figura 12
Figura 12
Mapa de transcrição do adenovírus. Genes iniciais são mostrados em vermelho.
Verde indica genes tardios. Azul indica DNA. Colchetes indicam os
promotores. Regiões ausentes indicam remoção dos íntrons.
Adaptado de Broker, T.R. In Processing of RNA.
(Apirion,
D ed) 181-212, 1984
 Figura
13
Processamento do transcrito primário viral Figura
13
Processamento do transcrito primário viral |
Transcrição tardia:
A maneira pela qual
a transcrição tardia é ligada ainda não é bem compreendida. RNAm tardios
codificam predominantemente para proteínas estruturais e existe UM promotor
tardio principal (figura 12). O transcrito primário é processado para gerar
vários RNAm monocistrônicos
(figura 12 e 13):
Há dois tipos de
clivagem do transcrito primário:
i. para produzir
vários terminais 3' que são depois poliadenilados
ii. para a remoção
de introns
Não é compreendido
como este processo é controlado para que as quantidades corretas de cada
RNAm sejam feitas. Ao que parece o vírus faz mais RNAm e proteínas do que as
necessárias para a montagem do vírion, de forma que o controle preciso não é
necessário.
|
| |
Montagem
A montagem das
partículas do adenovírus ocorre no núcleo. O DNA entra nas partículas após
capsídeos imatudos forem formados. Os capsídeos sofrem processo de
maturação, após o que as células lisam e os vírios escapam.
Mais proteínas
estruturais do que necessárias são feitas, e o excesso de proteínas
estruturais acumula no núcleo, onde formam corpos de inclusão.
|
| |
|
ASPECTOS DIGNOS DE NOTA SOBRE A ESTRATÉGIA DOS ADENOVÍRUS |
|
AdenovÍrus são maiores e mais complexos do que os papovavirus |
|
Adenoviruses codificam para sua própria DNA polimerase e proteínas de
empacotamento do DNA |
|
Entretanto, embora adenovírus codifiquem para sua própria DNA
polimerase, eles usam fatores do hospedeiro além das proteínas virais
para a replicação do DNA, e eles usam a RNA polimerase do hospedeiro e
sistemas de modificação do RNA. Sendo assim, a síntese de ácidos
nuclêicos precisa ocorrer no núcleo |
|
|
 Figura
14a Figura
14a
Estrutura do vírus do herpes
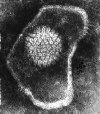 Figura 14b
Figura 14b
Virus do herpes simplex
©
Dra.
Linda M Stannard,
Universidade de Cape Town, África do Sul, 1995 (usado com permissão).
|
VÍRUS DO HERPES
|
PROPRIEDADES DO VÍRUS DO HERPES |
|
Vírions maiores (180 - 200nm) do que os adenovírus |
|
Genoma maior (tres a cinco vezes maior) do que os adenovírus |
|
DNA linear,
dupla fita |
|
Vírus envelopado icosaédrico (isso significa que solventes lipídicos
rapidamente inativam esses vírus) (figura 14) |
|
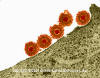 Figura 15a Vírus do herpes simplex adsorvendo à membrana plasmática
©
Dennis Kunkel Microscopy, Inc.
Used with permission
Figura 15a Vírus do herpes simplex adsorvendo à membrana plasmática
©
Dennis Kunkel Microscopy, Inc.
Used with permission
 Figura 15b
Figura 15b
Fusão do vírus ligado à membrana com a membrana plasmática |
Adsorção
e penetração
Muitos
vírus do
herpes,
incluindo o vírus do herpes simplex, pode se fusionar diretamente com a
membrana plasmática (levando ao desnudamento parcial) (figura 15). Esta
fusão com a membrana plasmática tem implicações tanto para o vírus como para
a célula hospedeira. Entre estas se incluem:
i) Visto que a
proteína de fusão está ativa em pH fisiológico, se ela estiver inserida na
membrana celular hospedeira durante o ciclo de crescimento do vírus, a
célula infectada pode potencialmente se fusionar com outras células e formar
um sincício.
ii) A membrana viral
deixa suas "impressões digitais" na membrana plasmática e esta é uma
possível dica de que a célula está infectada (figura 15b)
Os
capsídeos são transportados para o núcleo e o DNA passa para o núcleo
(provavelmente via poros nucleares)
|
 Figura
16 Figura
16
Expressão de genes iniciais imediatos, iniciais e tardios do vírus do herpe |
Fase
inicial
Transcrição inicial
(os RNAm durante esta fase são os RNAm alfa e beta) (figura 16)
O vírus do herpes
usa RNA polimerase hospedeira. Entretanto, um proteína de tegumento do
vírion (VP16) entra no núcleo com a infecção e é importante como parte do
complexo fator de transcrição reconhecido pela RNA polimerase. O vírus usa
enzimas de modificação do RNA hospedeiras.
Inicialmente, RNAm
alfa são transcritos. Estes são RNAm imediatamente iniciais e são exportados
para o citoplasma e traduzidos em proteínas alfa. As proteínas
α
traduzidas no citoplasma são transportadas para o núvleo, onde elas
habilitam os promotores beta para serem usados pela RNA polimerase
hospedeira (figura 16).
RNAm beta são
transcritos pela RNA polimerase hospedeira. (Genes beta são ainda “iniciais”
visto que eles são transcritos antes da síntese do DNA. Às vezes entretanto,
genes alfa são chamados de “imediatamente iniciais” e genes beta são
chamados “iniciais”). Proteínas beta estão envolvidas na regulação da
expressão gênica. Eles diminuem a expressão do gene alfa e são necessários
para a expressão do gene gama. Eles estão também envolvidos em vários
aspectos da síntese do DNA; por exemplo, genes beta do herpes codificam para
uma variedade de proteínas incluindo:
TENDO EM VISTA
QUE ESSAS PROTEÍNAS BETA SÃO CODIFICADAS PELO VÍRUS E NÃO SÃO ENZIMAS
CODIFICADAS PELO HOSPEDEIRO, ELAS SÃO POTENCIALMENTE “PONTOS DE
VULNERABILIDADE” NO CICLO DE VIDA DO VÍRUS, SENDO PORTANTO ALVOS PROMISSORES
PARA QUIMIOTERAPIA ANTIVIRAL
|
|
 Figura 18 Possíveis estruturas genômicas do vírus do herpes
Figura 18 Possíveis estruturas genômicas do vírus do herpes |
Fase
tardia
Replicação do DNA
O vírus do herpes codifica para
várias proteínas, além da DNA polimerase, que são necessárias para a
replicação do DNA. O mecanismo preciso da replicação do DNA não é conhecido.
A replicação do DNA é acompanhada de inúmeras recombinações. O DNA replicado
está presente contanto que moléculas concataméricas (repetições em tandem do
genoma ligado “cabeça à cauda”). Estas são clivadas até o tamanho do genoma
quando o DNA é empacotado no vírion (figure 18).
Alguns vírus herpes (ex. Vírus do
herpes simplex) têm uma estrutura genômica na qual duas partes do genoma
podem inverter uma em relação à outra (figura 18), e outros não. A
importância disso não está clara.
Transcrição tardia
Por definição,
transcrição tardia ocorre após a replicação do DNA. RNAm gama são produzidos
e são trasuzidos no citoplasma. Proteínas gama são predominantemente
estruturais. Há uma expressão diminuída de genes beta no estágio tardio.
Isso se deve provavelmente à regulação negativa da transcrição dos genes
beta por uma das proteínas gama.
No vírus do herpes
não há aparente organização do genoma em blocos de transcrição inicial ou
tardia.
|
 Figura 19A
Figura 19A
Vírus do
herpes simplex em vacúolos celulare e citoplasma de linfócito de sangue
periférico
©
Dennis Kunkel Microscopy, Inc.
Usado com permissão
 Figura 19B
Figura 19B
Vírus do
herpes simplex sobre e dentro de um linfócito de sangue periférico
©
Dennis Kunkel Microscopy, Inc.
Usado
com permissão
|
Montagem
A montagem ocorre no
núvleo. Um capsídeo é formado e o DNA entra no capsídeo. Os capsídeos
adquirem um envelope ao brotar através de áreas da membrana nuclear interna
que tenham proteínas de membrana virais nelas inseridas (figura 19). Essas
áreas têm proteínas tegumentares associadas com a face interna da membrana
nuclear interna. O envelope viral se fusiona então
com a membrana externa e o nucleocapsídeo desenvelopado é liberado no
citoplasma, onde adquire um tegumento mais maduro. Eles se tornam então
re-envelopados pelo brotamento em vesículas derivadas das vesículas de Golgi
e são então liberados.
A
proteína tardia requerida para a transcrição de RNAm imediatamente iniciais
na próxima rodada de infecção é empacotada no vírion.
O excesso de proteínas
estruturais se acumula no núcleo, frequentemente formando corpos de inclusão
(parte do efeito
citopático).
|
ASPECTOS DIGNOS DE NOTA SOBRE O VÍRUS DO HERPES |
| Não há blocos
definidos de genes iniciais ou tardios |
| Eles são mais
independentes do que alguns dos vírus menores |
| Devido ao fato
de serem mais independentes, eles têm mais “pontos de
vulnerabilidade” que podem ser alvos de drogas |
|
|



 Figura 19C
Estágios na exocitose do vírus do herpes do núcleo, em que o core do vírus é
montado, para a membrana plasmática
Figura 19C
Estágios na exocitose do vírus do herpes do núcleo, em que o core do vírus é
montado, para a membrana plasmática
|
 Figura 20 Coloração negativa e seção fina de vírus do grupo dos poxvírus
© F. Fenner
Figura 20 Coloração negativa e seção fina de vírus do grupo dos poxvírus
© F. Fenner |
VÍRUS DE DNA CITOPLASMÁTICOS
|
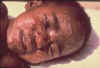 Figura 21 Garôto com varíola
CDC/Cheryl Tryon ctt1@cdc.gov
Figura 21 Garôto com varíola
CDC/Cheryl Tryon ctt1@cdc.gov |
POXVIRUSES
Há várias razões pelas
quais poxvirus (figura 20) têm importância:
-
Certos poxvírus são um
fato histórico, tal como o vírus da varíola (figura 21) e vaccinia (varíola
bovina, que foi usado na vacina da varíola (veja
aqui)
-
Vírus pox podem ser
possíveis agentes de bioterrorismo
-
Vírus pox são usados em
novas técnicas de desenvolvimento de vacinas (tal como a vaccinia produzida
por engenharia genética)
Alguns
membros desta família infectam homem (molluscum contagium (figura 22), vírus
orf, varíola símia, varíola bovina). Nota: varicela é causada por um herpesvírus
que não é membro da família poxviridae |
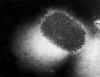 Figura 22
Micrografia de transmissão de poxvirus de
of molluscum contagiosum
CDC
Figura 22
Micrografia de transmissão de poxvirus de
of molluscum contagiosum
CDC |
|
PROPRIEDADES DOS POXVÍRUS |
|
Virions
granges |
Genoma grande, DNA dupla fita
tamanho variável mas são tão grandes quanto ou maiores do que os
herpesvirus |
|
Morfologia
complexa |
| Envelopados |
|
| |
Poxvirus replicam no
citoplasma. Isso significa que eles devem ter sua própria maquinária de síntese
de RNA e DNA.
Vaccinia é o mais
intensivamente estudado membro da família dos poxvirus.
Adsorção e penetração
O vírus se liga a
receptores da superfície celula. Ele entra nas células via endocitose ou via
fusão direta do vírus com a membrana plasmática. O vírus é então liberado no
citoplasma, sem sua membrana.
Fase inicial
Transcrição inicial
Após a fase inicial do
desnudamento ter ocorrido, o vírus pode fazer um número limitado de RNAm (os
RNAm imediados iniciais). Para fazer isso, o poxvírus precisa de uma RNA
polimerase dependente de DNA. A RNA polimerase hospedeira está no núcleo celular
e isso explica porque os poxviruses usam uma RNA polimerase dependente de DNA codificada pelo vírus
para fazer seus RNAs. Visto que esta enzima é
necessária imediatamente à infecção, ela deve ser trazida para a célula
infectada com o DNA da vaccinia, e assim se apresenta nos virions. DNA “nu” da
vaccinia que teve todas as proteínas removidas é portanto não infeccioso, visto
que ele não tem RNA polimerase associada a ele, e nada acontece no ciclo de vida
do vaccinia sem a RNA polimerase do vaccinia, uma vez que nenhum RNA ou
proteínas podem ser produzidos.
RNAm do poxvirus têm a
5’ Cap, são metilados e poliadenilados tais como os RNAm eucarióticos, mas os
RNAm da célula hospedeira são modificados no núcleo e o vaccinia replica no
citoplasma. Uma vez sendo o vaccinia citoplasmático, essas modificações devem
ocorrer por enzimas codificadas pelo vírus. As enzimas modificadoras são
empacotadas em vírions e assim aqueles RNAm feitos imediatamente após a infecção
podem ser modificados. Até o presente nenhum RNAm feito por splicing foi
demonstrado para o vaccinia (isso não é de surpreender, visto que ele replica no
citoplasma e enzimas hospedeiras de splicing estão no núcleo).
Um dos produtos de
tradução de RNAm iniciais é uma enzima de desnudamento. Ela permite desnudamento
posterior do DNA do vaccinia e mais genes podem agora ser transcritos – os genes
inicias são todos expressos agora. Poxvírus são excepcionais por codificarem
para uma proteína de desnudamento que tem que ser feita na célula
recém-infectada, antes do desnudamento ser concluído.
“Fábricas” de produção
viral são encontradas no citoplasma – sítios de replicação do vírus vaccinia.
As proteínas iniciais
estão envolvidas na replicação do DNA, transcrição do RNA, modificação do RNA e
desnudamento. Elas também incluem algumas proteínas estruturais.
|
| |
Fase tardia
Síntese de DNA
A síntese de DNA ocorre
em "fábricas" e usa um mecanismo não usual que não será tratado aqui.
Transcrição e tradução
tardias
Este é um processo
complexo. Algumas proteínas tardias são feitas durante a fase tardia, mas outras
somente no começo da fase tardia. Algumas proteínas iniciais não são
sintetizadas quando a replicação do DNA começa, enquanto que outras proteínas
iniciais são feitas durante a fase tardia, assim como as de fase inicial. Assim
há um controle complexo de quais proteínas são feitas pelo vaccinia e quando
elas são feitas. Isso significa que existem outros contrôles além dos simples
controles inicial/tardio (Este é um vírus muito grande, daí a complexidade é de
se esperar).
|
 Figura 23
Possível esquema para a formação de vírions pox infecciosos. O core do vírus se
embrulha em membrana citoplasmática e escapa quando a célula hospedeira é
lisada. Alguns outros vírios ligados à membrana podem brotar através de outras
membranas, em cujo caso eles têm duas membranas. Em qualquer caso os vírions são
infecciosos.
Adaptado de Baron, S. Ed. Medical Microbiology 4th Edition. 1996.
Figura 23
Possível esquema para a formação de vírions pox infecciosos. O core do vírus se
embrulha em membrana citoplasmática e escapa quando a célula hospedeira é
lisada. Alguns outros vírios ligados à membrana podem brotar através de outras
membranas, em cujo caso eles têm duas membranas. Em qualquer caso os vírions são
infecciosos.
Adaptado de Baron, S. Ed. Medical Microbiology 4th Edition. 1996. |
Montagem
A
montagem ocorre em "fábricas" no citoplasma. Os vírus novos imatudos
adquirem uma membrana quando no citoplasma – o mecanismo exato ainda não
é completamente compreendido, mas ao que parece o vírus se “embrulha” em
membranas celulares (figura 23). A idéia antida de que uma membrana é
formada diretamente a partir de lipídios e não a partir de uma membrana
pré-existente não é correta. Há uma maturação gradual das partículas
envelopadas. O vírus é normalmente liberado pela desintegração da célula
hospedeira, mas alguns saem por brotamento através das membranas (em
cujo caso eles têm membranas extras). Ambas as formas aparentam ser
infecciosas. O mecanismo exato pelo qual os vírus saem das células
infectadas depende do tipo de célula hospedeira.
|
ASPECTOS DIGNOS DE NOTA
SOBRE OS POXVIRUSES |
| Citoplasmáticos |
| Grande genoma |
| O vírus faz um monte
de coisas sozinhos |
| O vírus tem
capacidades não usuais comparados com outros vírus |
|
|
|
 Voltar
à Seção Virologia do Microbiologia e Imunologia Online
Voltar
à Seção Virologia do Microbiologia e Imunologia Online
This page last changed on
Monday, February 08, 2021
Página mantida por
Richard Hunt
|

 Figura 1
Figura 1  Figura 2 Vírus SV40, um vírus polioma
©
Dr
J-Y Sgro,
Universidade de Wisconsin. Usado com permissão
Figura 2 Vírus SV40, um vírus polioma
©
Dr
J-Y Sgro,
Universidade de Wisconsin. Usado com permissão
 Figura 5
Figura 5  Figura 6
Figura 6 Figura 7a
Figura 7a  Figura 11
Replicação do DNA do adenovírus por um mecanismo de deslocamento
Figura 11
Replicação do DNA do adenovírus por um mecanismo de deslocamento Figura 15a Vírus do herpes simplex adsorvendo à membrana plasmática
©
Dennis Kunkel Microscopy, Inc.
Used with permission
Figura 15a Vírus do herpes simplex adsorvendo à membrana plasmática
©
Dennis Kunkel Microscopy, Inc.
Used with permission
 Figura 19A
Figura 19A  Figura 20 Coloração negativa e seção fina de vírus do grupo dos poxvírus
© F. Fenner
Figura 20 Coloração negativa e seção fina de vírus do grupo dos poxvírus
© F. Fenner Figura 21 Garôto com varíola
CDC/Cheryl Tryon ctt1@cdc.gov
Figura 21 Garôto com varíola
CDC/Cheryl Tryon ctt1@cdc.gov  Figura 22
Micrografia de transmissão de poxvirus de
of molluscum contagiosum
CDC
Figura 22
Micrografia de transmissão de poxvirus de
of molluscum contagiosum
CDC 








