|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BACTERIOLOGY |
IMMUNOLOGY |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
VIDEO LECTURE |
IMMUNOLOGIE - CHAPITRE DEUX
LE COMPLEMENT
Gene Mayer,
Ph.D.
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Denis
Hudrisier, Ph.D.
Centre national de la recherche scientifique (CNRS) · Institute of
Pharmacology and Structural Biology
Université de Toulouse
|
|

 |
|
EN
ANGLAIS - ENGLISH |
|
SHQIP - ALBANIAN |
|
EN ESPANOL - SPANISH |
|
EM PORTUGUES - PORTUGUESE |
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
LECTURES:
Male et al. Immunology
7ème édition, chapitre 4
|
|
OBJECTIFS DU COURS
Comprendre les différentes voies d’activation du complément
Connaître les mécanismes enzymatiques et non-enzymatiques de l’activation du
complément
Connaître les propriétés biologiques des produits de l’activation du complément
Connaître l’importance du système du complément dans la résistance de l’hôte aux
infections, l’inflammation et les dommages tissulaires
Comprendre les mécanismes de régulation de la cascade du complément et ses
effecteurs
 Jules Bordet (1870-1961), Découvreur du complément National Library of
Medicine
Jules Bordet (1870-1961), Découvreur du complément National Library of
Medicine
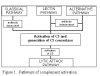 Figure 1
Figure 1
Voies d’activation de la cascade du complément
|
I. FONCTIONS DU COMPLEMENT
D’un point de vue historique, le terme de complément (abréviation usuelle : C’)
a été utilisé pour décrire un composant thermo-sensible (son activité est
détruite par chauffage à 56°C pendant 30 minutes), présent dans le sérum, et
capable de lyser des bactéries. On sait aujourd’hui que le complément participe
à la réponse immunitaire de bien d’autres manières. Le complément peut opsoniser
des bactéries et conduire à une phagocytose plus efficace ; il peut permettre le
recrutement de diverses cellules dont les neutrophiles et les macrophages sur le
site infectieux ; il peut participer à la régulation de la réponse anticorps et
faciliter l’élimination des complexes immuns (complexes antigène-anticorps) et
des cellules apoptotiques. Le complément a aussi des effets néfastes pour l’hôte
: il contribue à l’inflammation et l’endommagement des tissus et peut déclencher
des réactions d’hypersensibilité comme l’anaphylaxie.
Le complément comprend en fait plus de 20 protéines sériques différentes (voir
Table 1), produites par divers types cellulaires comme les hépatocytes, les
macrophages et les cellules épithéliales intestinales. Certaines protéines du
complément se lient aux immunoglobulines ou à des composants membranaires des
cellules. D’autres sont des proenzymes qui, une fois activés, vont cliver
d’autres protéines du complément. Après clivage, certains composants du
complément forment des fragments possédant la capacité d’activer des cellules,
d’augmenter la perméabilité vasculaire ou encore d’opsoniser les bactéries.
|
Table 1. Protéines du système du
complément
|
|
Voie classique |
Voie des lectines |
Voie alterne |
Voie lytique |
|
Protéines acivatrices:
C1qrs, C2, C3, C4
Protéines régulatrices:
C1-INH, C4-BP
|
Mannose binding protein (MBP), mannose-associated serine protease (MASP,
MASP2) |
C3, Facteurs B & D*, Properdine (P)
Facteurs I* & H, decay accelerating factor (DAF), Récepteurs du
complément 1 (CR1), etc…
|
C5, C6, C7, C8, C9
Protéine S |
|
Les composants soulignés acquièrent des propriétés
enzymatiques après activation.
Les composants marqués d’un astérisque ont une activité enzymatique à l’état
natif.
|
|
| |
II. VOIES D’ACTIVATION
DU COMPLEMENT
L’activation du complément peut-être divisée en 4 grandes voies (Figure 1): la
voie classique, la voie des lectines, la voie alterne et la voie lytique (attaque
membranaire). Les 3 premières voies nécessitent l’activation d’une activité
enzymatique C5 convertase et conduisent à la production du fragment C5b
essentiel pour l’activation du complexe d’attaque membranaire de la voie lytique.
|
|
MOVIE
Complement Activation and Biological Functions
High Resolution
Quicktime
Low Resolution Quicktime
© Scott R. Barnum, University of Alabama,
Birmingham, Ala., USA and
The MicrobeLibrary
|
|
CGAP
More detailed complement
pathways from CGAP/Biocarta |
VOIE CLASSIQUE (Figure 2)
Activation du C1
Le composant C1, composé de 3 sous-unités (C1q, C1r et C1s) se lie à la
partie Fc des molécules d’anticorps de type IgG et IgM ayant réagi avec leur
antigène. La liaison du C1 n’intervient pas lorsque l’anticorps n’est pas
complexé à l’antigène et dépend, par ailleurs, de la présence d’ions calcium
et magnésium [N.B. parfois, le C1 peut se lier à des anticorps agrégés (par
exemple, des agrégats d’IgG) ou à des pathogènes même en absence d’anticorps].
La liaison du C1 aux anticorps se produit via les sous-unités C1q et, pour
cela, C1q doit se lier à 2 molécules d’anticorps simultanément avant d’être
fermement lié. La liaison du C1q conduit à l’activation de la sous-unité C1r
qui, à son tour, active C1s. Le résultat est la formation d’un complexe
C1qrs qui est une enzyme capable de cliver le composant C4 du complément en
deux fragments, C4a et C4b.
Activation de C4 et C2 (génération
de la C3 convertase)
Le fragment C4b se lie à la membrane et le fragment C4a est libéré dans le
micro-environnement. Le composant "C1qrs", une fois activé, clive également
le composant C2 en fragments C2a et C2b. Le fragment C2a se lie à la
membrane et s’associe avec C4b ; le fragment C2b est libéré dans le micro-environnement.
Le complexe résultant C4bC2a est une C3 convertase, une enzyme qui clive C3
en C3a et C3b.
Activation de C3 (génération de
C5 convertase)
Le fragment C3b se lie à la membrane et s’associe avec C4b et C2a, alors que
C3a est libéré dans le micro-environnement. Le complexe C4bC2aC3b qui en
résulte est une C5 convertase. La génération de la convertase C5 marque la
fin de la cascade du complément spécifique à la voie classique.
Plusieurs produits de la voie classique ont de puissantes activités
biologiques qui contribuent à organiser la défense immunitaire. Certains de
ces produits peuvent aussi avoir des effets néfastes s'ils sont produits de
manière non régulée. Le tableau 2 résume les activités biologiques des
composants de la voie classique.
|
Table 2. Activités
biologiques des produits de la voie classique du complément |
|
Composant |
Activité biologique |
| C2b |
Prokinine : clivé par la plasmine
pour produire les kinines ; conduit à la formation d’œdème |
| C3a |
Anaphylotoxine : peut activer la
dégranulation des basophiles et des mastocytes, conduisant à une
augmentation de la perméabilité vasculaire et à la contraction des
muscles lisses. Ces évènements peuvent entraîner une réaction
anaphylactique. |
| C3b |
Opsonine : favorise la phagocytose par liaison
aux récepteurs du complément. Active les phagocytes.
|
| C4a |
Anaphylotoxine (plus faible que
C3a). |
| C4b |
Opsonine : favorise la phagocytose
par liaison aux récepteurs du complément. |
Si la voie classique n’était pas régulée, une production durable de C2b, C3a,
C4a s’ensuivrait. Il existe plusieurs moyens pour réguler l'activité de la voie
classique. Le tableau 3 résume la façon dont la voie classique est régulée.
|
Table 3. Régulation de la voie classique |
|
Composant |
Régulation |
| Tous |
C1-INH : dissocie C1r et C1s de
C1q |
| C3a |
L’inactivateur de C3a
(C3a-INA;Carboxypeptidase B) : dégrade C3a |
| C3b |
Facteurs H et I : Le facteur H
facilite la dégradation de C3b par le facteur I |
| C4a |
C3-INA |
| C4b |
C4 binding protein (C4-BP) et
Factor I : C4-BP facilite la dégradation de C4b par le facteur I;
C4-BP empêche aussi l’association de C2a avec C4b bloquant la
formation de la C3 convertase |
L'importance de C1-INH dans la régulation de la voie classique est démontrée par
le résultat d'une carence en cet inhibiteur. Une carence en C1-INH est en effet
associée à la formation d'angio-œdème héréditaire.
|
 A.
A.
Génération de la C3 convertase
de la voie classique
 B Génération de la C5 convertase de la voie classique
B Génération de la C5 convertase de la voie classique
 C
C
Activation du C3 dans la voie classique
Figure 2
|
 Figure 3 Voie initiée par les lectines
Figure 3 Voie initiée par les lectines |
VOIE DES
LECTINES
La voie des lectines (Figure 3) est très similaire à la voie
classique. Elle est initiée par la liaison d’une lectine liant le
mannose (MBL, mannose binding lectin) à des polysaccharides contenant du
mannose (mannanes) présent sur certaines surfaces bactériennes. La
liaison de la MBL à la surface des pathogènes conduit à l'association de
deux sérines protéases, MASP-1 et MASP-2 (MBL-associated-serine-proteases).
MASP-1 et MASP-2 sont similaires respectivement à C1r et C1s et MBL est
similaire à C1q. La formation des complexes tri-moléculaires MBL/MASP-1/MASP-2
conduit à l'activation de MASP et, en suivant, au clivage de C4 en C4a
et C4b. La suite de la cascade se déroule comme dans le cadre de la voie
classique : le fragment C4b se lie à la membrane et le fragment C4a est
libéré dans le micro-environnement. MASP activé va également cliver le
fragment C2 en C2a et C2b. C2a se lie à la membrane et s’associe avec
C4b et C2b est libéré dans le micro-environnement. Le complexe C4bC2a
constitue la convertase C3, qui clive C3 en C3a et C3b. C3b se lie à la
membrane et s’associe avec C4b et C2a alors que le C3a est libéré dans
le micro-environnement. Le complexe C4bC2aC3b qui en résulte est une C5
convertase. La génération de la convertase C5 marque la fin de la voie
des lectines.
Les activités biologiques et les protéines régulatrices de la voie des
lectines sont les mêmes que celles de la voie classique.
|
 Figure
4 Activation spontanée du C3 (C3 tick-over) Figure
4 Activation spontanée du C3 (C3 tick-over) |
VOIE ALTERNE
La voie alterne commence avec l'activation de C3 et nécessite les
facteurs B et D ainsi que des cations Mg + +, éléments tous présents
dans le sérum normal.
1. Boucle d'amplification de la formation de C3b (Figure 4)
Dans le sérum, il se produit une hydrolyse spontanée à faible taux de C3
ce qui conduit au fragment C3i. Le facteur B se lie à C3i et devient
alors sensible au facteur D, qui clive le facteur B en fragment Bb. Les
complexes C3iBb formés agissent comme une C3 convertase qui clive C3 en
C3a et C3b. Une fois C3b formé, le facteur B vient s’y lier et devient
sensible au clivage par le facteur D. Le complexe résultant C3bBb est
une C3 convertase qui continuera à générer davantage encore de C3b,
amplifiant ainsi la production de C3b. Si ce processus se poursuivait
sans contrôle, cela conduirait rapidement à la consommation de tout le
C3 présent dans le sérum. En fait, cette production spontanée de C3b est
étroitement contrôlée.
|

 Figure 5
Figure 5
Régulation du C3 activé par le DAF
 Figure
6 Régulation du C3 activé par le CR1 Figure
6 Régulation du C3 activé par le CR1
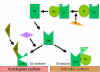 Figure
7 Stabilisation de la C3 convertase Figure
7 Stabilisation de la C3 convertase
 Figure 8
Figure 8
La C5 convertase stabilisée de la voie alterne
|
2. Contrôle de la boucle d’amplification
(Figures 5 and 6)
Lorsque le C3b formé spontanément se lie aux membranes des cellules de
l'hôte, il interagit avec le DAF (Decay Accelerating Factor), qui bloque
la liaison du facteur B au C3b empêchant ainsi la formation de C3
convertases supplémentaires. En outre, le DAF accélère la dissociation
de Bb du C3b de la C3 convertase déjà formée, ce qui stoppe la
production de C3b supplémentaire. Certaines cellules possèdent le
récepteur 1 du complément (CR1). La liaison de C3b à CR1 facilite la
dégradation enzymatique de C3b par le facteur I. De plus, la liaison de
la C3 convertase (C3bBb) au CR1 conduit également au fait que Bb se
dissocie du complexe. Ainsi, dans les cellules possédant le CR1,
celui-ci participe au contrôle de la boucle d'amplification. Enfin, le
facteur H peut se lier au C3b lié à une cellule ou en phase fluide et
facilite alors la dégradation enzymatique de C3b par I. Ainsi, la boucle
d'amplification est contrôlée en bloquant la formation de la C3
convertase, en dissociant cette C3 convertase, ou par la digestion
enzymatique du C3b. L'importance du contrôle de cette boucle
d'amplification est illustrée chez les patients présentant des anomalies
génétiques du facteur H ou I. Ces patients ont un déficit en C3 et
présente une susceptibilité accrue à certaines infections.
3. Stabilisation de la C3 convertase par l’activateur (protecteur) de
surface (Figure 7)
Lorsqu'il est lié à un activateur approprié de la voie alterne, le
fragment C3b va se lier au facteur B, lequel est clivé par voie
enzymatique par le facteur D pour générer la C3 convertase (C3bBb) de la
voie alterne. Toutefois, le C3b est résistant à la dégradation par le
facteur I et la C3 convertase n'est pas rapidement dégradée, car elle
est stabilisée par l’activateur de surface. Le complexe est en outre
stabilisé par la liaison de la properdine à C3bBb. Les activateurs de
surface de la voie alterne sont des composants sur présents à la surface
d'agents pathogènes et incluent notamment le LPS des bactéries Gram-négatives
ainsi que les parois cellulaires des bactéries et des levures. Ainsi,
lorsque le fragment C3b se lie à un activateur de surface, la C3
convertase formée sera stable et continuera à générer les fragments C3a
et C3b supplémentaires par clivage de C3.
4. Génération de la C5 convertase (Figure 10)
Une partie du fragment C3b généré par la C3 convertase et stabilisé sur
les surfaces activatrices va se lier au complexe C3bBb pour former un
complexe C3bBbC3b. Ce dernier complexe constitue la C5 convertase de la
voie alterne. La génération de la C5 convertase marque la fin de la voie
alterne. La voie alterne peut être activée par de nombreuses bactéries
Gram-négatives (les plus significatives étant Neisseria meningitidis, et
Neisseria gonorrhoeae), ainsi que par certaines bactéries
Gram-positives, certains virus et des parasites conduisant, au final à
la lyse de ces organismes. Ainsi, la voie alterne d'activation du
complément fournit un autre moyen de protection contre certains agents
pathogènes avant même qu’une réponse anticorps soit déclenchée. Une
carence en composant C3 conduit à susceptibilité accrue aux micro-organismes
mentionnés ci-dessus. Sur le plan évolutif, la voie alterne pourrait
être la voie la plus primitive du système du complément alors que les
voies classique et lectine ont vraisemblablement évolué à partir de
cette voie ancestrale.
|
| |
|
| |
Rappelez-vous que la voie alterne fournit un moyen de
résistance non spécifique contre l'infection ne nécessitant pas la
participation d'anticorps et fournit donc une première ligne de défense
contre un certain nombre d'agents infectieux.
De nombreuses bactéries Gram-négatives et quelques bactéries Gram-positives,
certains virus, les parasites, les globules rouges hétérologues, les
immunoglobulines agrégées (notamment les IgA) et quelques protéines autres
(par exemple des protéases, des produits du système de coagulation) peuvent
activer la voie alterne. Une protéine issue du venin de cobra, le cobra
venom factor (CVF), a été très étudiée pour sa capacité à activer la voie
alterne du complément.
|
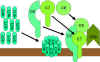 Figure 9 La voie lytique
Figure 9 La voie lytique |
LA VOIE LYTIQUE DU COMPLEXE D’ATTAQUE MEMBRANAIRE (Figure 9)
Les C5 convertases de la voie classique (C4b2a3b), de la voie des
lectines (C4b2a3b) ou de la voie alterne (C3bBb3b) ont la propriété commune
de cliver le fragment C5 en C5a et C5b. Le fragment C5a reste dans la phase
liquide alors que le C5b s’associe rapidement aux fragments C6 et C7 et
s'insère dans la membrane. Par la suite, le fragment C8 vient également se
lier, suivi de plusieurs molécules de fragment C9. Les molécules C9 forment
un pore dans la membrane activatrice à travers lequel le contenu cellulaire
fuit, conduisant alors à la lyse de la cellule. La lyse due au complément
n'est donc pas un processus enzymatique, mais résulte vraisemblablement de
dommages physiques à la membrane. Le complexe constitué de C5bC6C7C8C9 est
désigné sous le nom de complexe d'attaque membranaire (CAM).
Le fragment C5a généré lors de la voie lytique possède plusieurs effets
biologiques puissants. D’une part, il s’agit de l’anaphylotoxine la plus
puissante. De plus, C5a agit comme un facteur chimiotactique pour les
neutrophiles et stimule le burst respiratoire dans ces cellules. Enfin, C5a
stimule la production de cytokines inflammatoires par les macrophages. Ces
activités sont contrôlées par l’inactivation du C5a par la carboxypeptidase
B (C3-INA).
Une partie du complexe C5b67 formé peut se dissocier de la membrane
cellulaire et passer en phase fluide. Il pourrait alors aller se fixer sur
la membrane de cellules voisines et conduire à leur lyse. Dans les faits,
cela ne se produit car la Protéine S (vitronectin) se lie au C5b67 soluble
et empêche sa liaison aux autres cellules.
|
 Figure
10 Régulation du complexe C1rs (C4 convertase) par le C1-INH Figure
10 Régulation du complexe C1rs (C4 convertase) par le C1-INH |
III. PRODUITS BIOLOGIQUEMENT ACTIFS DE
LA CASCADE D’ACTIVATION DU COMPLEMENT La
cascade d’activation du complément fournit plusieurs molécules biologiquement
actives qui contribuent à la résistance aux infections, à l’anaphylaxie et à
l’inflammation (voir ci-dessous).
Production des Kinines
Le fragment C2b généré lors de la voie classique d’activation du complément
est une prokinine qui devient active après dégradation enzymatique par la
plasmine. Un excès de production de C2b est contrôlé par l’inhibiteur du C1
(C1-INH, aussi connu sous le nom de serpine) qui inhibe l’activation du C2
en dissociant C1rs du complexe C1qrs (Figure 10). Un déficit génétique en
C1-INH conduit donc à une surproduction de C2b et cause l’œdème
angioneurotique héréditaire. Le Danazol qui favorise la production de C1-INH
ou l’acide ε-amino caproïque qui inhibe l’activité de la plasmine peuvent
être utilisées pour traiter ces patients.
|
|
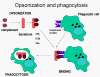 Figure 11
Figure 11
Les protéines du complément se lient à la surface des micro-organismes
et déclenchent la phagocytose via les récepteurs au complément
 Figure 12
Figure 12
Effets biologiques du fragment C5a
|
Anaphylotoxines
Les fragments C4a, C3a et C5a (classés en ordre croissant d'activité) sont
tous des anaphylotoxines qui provoquent la dégranulation des basophiles et
des mastocytes ainsi que la contraction des muscles lisses. Les effets
indésirables de ces peptides sont contrôlés par la carboxypeptidase B
(C3a-INA).
Facteurs chimiotactiques
Le C5a et le CAM (C5b67) sont tous les deux des facteurs chimiotactiques. Le
C5a est également un puissant activateur des neutrophiles, des basophiles et
macrophages et permet également l'induction de molécules d'adhésion sur les
cellules endothéliales vasculaires (Figure 12).
Opsonines
Les fragments C3b et C4b déposés à la surface de micro-organismes peuvent
fixer le récepteur de type 1 au complément (CR1) présent sur les cellules
phagocytaires et promouvoir ainsi la phagocytose opsonique (Figure 11).
Autres produits biologiquement actifs résultant de
l'activation du complément
Les produits de dégradation du fragment C3 (iC3b, C3d et C3e) peuvent
également se lier à des cellules différentes par l’intermédiaire de
récepteurs au complément distincts et moduler les fonctions de ces cellules.
En résumé, le système du complément participe à la fois à une réponse
immunitaire spécifique et non-spécifique et génère un certain nombre de produits
d'importance biologique et physiopathologique (tableau 4).
Il existe des déficits génétiques connus pour la plupart des composants du
complément, mais la carence en C3 reste certainement le déficit en complément le
plus grave et le plus mortel. Des déficits en complément peuvent également se
produire au décours de maladies immunitaires complexes (comme par exemple dans
le lupus Erythémateux Disséminé, SLE) et lors d’infections bactériennes, virales
ou parasitaires aiguës et chroniques.
|
|
RESSOURCE WEB
Angio-oedema
héréditaire
On-line Mendelian inheritance in man (NIH) |
|
|
|
|
|
|
Table 4. Activités des produits de l’activation du complément
et facteurs qui les contrôlent |
| Fragment |
Activité |
Effet |
Facteur(s) de contrôle |
| C2a |
Prokinine, afflux de liquide
plasmatique dans le tissu |
Oedeme |
C1-INH |
| C3a |
Dégranulation des basophiles
et des mastocytes ; augmentation de la perméabilité vasculaire ;
contraction des muscles lisses |
Anaphylaxie |
C3a-INA |
| C3b |
Opsonine, activation des
phagocytes |
Phagocytose |
Facteurs H et I |
| C4a |
Dégranulation des basophiles
et des mastocytes ; augmentation de la perméabilité vasculaire ;
contraction des muscles lisses |
Anaphylaxie
(activité la plus faible) |
C3a-INA |
| C4b |
Opsonine |
Phagocytose |
C4-BP et Facteur I |
| C5a |
Dégranulation des basophiles
et des mastocytes ; augmentation de la perméabilité vasculaire ;
contraction des muscles lisses |
Anaphylaxie
(activité la plus forte) |
C3a-INA |
| Chimiotactisme, stimulation
burst respiratoire, activation des phagocytes, stimulation de la
production de cytokines inflammatoires |
Inflammation |
| C5bC6C7 |
Chimiotactisme |
Inflammation |
Protéine S
(vitronectin) |
| Attachement à d’autres
membranes que la membrane activatrice |
Dommages tissulaires |
|
|
Vous avez appris
Les protéines du complément
es différences et les similitudes des voies
d’activation du composant C3
’importance des différentes voies dans l’immunité
spécifique et non-spécifique
Le rôle des différents produits de la cascade du
complément dans l’amplification de la réponse spécifique et non-spécifique
ainsi que dans l’inflammation
|
| Table
5. Déficiences en complément et maladies |
| Voie/composant |
Maladie |
Mécanisme |
| Voie classique |
|
| C1INH |
Angio-œdème héréditaire |
Surproduction de C2b (prokinine) |
| C1, C2, C4 |
Prédisposition au lupus |
Ces composants opsonisent les
complexes immuns permettant leur maintien à l’état soluble : une
déficience en ces composants favorise la précipitation de
complexes immuns dans les tissus générant une inflammation. |
| Voie des lectines |
|
| MBL |
Susceptibilité accrue des
enfants ou des individus immunodéprimés aux infections
bactériennes |
Impossibilité d’initier la
voie des lectines |
| Voie alterne |
|
| Facteurs B ou D |
Susceptibilité accrue aux
infections bactériennes pyogéniques (générant du pus) |
Absence d’opsonisation des
bactéries |
| C3 |
Susceptibilité accrue aux
infections bactériennes |
Absence d’opsonisation des
bactéries et d’utilisation du complexe d’attaque membranaire |
| C5, C6, C7 C8, et C9 |
Susceptibilité accrue aux
infections par des bactéries Gram- |
Pas d’attaque de la membrane
externe des bactéries Gram-négatives |
| Properdine (liée à l’X) |
Susceptibilité aux méningites
à Meningocoques |
Absence d’opsonisation des
bactéries |
| Facteurs H ou I |
Déficience en C3 et
susceptibilité accrue aux infections bactériennes |
Activation incontrôlée du C3
par la voie alterne conduisant à une déplétion en C3 |
|
|


|
 Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
Retourner à la section d'immunologie de Microbiologie et Immunologie On-line
This page last changed on
Thursday, October 25, 2012
Page maintained by
Richard Hunt
Please report any problems to richard.hunt@uscmed.sc.edu
|

 A.
A.
 Figure 3 Voie initiée par les lectines
Figure 3 Voie initiée par les lectines
 Figure 5
Figure 5 Figure
10 Régulation du complexe C1rs (C4 convertase) par le C1-INH
Figure
10 Régulation du complexe C1rs (C4 convertase) par le C1-INH





