|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
ENGLISH |
İMMÜNOLOJİ BÖLÜM ON
BÜYÜK DOKU UYGUNLUK KOMPLEKSİ VE T-HÜCRE RESEPTÖRLERİ- İMMÜN YANITTAKİ
ROLLERİ
Gene Mayer, Ph.D
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Jennifer Nyland, Ph.D
Assistant Professor of Pathology, Microbiology and Immunology
University of South Carolina
Çeviri:
Doç. Dr. Erkan Yula
İzmir, Katip Çelebi Üniversitesi, Tıp Fakültesi, Tıbbi Mikrobiyoloji
Anabilim Dalı
|
|
FRANCAIS |
|
PORTUGUESE |
|
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
|
ÖĞRENİM HEDEFLERİ
Bağışıklık yanıtta büyük doku uygunkluk komplekslerinin rolüne bakış
açısı kazandırmak
Sınıf I ve Sınıf II moleküllerinin yapısını ve fomksiyonunu tanımlamak
Sınıf I ve Sınıf II moleküllerinin polimorfizm doğasını tartışmak
Antijen için T hücre reseptör yapısını tanımlamak
TCR çeşitliliğinde genetik temelleri tartışmak
CD3 kompleks ve kostimülatör moleküllerin rolünün tartışılması
İmmünolojik sinapsların doğasını tanımlamak
T hücre aktivasyonu için gereksinimleri tartışmak
|
TARİHÇE
Hücreler arası etkileşim kazanılmış immün yanıtta
patojenlerden korunmada kritik öneme sahiptir. Bu etkileşimler primer
komponentleri T hücre antijen reseptör (TCR) ve büyük doku uygunluk kompleksi (MHC)
olan immünolojik sinapsların tarafından organize edilmektedir. TCRnin temel
fonksiyonu MHCye doğru bağlanmış haldeki antijeni tanıma ve dış sinyali
hücrenin iç kısmına sinyali iletmektir. Peptidin MHC ye non kovalent
bağlanmamasından dolayı immünolojik sinapsların sabitlenmesine yardımcı birçok
faktör mevcuttur.
MHCde kodlanmış gen ürünlerinin ilk olarak nakledilen
dokularının reddinde önemli olduğu tespit edildi. Ayrıca, MHCde bulunan
genlerin yüksek polimorfik olduğu bulundu (yani popülasyonda birçok farklı
allelik gen formları mevcuttur). Farelerin akraba suşları ile yapılan çalışmalar
MHC genlerinin hem hümoral ve hem de hücresel bağışıklık yanıtların kontrolünde
etkili olduğu gösterildi. Örneğin, farelerin bazı suşları belirli bir antijene
yanıt verebilir fakat diğer suşlar vermez ve bu suşlar, sadece MHC genlerinin
bir yada daha fazlasında farklılık göstermektedir. Daha sonraki çalışmalar, MHC
tarafından kodlanan iki çeşit molekül olduğunu, sınıf I ve sınıf II MHC, farklı
T hücre sınıfları tarafından tanındığı bulundu. Sınıf I molekülleri bütün
nükleuslu hücrelerde (kırmızı kan hücreleri hariç.), sınıf II molekülerin ise
dentritik hücrler, makrofajlar ve B hücrelerini içeren antijen sunan hücrelerle
birkaç farklı hücre türün olduğu bulundu (Şekil 1).
MHC genlerinin bağışıklık yanıttaki rolleri, TCR
antijenleri nasıl tanıdığı keşfedilene kadar anlaşılamamışıtı. TCRnin antijenik
peptidleri MHC molekülleri ile eşlenik olarak tanıdıkları gösterildi. T hücrler,
MHC gen ürünlerine non kovalent bağlanan antijenlerin protein kısımlarını
tanımaktadır. Sitotoksik T hücreleri (Tc), sınıf I MHC moleküllerine bağlanan
peptid kısımları tanırken yardımcı T hücreleri (Th) sınıf II MHC moleküllerine
bağlanan peptidleri tanımaktadır. MHC moleküllerinin ve TCRnin üç boyutlu
yapısı X ışını kristallografisi tarafından tanımlanarak TCR, MHC gen ürünleri ve
antijenin etkileşimi ortaya çıkarılmıştır.
|
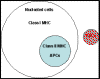 Şekil 1
Şekil 1
Sınıf I ve Sınıf II MHC moleküllerinin insan hücrelerindeki dağılımı
 Şekil 2
Şekil 2
MHC Sınıf 1 molekülü alfa 1 (sarı), alfa 2 (yeşil) ve
alfa 3 (mavi) üç globüler alana (domain) sahiptir.
Alfa 3 alanı MHC olmayan kodlanmış beta 2 mikroglobulin (pembe) ile
yakından ilişkilidir.
Sonraki disülfid köprüleri (kırmızı) ile sabitlenmiştir ve immünglobülin
domaini ile üç boyutlu yapısal benzerlik vardır.
Her bir birey için özgül determinantlar taşıyan alloantijenik bölgeler
alfa 1 ve alfa 2 bölgelerinde bulunur.
Sonraki karbonhidrat zincirine (mavi, CHO) sahiptir. Sitoplazmik alanda
fosfat bulunur. Papain yarıkları plazma membranın dış yüzeyine yakındır.
|
SINIF I MHC MOLEKÜLLERİNİN
YAPISI
Molekül Sınıf
I MHC molekülleri uzun α ve kısa β zinciri olmak üzere iki
polipeptid zincirrden oluşmaktadır ve bu yapı β2-mikroglobulin
olarak adlandırılmaktadır (Şekil 2). α zinciri 4 bölgeden oluşur.
- Hücresel bölgede, fosforilasyon ve hücre iskeleti
elemanlarına bağlanma bölgelerine sahiptir.
- Transmembran bölge, hücre membranına gömülen hidrofik
aminoasitleri içerir.
- CD8e bağlanan yüksek derecede korunmuş α3 immünglobülin
benzeri alan.
- α1 ve α2 alanlarından oluşmuş yüksek derece polimorfik
peptid bağlanma bölgeleri. β2-mikroglobülin, α zincirle birleşir
ve molekülün uygun adaptasyonunu devam ettirmesine yardım eder.
Antijen bağlanma oluğu
Sınıf I MHC molekülünün hangi kısmının daha fazla değişken
olduğu ile ilgili analizler, peptit bağlama bölgesini içeren α1
ve α2 bölgelerinin daha değişken olduğunu göstermiştir (Şekil
3). Peptit bağlayan oluğun X-ray kristalografisi, oluğun her bir
tarafında duvar oluşturan iki α sarmalından oluştuğunu, tabanı
oluşturan 8 β burgusundan oluştuğunu göstermiştir. Peptit olukla
sınırlandırılır ve oluğu kaplayan kalıntılar peptitle temas
kurarlar (Şekil 4). Bunlar çoğu polimorfik olan arta kalan
kısımlardır. Oluk yaklaşık 8-10 amino asit uzunluğundaki
peptitlerin yerleşebileceği büyüklüktedir. Sınıf I moleküller
polimorfiktir ve farklı sınıf I moleküller farklı peptitleri
bağlayabilir. Her bir sınıf I molekül sadece belirli peptitleri
bağlayacaktır ve peptidin bağlanması için kriterlere uyum
sağlamalıdır. Örneğin Şekil 5de sınıf I molekül karboksi ucunda
lösin (L) veya tirozin (Y) veya fenil alanin (F) 4. amino asit
olarak içeren peptidi bağlayacaktır. Bu iki koşul sağlandığında
diğer peptitlere bakılmaksızın ipeptit bağlanacaktır. Benzer
şekilde sınıf I molekül, amino ucunda ikinci amino asit olarak
trirozin içeren veya karboksi uçta valin (V), izolösin (I) veya
lösin (L) herhangi bir peptit bağlanacaktır (Şekil 5). Böylece,
her bir sınıf I molekül için, MHC molekülüne bağlanmadan önce
peptitde belirli amino asitler özel yerleşim yerlerinde
olmalıdır. Bu yerler ise çapa bölgeleri olarak
adlandırılmaktadır. Peptidin uçları sınıf I molekülün bağlanma
oluğunun yakın uçlarına gömülür.
MHC içinde Sınıf 1 molekülünü kodlayan 6 gen HLA-A, HLA B,
HLA-C, HLA-E, HLA-F ve HLA-G bulunur. Bunlar arasında HLA-A, HLA
B, ve HLA-C en önemli ve en polimorfik olanlarıdır. Tablo 1 Her
bir lokustaki polimorfizm derecesini göstermektedir.
|
 Şekil 3
Şekil 3
Sınıf I MHC moleküllerinin alfa zincirindeki büyük amino asid
değişkenliği alfa 1 ve alfa 2 bölgelerinde gerçekleşmektedir. En büyük
amino asit polimorfizmi duvar çizgisinde ve peptid bağlayan olukta
bulunur.
|
 Şekil 4
Şekil 4
a. Sınıf I MHC moleküllerinde peptid bağlayıcı oluk.
b. Vurgulanan kısın-mlar yüksek değişken rezidüleri temsil etmektedir.
Değişken rezidüler peptid bağlama cebinin etrafında kümelenir.
 Şekil 5
Şekil 5
Anchor sites in peptides that bind to class I MHC molecules (adapted
from Janeway et al. Immunobiology 6th Edition. Sınıf I MHC moleküllerini
bağlayan peptiddeki çapa bölgeleri (Janeway et al. Immunobiology 6.
Baskıdan uyarlanmıştır.)
|
| |
|
Tablo 1. Sınıf 1 MHC genlerinin
polimorfizmi |
| Gen
bölgesi |
Allellerin sayısı
(allotypes) |
| HLA-A |
218 |
| HLA-B |
439 |
| HLA-C |
96 |
| HLA-E, HLA-F
ve HLA-G |
Nispeten az
sayıda allel |
|
|
|
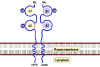 Şekil 6 MHC Sınıf II molekülleri bir birinin eşi olmayan iki peptitden
oluşmuştur (alfa ve beta) ve bunlar birbirine non-kovalent olarak
bağlanmıştır ve plazma membranını hücre dışında N terminal uç ile arşlar.
Her bir zincirdeki membrana en yakın bölgeler yapısal olarak
immünoglobülinlerle ilişkilidir. Alfa 1 bölgesi dışında tüm domainler
disülfit bağları (kırmızı) ile stabilleştirilmiştir. Alfa ve beta
zincirin her ikiside glikolizedir. Beta zincir alfa zincirden daha
kısadır (beta mol. Ağırlığı 28.000) ve alloantijenik ksımlar içerirler.
MHC II molekülünün alfa zincirinde bazı polimorfizmler bulunmaktadır.
Şekil 6 MHC Sınıf II molekülleri bir birinin eşi olmayan iki peptitden
oluşmuştur (alfa ve beta) ve bunlar birbirine non-kovalent olarak
bağlanmıştır ve plazma membranını hücre dışında N terminal uç ile arşlar.
Her bir zincirdeki membrana en yakın bölgeler yapısal olarak
immünoglobülinlerle ilişkilidir. Alfa 1 bölgesi dışında tüm domainler
disülfit bağları (kırmızı) ile stabilleştirilmiştir. Alfa ve beta
zincirin her ikiside glikolizedir. Beta zincir alfa zincirden daha
kısadır (beta mol. Ağırlığı 28.000) ve alloantijenik ksımlar içerirler.
MHC II molekülünün alfa zincirinde bazı polimorfizmler bulunmaktadır.
 Şekil 7
Şekil 7
Sınıf II MHC molekülünün beta zinciri için en büyük polimorfizm, beta I
bölgesindeki oluğun duvar ve tabanını oluşturan peptitlerdeki amino
asitlerde görülmektedir.
|
SINIF II MHC MOLEKÜLLERİNİN YAPISI
Molekül
Sınıf II MHC molekülleri yaklaşık olarak eşit uzunlukta
olan α ve β zincirden oluşan iki polipeptid zincirden oluşur (Şekil
6). Her iki zincirde dört bölge bulunur:
- Hücresel bölgede, fosforilasyon ve hücre iskeleti
elemanlarına bağlanma kısımlarını içerir.
- Transmembran bölge, hücre membranına gömülen hidrofik
aminoasitleri içerir.
- Yüksek ölçüde korunmuş α2 alanı ve CD4e bağlanan yüksek
ölçüde korunmuş β2 alanı
- α1 ve β1 alanlarından oluşan yüksek derece polimorfik peptid
bağlanma bölgeleri.
Antijen bağlayan oluk
Sınıf I MHC moleküllerinde olduğu gibi, sınıf II MHC
moleküllerinin en değişken bölgelerinin nereler olduğu ile ilgili
analizler ile peptit bağlama bölgesi olan α1 ve β1 bölgelerinin en
değişken bölgeler olduğu bununmuştur (Şekil 7). Peptit bağlayan
oluğun yapısının sınıf I molekülde olduğu gibi X-ray kristalografisi
ile, oluğun her bir tarafında duvar oluşturan iki α sarmalından
oluştuğunu, tabanı oluşturan 8 β burgusundan oluştuğunu göstermiştir.
Her iki α1 ve β1 zinciride peptit bağlama oluğunun yapısına
katılmaktadır. Oluğa bağlı peptid ve oluğu dolduran rezidüler,
peptitle temas kurarlar. Bunlar çok polimorfik rezidülerdir. Sınıf
II molekülün oluğunun bir ucu açıktır ve böylece oluk yaklaşık 13-25
amino aist uzunluğundaki daha büyük peptitlere uyum
sağlayabilmektedir bu durumda bir kısım amino aistler oluğun dışına
yerleşmektedir. Belirli bir peptidin oluğa bağlanıp bağlanmaması
oluğu kaplayan aminoasitlere bağlıdır. Çünkü sınıf II moleküller
polimorfiktir ve farklı sınıf II moleküller farklı peptidleri bağlar.
Sınıf I moleküller gibi, her bir sınıf I molekülü sadece belirli bir
peptidi bağlamaktadır ve bağlanmak için birtakım kreiterlerin
uyuşması gerekmektedir (örneğin çapa bölgesi)
MHCde sınıf II molekülünü kodlayan 5 lokus bulunmaktadır. Her biri
α zinciri için bir gen ve β zinciri için en az bir gen içermektedir.
Bu lokuslar HLA-DP, HLA DQ, HLA-DR, HLA-DM, ve HLA-DO olarak
adlandırılmışlardır.
Bunların arasınds HLA-DP, HLA DQ ve HLA-DR en polimorfik ve en
önemli olanlardır. Tablo 2de her bir lokus için polimorfizmin
derecesi görülmektedir.
|
| |
MHC NİN ÖNEMLİ YÖNLERİ
-
Bir tür için yüksek derecede polimorfizim olmasına rağmen, bireysel
en fazla altı farklı Sınıf 1 MHC ürünü ve biraz daha fazla olarak
Sınıf 2 MHC ürünleri bulunur (sadece büyük lokusların dikkate
alındığında).
-
Her bir MHC molekülünün sadece bir bağlanma bölgesi vardır. MHC
molekülündeki farklı peptidler aynı bölgeleri bağlar fakat bir
defada sadece bir tek bölgeye bağlanır.
-
Çünkü her bir MHC molekülü birçok farklı peptidi bağlayabilir.
-
MHC polimorfizmi sadece germçizgisinde kararlaştırılır.Çeşitliliği
üretmek için rekombinasyonel mekanizmalar vardır.
-
MHC molekülleri membrana bağlıdır; T hücre tarafından tanınma hücre
hücre teması gerektirir.
-
MHC genleri için alleller eş-baskındır. Her MHC gen ürünü her bir
çekirdekli hücrenin yüzeyinde ifade edilmektedir.
-
Bir peptid, belirli bir MHC ile ilişkilendirmelidir aksi taktirde
hiçbir immün yanıt oluşmaz. Bu kontrolün bir aşamasıdır.
-
Olgun T hücreler MHC ile birlikte peptidleri tanıyan T hücre
reseptörlerine sahip olmalıdır. Bu kontörlün ikinci aşamasıdır.
-
Sitokinler (özellikle interferon- γ) MHC ekspresyon seviyesini
arttırır.
-
Sınıf I MHC ile birlikte olan sitozoldeki peptidler Tc hücreleri
tarafından tanınır. Veziküllerin içerisindeki Sınıf II MHC ile
ilişkili olan peptidler Th hücreler tarafından tanınır.
-
MHC deki polimorfizm türlerin devamlılığı için önemlidir.
|
Tablo 2. Sınıf 2 MHC genlerinin
polimorfizmi |
|
Gen bölgesi (lokus) |
Allellerin sayısı
(allotipler) |
HLA-DPA
HLA-DPB |
12
88 |
HLA-DQA
HLA-DQB |
17
42 |
HLA-DRA
HLA-DRB1
HLA-DRB3
HLA-DRB4
HLA-DRB5 |
2
269
30
7
12 |
| HLA-DM ve HLA-DO |
Nispeten az sayıda allel |
|
| |
PEPTİDLER MHC OLUKLARINA NASIL
GİRMEKTEDİR? Hücre zarı ile ilişkili olan Sınıf I MHC
peptidleri CTL hücreleri tarafından tanınırlar. Peptidler endoplazmik
retikuluma girer ve MHC Sınıf I oluğuna bağlanır. Bu kompleks golgi
aracılığı ile hücre yüzeyine taşınır. MHC Sınıf II molekülleri ER ve
golgide yer tutucu olarak değişmeyen zincir (li) formlarını alırlar.
Vezikülde değişmeyen zincir (li) ayrılır ve kompleksten çıkarılır.
Vezikülde Sınıf II MHC ile ilişkili peptidler hücre yüzeyine taşınarak
yardımcı T hücreler tarafından tanınır.
T HÜCRE RESEPTÖR (TCR)NİN İMMÜN
YANITTAKİ ROLÜ T hücreleri yüzeyinde bulunan TCR yüzey
molekülü, uygun MHC ile sunulan antijeni tanır. TCR yapısal olarak
immünoglobülin ile benzerdir ve immünoglobülin süper ailesinin bir
parçasıdır. İki çeşit TCR mevcuttur, baskın form olan αβ lenfoid
dokularda bulunur ve γδ formu mukozal yüzeylerde bulunur.
|
 Şekil 8
Şekil 8
T hücre reseptör heterodimeri, iki transmembran
glikoproteini olan alfa ve beta zincirlerinden oluşur. Her bir zincirin
dış kısmında iki domain bulunmaktadır ve bunlar immünglobülinlerin
değişken ve sabit bölgelerini andırmaktadır. Her bir domainde şeker
zincirleri bulunmaktadır. İmmünglobülinlerin menteşe bölgelerine benzer
şekilde kısa bir dizi bulunmaktadır. Bunlar disülgit köprüsünü oluşturan
sistein içermektedir. Pozitif yüklü amino aistler (bazik amino asitler)
içerdiği için hidrofobik transmembran helikal yapılar alışılmadık
özeliktedir. Alfa zincir iki pozitif yüklü rezidü barındırırken beta
zincirde birtane bulunmaktadır.
 A6-T hücre reseptör bağlı MHC sınıf I molekülü değişmiş
HTLV-1 tax peptidi kompleksinin yapısı. HIV peptidi gri renkli
gösterilmiştir. MHC sınıf I molekülü koyu mavi, ilişkili beta 2
mikroglobülin açık mavi renklidir. T hücre reseptörüyeşil ve sarı renkli.
Y. H.Ding, B. M.Baker, D. N.Garboczi, W. E.Biddison & D. C.Wiley MMDB
Id: 11766 PDB Id: 1QSF Image prepared using RasMol
A6-T hücre reseptör bağlı MHC sınıf I molekülü değişmiş
HTLV-1 tax peptidi kompleksinin yapısı. HIV peptidi gri renkli
gösterilmiştir. MHC sınıf I molekülü koyu mavi, ilişkili beta 2
mikroglobülin açık mavi renklidir. T hücre reseptörüyeşil ve sarı renkli.
Y. H.Ding, B. M.Baker, D. N.Garboczi, W. E.Biddison & D. C.Wiley MMDB
Id: 11766 PDB Id: 1QSF Image prepared using RasMol
 Şekil 9
Şekil 9
TCR beta zincir genlerinin yeniden düzenlenmesi
|
T HÜCRE
RESEPTÖR (TCR) YAPISI
TCR heterodimer yapıda yaklaşık olarak eşit uzunlukta bir α ve bir β
zincir yapısından oluşur (Şekil 8). Her zincir kısa sitoplazmik kuyruğa
sahiptir fakat aktivasyon sinyallerini hücreye iletemeyecek kadar
kısadır. Her iki zincirde transmembran bölgelerden oluşan hidrofobik
aminoasidler hücre membranına gömülüdür. Her iki zincirde immünglobülin
zincirlerine benzer şekilde sabit ve değişken bölgelere sahiptir. Her
zincirin değişken bölgesi antijene özgüllüğü belirleyen aşırı değişken
bölgeler içermektedir. Her T hücresi sadece bir özgül TCR taşır (burada
bir allelik dışlama bulunmaktadır).
RESEPTÖR OLUŞUMUNDA GENETİK TEMEL
B hücreleri üzerindeki geniş bir sergileme gösteren antijen
reseptörlerinin genetik temeli bir önceki bölümde antıldı (bakınız: Ig
genetiği). TCRnin geniş yelpazesi de benzer bir mekanizma ile
gerçekleşmektedir. TCR β genleri için germline genler V,D ve J gen
segmentlerinden oluşurlar ve bunlar T hücre gelişimi boyunca yeniden
düzenlenerek çok farklı TCR β zincirleri oluştururlar (Şekil 9). TCR α
genleri için germline genler V ve J gen segmentlerinden oluşurlar ve
bunlar α zincir oluşturmak için yeniden düzenlenirler. TCRnin özgüllüğü
α ve β zincirlerin kombinasyonu ile belirlenmektedir.
Çok küçük bir T hücre popülasyonu α ve β zincir yerine γ ve δ
zincirlerini ifade etmektedir. Bu gama/delta T hücreleri mukozal
epitelde baskındırlar ve belirli bakteri ve viral antijenlere eğilimli
bir repartuvarları bulunmaktadır. δ zincirleri için V,D ve J gen
segmentleri bulunurken γ zincirleri için sadece V ve J gen segmenti
bulunmaktadır fakat repartuvarları alfa/beta hücrelerden oldukça
küçüktür. gama/delta T hücreleri, alfa/beta hücrelerden farklı olarak
antijeni MHCden bağımsız olarak tanır.
TCRNİN ÖNEMLİ YÖNLERİ
-
Her bir T hücresi yalnızca tek özgüllükte TCR taşır (burada bir
allelik dışlama bulunmaktadır).
-
αβ TCR, antijenleri sadece hücre-hücre etkileşiminde ve doğru MHC
içerisinde tanır.
-
The γδ TCR recognizes antigen in an MHC-independent manner in response
to certain viral and bacterial antigen.
-
γδ TCR, antijenleri MHC'den bağımsız bir şekilde belirli viral ve
bakteriyel antijenleri tanımaktadır.
|
TABLO 3. İMMÜNGLOBÜLİN VE T-HÜCRE
RESEPTÖR (TCR) GEN VE PROTEİNLERİNİN ANA ÖZELLİKLERİNİN
KARŞILAŞTIRILMASI |
|
GENLER |
|
Özellikler |
Ig |
TCR |
|
Çoğu VDJler, az Cler |
Evet |
Evet |
|
VDJ yeniden düzenlenmesi |
Evet |
Evet |
|
V çiftleri- antijen tanıma b |
Evet |
Evet |
|
Somatik hipermutasyon |
Evet |
Hayir |
|
PROTEİNLER |
|
Transmembran şekli |
Evet |
Evet |
|
Salgılanan şekli |
Evet |
Hayir |
|
Farklı işlevleri olan izotipler |
Evet |
Hayir |
|
Valans |
2 |
1 |
|
Janeway and Travers,
Immunobiologyden uyarlanmıştır. |
|
 İnsan T hücre reseptör kompleksinin influenza Ha antijen peptidi ve MHC
Sınıf 2 molekül kristal yapısı. MHC Sınıf 2 molekülüne ait alfa ve beta
zincirleri koyu ve açık mavi görülmektedir. T hücre reseptörleri sarı ve
yeşil renkte görülmektedir. İnfluenza peptidi gri görülmektedir.
Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB Id: 1FYT. Image
prepared using RasMol.
İnsan T hücre reseptör kompleksinin influenza Ha antijen peptidi ve MHC
Sınıf 2 molekül kristal yapısı. MHC Sınıf 2 molekülüne ait alfa ve beta
zincirleri koyu ve açık mavi görülmektedir. T hücre reseptörleri sarı ve
yeşil renkte görülmektedir. İnfluenza peptidi gri görülmektedir.
Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB Id: 1FYT. Image
prepared using RasMol.
|
|
 Şekil 10
Şekil 10
T hücre yüzeyindeki antijen reseptörleri 8 protein
içermektedir.
(a) iki disülfid bağlı zinciri olan T hücre reseptörleri heterodimer
yapıdadır. Bunlar MHC ile eşlenik peptidleri tanırlar.
(b) Dört zincir, toplu CD3 olarak adlandırılan T hücre reseptör dimeri
ile ilişkili ve hücre yüzeyine taşınmasında rol alan yapı. zeta
zincirleri ile birlikte CD3 kompleksi, homodimer bir yapı oluşturur ve
antijen bağlanmasından sonra sinyal iletiminde yer alır.
|
TCR VE CD3
KOMPLEKSİ
TCR, CD3 kompleksi olarak adlandırılan 5 protein
grubu ile yakın ilişkilidir (Şekil 10). CD3 kompleksi bir γ, bir δ, iki
ε ve 2 ξ zincirlerinden oluşur. CD3 kompleksindeki bütün proteinler
değişmez yapıdadır ve herhangi bir şekilde özgüllüğüne katkıda
bulunmayan yapılardır. CD3 kompleksi T hücresi gelişimi sırasında
TCRnin hücre yüzeyinde ifadesi için gereklidir. Ek olarak, CD3
kompleksi, TCR-antijen etkileşimini sonrası hücreye aktivasyon
sinyallerinin iletilmesini sağlar.
|
 Şekil 11
Şekil 11
A. T hücreleri ve antijen sunan hücreler ile
etkileşiminde yer alan moleküller. Her hücre tipi tarafından ürertilen
bazı sitokinler gösterilmektedir.
 B.
B.
Sitotoksik T hücrelerinin etkileşiminde yer alan
ligandlar ve bunların hedef hücreleri.
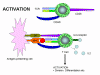 Şekil 12a
Şekil 12a
T hücrelerinin aktivasyonu sadece TCR ve ortak uyarıcı moleküllerin her
ikisi de kendilerine ait aynı ligandları ile angaje olduğunda oluşur.
 Şekil 12b
Şekil 12b
CTLA - 4 B7 ile etkileşirse down regülasyon oluşur:
CTLA-4 engelleyici bir sinyal gönderir
 Şekil 12c
Şekil 12c
Yardımcı uyarım yokluğunda TCR ve antijen / MHC
birlikteliği anerjiye yol açabilir
 Şekil 12d
Şekil 12d
TCR yokluğunda yardımcı uyarıcı angajmanı bir cevaba yol
açmaz.
|
İMMUNOLOJİK SİNAPS
TCR ve MHC molekülleri arasındaki etkileşim çok güçlü değildir.
Etkileşmeyi stabil tutmaya yardım etmek için aksesuar moleküller gereklidir (Şekil
11a,b). Bu moleküller:
-
CD4ün Sınıf II MHCye bağlanması, Th hücrelerinin sadece
ASHler ile etkileşmesini sağlar
-
CD8in Sınıf I MHCye bağlanması, Tc hücrelerinin hedef
hücrelerle etkileşebilmesini sağlar
-
LFA-3e bağlanan CD2
-
ICAM-1e bağlanan LFA-1
Aksesori moleküller değişmez ve TCRla belirlenen etkileşimin özgüllüğüne
katkıları yoktur. Aksesori moleküllerin ekspresyonu sitokine yanıt olarak
arttırılabilir bu sitokinlerin bağışıklık yanıtları modüle edebildiği bir yoldur.
MHC molekülleriyle birlikte TCR ve antigen arasındaki etkileşmi dengelemeye
yardım eden aksesuar moleküllerine ek olarak, T hücre aktivasyonu için diğer
moleküller de gereklidir. T hücre aktivasyonu için iki sinyal gereklidir- bir
tanesi TCR ve Antijen/MHC birleşmesi ve diğer sinyal yardımcı uyarıcı
moleküllerin ligandlarıyla birleşmesinden gelir. En önemli (ancak tek değil)
yardımcı uyarıcı moleküllerden biri T hücreleri üzerindeki CD28dir ve bu
ASHler üzerindeki B7-1 (CD80) veya B7-2 (CD81) ile etkileşmek zorundadır.
Aksesori moleküller gibi yardımcı uyarıcı moleküller de değişmez ve etkileşmenin
özgüllüğüne katkıları yoktur. TCRın Antijen/MHC ile ve aksesuar moleküller ve
yardımcı uyaran moleküllerin ligandaları ile çoklu etkileşimleri immünolojik
sinaps olarak adlandırılır.
Yardımcı uyarım sadece T hücre aktivasyonu için değildir,
yardımcı uyarıcı eksikliği anerjiyle (antijene karşı tepkide yetersizlik) ya da
tepkinin down regülasyonu ile sonuçlanabilir. Figür 12, aktivasyon için gerekli
olan bir veya her iki sinyali alan bir T hücresinin olası sonuçlarını gösterir.
TCRın Ag/MHC ile birleşimi var fakat yardımcı uyarıcı yoksa anerji gelişir.
Sadece yardımcı uyarıcı molekülün etkisi yoktur. TCRın Ag/MHC ile ve yardımcı
uyarıcı moleküllerin kendi ligandlarıyla birleşimi aktivasyonla sonuçlanır.
TCRın Ag/MHC ile birleşimi ve B7 ligandın CD28e benzeyen moleküller olan
CTLA-4 ile birleşimi tepkinin down regülasyonuyla sonuçlanır. CTLA-4/B7
etkileşimi aktivasyon sinyali yerine T hücresine inhibasyon sinyali gönderir. Bu
immun yanıtın regülasyon yollarından biridir. CTLA-4 sonradan bir immun yanıt
sırasında T hücreleri üzerinde ekspres edilir ve bu, yanıtı kapatmaya yardımcı
olur.
T HÜCRE AKTİVASYONUNDAKİ ANAHTAR
BASAMAKLAR
-
ASHnin peptidleri işlemesi ve T hücrelerine sunması
gereklidir
-
T hücrelerinin yardımcı uyarı sinyali (ko-stimülatör) alması
gereklidir- genellikle CD28/B72den.
-
Aksesori adhezyon molekülleri T hücreleri ve ASHlerin
bağlanmasını dengelemeye yardımcı olmalıdır. (CD4/Sınıf II MHC, CD8/Sınıf I
MHC, LFA-1/ICAM-1 ve CD2/LFA-3)
-
Hücre yüzeyindeki sinyallaer ikincil mesajcılar yoluyla
nükleusa iletilmelidir.
-
IL-2i de içeren sitokinler hücre bölünmesini sürdürmeye
yardımcı olmalıdır
|
TABLO 4. ÖNEMLİ AKSESUAR
MOLEKÜLLER |
|
T hücre molekülü
|
İkinci hücredeki ligandı |
|
Yardımcı T hücreleri üzerinde CD4 |
Sınıf II MHC molekülleri |
|
Sitotoksik T hücreleri üzerinde CD8 |
Sınıf I MHC molekülleri |
|
LFA-2 (CD2) |
LFA-3 |
|
LFA-1 |
ICAM-1, ICAM-2 |
|
LFA = Leukocyte Function-associated Antigen,
Lökosit fonksiyonu ile ilişkili antijnen |
|
ICAM = Intercellular Adhesion Molecule,
İntersellüler Adezyon Molekülü |
|
|

 |
 Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
This page last changed on
Tuesday, March 29, 2016
Page maintained by
Richard Hunt
|

 Şekil 1
Şekil 1 Şekil 3
Şekil 3 Şekil 4
Şekil 4 Şekil 6 MHC Sınıf II molekülleri bir birinin eşi olmayan iki peptitden
oluşmuştur (alfa ve beta) ve bunlar birbirine non-kovalent olarak
bağlanmıştır ve plazma membranını hücre dışında N terminal uç ile arşlar.
Her bir zincirdeki membrana en yakın bölgeler yapısal olarak
immünoglobülinlerle ilişkilidir. Alfa 1 bölgesi dışında tüm domainler
disülfit bağları (kırmızı) ile stabilleştirilmiştir. Alfa ve beta
zincirin her ikiside glikolizedir. Beta zincir alfa zincirden daha
kısadır (beta mol. Ağırlığı 28.000) ve alloantijenik ksımlar içerirler.
MHC II molekülünün alfa zincirinde bazı polimorfizmler bulunmaktadır.
Şekil 6 MHC Sınıf II molekülleri bir birinin eşi olmayan iki peptitden
oluşmuştur (alfa ve beta) ve bunlar birbirine non-kovalent olarak
bağlanmıştır ve plazma membranını hücre dışında N terminal uç ile arşlar.
Her bir zincirdeki membrana en yakın bölgeler yapısal olarak
immünoglobülinlerle ilişkilidir. Alfa 1 bölgesi dışında tüm domainler
disülfit bağları (kırmızı) ile stabilleştirilmiştir. Alfa ve beta
zincirin her ikiside glikolizedir. Beta zincir alfa zincirden daha
kısadır (beta mol. Ağırlığı 28.000) ve alloantijenik ksımlar içerirler.
MHC II molekülünün alfa zincirinde bazı polimorfizmler bulunmaktadır. Şekil 7
Şekil 7 Şekil 8
Şekil 8 İnsan T hücre reseptör kompleksinin influenza Ha antijen peptidi ve MHC
Sınıf 2 molekül kristal yapısı. MHC Sınıf 2 molekülüne ait alfa ve beta
zincirleri koyu ve açık mavi görülmektedir. T hücre reseptörleri sarı ve
yeşil renkte görülmektedir. İnfluenza peptidi gri görülmektedir.
Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB Id: 1FYT. Image
prepared using RasMol.
İnsan T hücre reseptör kompleksinin influenza Ha antijen peptidi ve MHC
Sınıf 2 molekül kristal yapısı. MHC Sınıf 2 molekülüne ait alfa ve beta
zincirleri koyu ve açık mavi görülmektedir. T hücre reseptörleri sarı ve
yeşil renkte görülmektedir. İnfluenza peptidi gri görülmektedir.
Hennecke, J., Carfi, A., Wiley, D. C. MMDB Id: 14648 PDB Id: 1FYT. Image
prepared using RasMol. Şekil 10
Şekil 10  Şekil 11
Şekil 11








