|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
|
İMMUNOLOJİ BÖLÜM DOKUZ
İMMUN YANIT VE ANTİJEN TANIMADA YER ALAN HÜCRELER
Gene Mayer, Ph.D
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Jennifer Nyland, Ph.D
Assistant Professor of Pathology, Microbiology and Immunology
University of South Carolina
Çeviri:
Doç. Dr. Erkan Yula
İzmir, Katip Çelebi Üniversitesi, Tıp Fakültesi, Tıbbi Mikrobiyoloji
Anabilim Dalı
|
|
TURKISH |
|
FRANCAIS |
|
PORTUGUES |
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
|
|
ÖĞRETİM HEDEFLERİ
Özgül bağışıklık için gerekli olan moleküller ve hücre etkileşimleri
türlerine genel bir bakış sağlamak
Özgül bağışıklık ve ilgili hücreleri tanımlamak
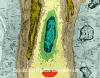 Kılcal damardaki beyaz kan hücresi (lenfosit) ( TEM x16,210)
Kılcal damardaki beyaz kan hücresi (lenfosit) ( TEM x16,210)
© Dennis Kunkel Microscopy, Inc. İzniyle kullanılmıştır |
GENEL BAKIŞ
Bağışıklık sistemi konağı patojenler ve diğer yabancı maddelerden korumak için
gelişmiştir. Kendini yabancıdan ayırt etmesi bağışıklık sisteminin en ayırıcı
özelliklerinden biridir. Patojenlerin bulunabileceği iki ana bölge vardır: hücre
dışı olarak doku aralıkları ya da konak hücre içi bölgesi; bağışıklık sistemi
patojenlerle bu bölgelerde farklı yollarla baş eder. İmmun yanıt patojenlere ve
patojenlerin bulunduğu yere göre adapte olsa da patojenlerin birçoğu, konağı
patojenden kurtarmaya katkısı olabilecek olan hem antikor ve hem hücre aracılı
tepkiye yol açabilirler. Bununla birlikte, patojene karşı savunmada herhangi bir
patojen için antikor aracılı ya da hücre aracılı yanıt daha etkili olabilir.
Hücre dışı patojenler
Hücre dışı patojenlere karşı birincil savunmayı yapan antikorlardır ve üç
temel yolla çalışırlar:
- Nötralizasyon (Şekil 1a)
Antikorlar patojenlere ve ya yabancı maddelere bağlanarak, patojenlerin
hedefleriyle birleşmesini engelleyebilirler. Örneğin, bakteriyel
toksinlere karşı antikorlar toksinlerin konakçı hücreye bağlanmasını
önlerler ve böylece toksinleri etkisiz hale getirirler. Benzer şekilde,
antikorun virüse ya da bakteriyel patojene bağlanması patojenin kendi
hedef hücresine bağlanmasını engeller ve böylece enfeksiyonu veya
kolonizasyonu önlerler.
- Opsonizasyon (Şekil 1b)
Antikorun patojene ya da yabancı maddeye bağlanması materyali opsonize
edebilir ve fagositik hücrelerle içeri alınımını ve yok edilmesi
kolaylaştırır. Fagositik hücrelerin Fc reseptörleriyle etkileşen
antikorun Fc kısmı patojenin daha kolayca fagosite olmasını sağlar.
- Kompleman aktivasyonu (Şekil 1c)
Kompleman kaskadının antikorla aktivasyonu bazı bakteri ve virüslerin
lizis edilmesine neden olabilir. Ayrıca, kompleman kaskadının bazı
bileşenleri (örneğin C3b) patojenleri opsonize eder ve fagositik
hücrelerin üstündeki kompleman reseptörleri yoluyla hücre içine
alınımını kolaylaştırır.
|
|
Şekil 1
|
A
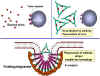
 Bakteriyel toksine bağlanan ve nötralize eden antikorlar, bunların
konakçı hücrelerle etkileşimini ve patolojiye neden olmasını engeller.
Bağlanmamış toksinler konak hücre üzerindeki reseptörlerle reaksiyona
girebildiği halde toksin:antikor kompleksi giremez. Antikorlar ayrıca
tüm virüs parçacıklarını ve bakteri hücrelerini onlara bağlanarak ve
etkisiz hale getirerek nötralize ederler. Antijen: antikor compleksi
makrofajlar tarafından sonunda uzaklaştırılır ve ayrıştırılır. Antijeni
kaplayan antikorlar, antijenin fagositler (makrofajlar ve
polimorfonükleer lökositler) tarafından yabancı madde olarak tanınabilir
kılar ve fagositler tarafından sindirilir ve imha edilir; bu olay
opsonizasyon olarak adlandırılır.
Bakteriyel toksine bağlanan ve nötralize eden antikorlar, bunların
konakçı hücrelerle etkileşimini ve patolojiye neden olmasını engeller.
Bağlanmamış toksinler konak hücre üzerindeki reseptörlerle reaksiyona
girebildiği halde toksin:antikor kompleksi giremez. Antikorlar ayrıca
tüm virüs parçacıklarını ve bakteri hücrelerini onlara bağlanarak ve
etkisiz hale getirerek nötralize ederler. Antijen: antikor compleksi
makrofajlar tarafından sonunda uzaklaştırılır ve ayrıştırılır. Antijeni
kaplayan antikorlar, antijenin fagositler (makrofajlar ve
polimorfonükleer lökositler) tarafından yabancı madde olarak tanınabilir
kılar ve fagositler tarafından sindirilir ve imha edilir; bu olay
opsonizasyon olarak adlandırılır.
B
 Bakteri hücresinin opsonizasyonu ve fagositozu
Bakteri hücresinin opsonizasyonu ve fagositozu
C
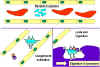 Kompleman sistemin bakteri hücresini saran
antikorlar tarafından etkinleştirilmesi. Bağlı antikorlar, sonunda
bakteri üzerinde protein kompleksi oluşturan kompleman sistemin ilk
proteini için bir reseptör oluştururlar. Bu, bazı durumlarda bakteriyi
direk öldürebilir fakat genel olarak fagositozla alınması ve yıkım yolu
tercih edilir. Bu yüzden, antikorlar fagositozla yok etmek için
patojenleri ve onların ürünlerini hedef alırlar.
Kompleman sistemin bakteri hücresini saran
antikorlar tarafından etkinleştirilmesi. Bağlı antikorlar, sonunda
bakteri üzerinde protein kompleksi oluşturan kompleman sistemin ilk
proteini için bir reseptör oluştururlar. Bu, bazı durumlarda bakteriyi
direk öldürebilir fakat genel olarak fagositozla alınması ve yıkım yolu
tercih edilir. Bu yüzden, antikorlar fagositozla yok etmek için
patojenleri ve onların ürünlerini hedef alırlar.
|
 Şekil 2
Şekil 2
Konağın virüsler tarafından hücre içi enfeksiyonuna karşı
savunma mekanizması. Virüsler tarafından enfekte olmuş hücreler,
sitotoksik T lenfositler (CTL) olarak adlandırılan özelleşmiş T
lenfositler tarafından tanınırlar ve CTL tarafından direkt öldürürler.
Öldürme mekanizması enfekte olmuş hücredeki nükleazların
aktifleştirilmesini ve bu nükleazların konak hücreyi ve viral DNAyı
ayırmasını kapsar. |
Hücre içi patojenler
Antikorlar konak hücrelerin içine giremedikleri için, hücre içi
patojenlere karşı etkisizlerdir. İmmun sistemi bu tür patojenlerle baş etmek
için farklı bir yaklaşım kullanır. Hücre içi patojenlere karşı birincil
savunma hücre aracılı immün yanıtlardır ve patojenin konak hücerede
bulunduğu yere göre (örneğin, sitoplazmada ya da vesiküllerin içinde)
yaklaşım farklılık gösterir. Örneğin, virüslerin birçoğu ve bazı bakteriler
konak hücrenin sitoplazmasında bulunurlar fakat bazı bakteriler ve
parazitler asıl enfekte konak hücrenin endozomlarının içinde yaşarlar.
Sitoplazmadaki patojenlere karşı birincil savunmayı sitotoksik T lenfosit (Tc
ya da CTL) oluşturur. Bunun tersine, vesiküllerin içindeki patojenlere karşı
birincil savunmayı yardımcı T lenfositlerin bir alt grubu oluşturur.
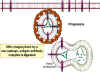
- Sitotoksik T lenfositler (Şekil 2)
Sitotoksik T lenfositler (CTLs), yüzeylerinde CD8 adında kendine özgü
yüzey antijeleri ekspres eden T lenfositlerin bir alt tipidir. Bu
hücreler patojenleri, enfekte ettikleri hücrelerin yüzeyinde bulunan
antijenlerden tanırlar ve hücreyi öldürürler. Böylece, enfeksiyonun
komşu hücrelere yayılmasını engellerler. CTLs enfekte hücrelerin
apoptozisini başlatarak öldürürler.
|
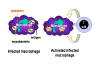 Şekil 3
Şekil 3
Konağın mycobakteri tarafından hücre içi enfeksiyonuna
karşı savunma mekanizması. Mycobakterilerin enfekte ettiği makrofajların
içinde yaşadığı sitoplazmik vesiküller, lizosomlarla füzyona ve
bakterilerin makrofaj bakterisidal aktivite ile yıkımına direnç
gösterirler. Bununla birlikte, uygun T hücreleri enfekte olan makrofajı
tanıdığında, lizosomal birleşmeyi başlatan ve makrofaj bakterisidal
aktiviteyi aktifleştiren makrofaj-aktive edici moleküller salgılarlar.
|
- Th1 Yardımcı T hücreleri (Şekil 3)
Th hücreleri, yüzeylerinde CD4 adında kendine özgü yüzey antijeleri
ekspres eden T lenfositlerin bir alt tipidir. Th hücrelerinin bir alt
tipi olan Th1 hücreleri, vesiküller içinde yaşayan hücre içi patojenlere
karşı birincil savunmayı oluştururlar. Th1 hücreleri patojenleri,
enfekte ettikleri hücrelerin yüzeyinde ekspres edilen antijenlerden
tanırlar ve enfekte hücreyi aktifleştirecek sitokinler salgılarlar. Bir
defa aktif hale geldikten sonra enfekte hücre patojeni öldürebilir.
Örneğin, tüberküloz hastalığına neden olan Mycobacterium tuberculosis
bakterisi makrofajları enfekte eder fakat öldürülmez. Çünkü bu bakteri,
içinde bulunduğu endozomların lizosomlarla birleşmesini bloke eder. Th1
hücreleri, enfekte olmuş makrofajın yüzeyinde bulunan M. tuberculosis
antijenlerini tanıyabilir ve makrofajları aktive eden sitokinler
salgılayabilirler. Bir kez aktive olduklarında, lizosomlar endozomlarla
bileşirler ve M. tuberculosis bakterisi öldürülür.
İmmun yanıt patojenlere ve patojenlerin nerede bulunduğuna göre
adapte olmuş olsa da patojenlerin birçoğu, konağı patojenden kurtarmaya
katkısı olabilecek olan antikor ve hücre aracılı her iki tepkiye de yol
açabilirler. Bununla birlikte, herhangi bir patojen için antikor aracılı
ya da hücre aracılı yanıt patojene karşı savunma için daha etkili
olabilir.
|
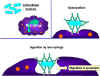
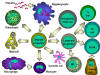 Şekil 4
Şekil 4
Hematopoetik hücrelerin hepsi pluripotent kök hücrelerden
türerler ve başlıca iki soya ayrılırlar: bir tanesi lenfoid hücreler
diğeri miyeloid hücreler. Ortak lenfoid progenitörün bulunduğu ana
konumun mikroçevresine bağlı olarak T ya da B hücrelerinden birine
diferansiye olma kapasitesi vardır. Memelilerde, T hücreleri timusda
gelişirken B hücreleri fetal karaciğerde ve kemik iliğnde gelişirler.
AFC bir antikor yapıcı hücredir, plazma hücresi en farklıllaşmış AFCdir.
NK hücreleri ayrıca ortak lenfoid progenitürlerden de türerler. Sol
tarafta miyeloid hücreler committed hücrelere diferansiye olurlar.
Eosonofiller, nötrofiller ve bazofiller için toplu olarak granülosit
adı kullanılır.
|
BAĞIŞIKLIK SİSTEMİ HÜCRELERİ
İmmun sistemin tüm hücreleri kemik iliğindeki hematopoetik kök hücreden
oluşurlar ve miyeloid progenitör hücre ve lenfoid progenitör hücre olmak üzere
başlıca iki soya ayrılırlar (Şekil 4). Bu iki progenitörler sırasıyla miyeloid
hücreler (monositler, makrofajlar, dendiritik hücreler, megakaryositler ve
granülositler) ve lenfoid hücreleri (T hücreler, B hücreler ve doğal öldürücü (NK)
hücreler) meydana getirirler. Bu hücreler doğuştan gelen bağışıklık sistemi (doğal
bağışıklık) ve edinilmiş bağışıklık sisteminin (edinilmiş bağışıklık) hücresel
bileşenlerini oluştururlar.
Doğal bağışıklık sistemi hücreleri
Doğal bağışıklık sistemi fagositik hücreler (monosit/makrofajlar ve PMN
polimorfonükleer lökositler), NK hücreler, bazofiller, mast hücreleri,
eozinofiller ve trombositleri içerir. Bu hücrelerin rolleri daha önce
anlatılldı (bakınız doğal bağışıklık). Bu hücrelerin reseptörleri kalıp
tanıma reseptörleridir (PRRs) ve patojenlerde bulunan geniş moleküler
kalıpları (patojen ilişkili moleküler kalıplar, PAMPS) tanırlar.
Doğal ve kazanılmış bağışıklık
sistemiyle bağlantı sağlayan hücreler Özelleşmiş bir alt tip
olan antijen sunan hücreleri (ASH) lökositlerin heterojen bir populasyonudur.
Doğal bağışıklıkta önemli rol oynar ve aynı zamanda yardımcı T hücrelerinin
(Th hücreleri) aktive olmasına katılarak edinilmiş bağışıklık sistemi için
bağlantı görevi görür. Bu hücreler dendritik hücreler ve makrofajlardan
oluşur. Antijen sunumu hücrelerinin karakteristik özelliği, hücre yüzey
molekülü sentezinin sınıf II MHC molekülleri olarak bilinen majör
histokompatibilite kompleksindeki genler tarafından kodlanmasıdır. B
lenfositleri doğal bağışıklık sisteminin parçası olarak görülmese de, sınıf
II MHC moleküllerini de sentezlerler ve ASH işlevi görürler. Ayrıca, diğer
bazı hücreler (örneğin, timic epitel hücreler) sınıf II MHC molekülleri
sentezleyebilirler ve ASH olarak işlev görebilirler.
Edinilmiş bağışıklık sistemi hücreleri
Edinilmiş (özgül) bağışıklık sistemini oluşturan hücreler B ve T
lenfositleri içerir. Antijene maruz kaldıktan sonra, B hücreleri birincil
fonksiyonu antikor üretmek olan plazma hücrelerine diferansiye olurlar.
Benzer şekilde T hücreleri, T sitotoksik (Tc) ya da T yardımcı (Th)
hücrelerinden herhangi birine diferansiye olabilirler. Yardımcı T hücrelerin
Th1 ve Th2 olmak üzere iki çeşidi bulunmaktadır.
B hücreleri, T hücreleri ve bunların alt populasyonlarını birbirinden
ayırmak için laboratuvarlarda kullanılan birçok hücre yüzey belirteçleri
vardır. Bunlar Tablo 1de özetlenmiştir.
|
| |
|
Tablo 1. T ve B
hücrelerini ayıran başlıca belirteçler |
| Belirteç |
B hücreleri |
Tc |
Th |
| CD3 |
- |
+ |
+ |
| CD4 |
- |
- |
+ |
| CD8 |
- |
+ |
- |
| CD19
ve/veya CD20 |
+ |
- |
- |
| CD40 |
+ |
- |
- |
| Antijen reseptörü |
BCR (yüzey Ig) |
TCR |
TCR |
|
 Şekil 5
Şekil 5
B hücrelerinin antijen receptörleri iki, T hücrelerininki
ise sadece bir antijen tanıma bölgesine sahiptir.
|
EDİNİLMİŞ BAĞIŞIKLIK SİSTEMİNİN
ÖZGÜLLÜĞÜ Edinilmiş bağışıklık sisteminin özgüllüğü T ve B
hücresi üzerinde bulunan antijen reseptörlerine, sırasıyla TCR ve BCRa bağlıdır.
TCR ve BCR benzer şekilde reseptörün her biri bir antijen determinantına özgüdür
fakat BCR divalan iken TCR monovalandır (Şekil 5). Bu farklılığın bir soncu
olarak B hücreleri antijen reseptörleri antijen tarafından çapraz bağlanabildiği
halde, TCR bağlanamaz.
|
| |
B ve T hücrelerinin her biri özel bir antijen determinantına özgü reseptöre
sahiptir ve B ve T hücrelerin her ikisinin üzerindeki antijen reseptörleri
farklı büyüklükte diziye sahiptir. Bu reseptörlerin nasıl oluştuğu sorusu
immunolojistlerin yıllardır başlıca odağıydı. Reseptörlerin oluşumunu açıklamak
için iki temel hipotez önerildi: öğretici (şablon) hipotez ve klonal seleksiyon
hipotezi.
Öğretici hipotez
Öğretici hipoteze göre germlineda kodlanan sadece bir tane ortak
reseptör vardır ve farklı reseptörler antijeni şablon olarak kullanarak
oluşmuşlardır. Her bir antijen kendisine uyması olması için tek ortak
reseptörün katlanmış olmasına neden olacaktır. Bu hipotez basit ve ilgi
çekici olmasına rağmen protein katlanması (örneğin, protein katlanması,
proteindeki aminoasitlerinin sekansı tarafından dikte edilir) hakkında
bilinenlerle tutarlı değildir. Ayrıca bu hipotez bağışıklık sisteminin
kendini yabancıdan ayırt etme durumuna açıklık getirmemektedir. Ortak
reseptörlerin neden öz antijenler etrafında katlanmadığını açıklamamaktadır.
Klonal seleksiyon hipotezi
Klonal seleksiyon hipotezi germlinenın birçok farklı antijen
reseptörlerini kodladığını ifade eder- kişinin immun yanıt verebilmesini
sağlayacak herbir antijenik determinant için bir antijen reseptörü
kodlanmaktadır. Antijen, uygun reseptörü olan hücre klonlarını seçer. Klonal
seleksiyon hipotezinin dört temel prensibi:
- Her bir lenfosit bir özgüllükte tek çeşit reseptör taşıyabilir.
- Yabancı bir molekül ile bu moleküle yüksek afinite ile bağlanabilen
bir lenfosit reseptörü arasındaki etkileşim lenfosit aktivasyonunu
başlatır.
- Aktifleşmiş lenfositten türeyen diferansiye olmuş efektör hücreler,
türedikleri parental hücrenin reseptörleriyle aynı özgüllüğe sahip
reseptörleri taşıyabileceklerdir.
- Öz molekülleri için reseptör taşıyan lenfositler, lenfosit hücre
gelişiminin erken evresinde yok edilirlerr ve bu yüzden olgun
lenfositler arasında yokturlar.
Klonal seleksiyon hipotezi edinilmiş bağışıklık
sisteminin nasıl çalıştığını açıklamada günümüzde genel olarak doğru hipotez
olarak kabul edilmiştir. Bu hipotez immun yanıtın birçok özelliğini açıklar:
1) yanıtın özgüllüğü; 2) yanıtın aktivasyonu için gerekli olan sinyal
(örneğin, antijen); 3) edinilmiş bağışıklık yanıtındaki gecikmeyi-lag
periyodu (hücreleri aktive etmek ve hücre klonlarının genişlemesi için süre
gereklidir); 4) kendini yabancıdan ayırt etme.
|
 Şekil 6
Şekil 6
Sirküle lenfositler periferal lenf dokularında
antijenlerle karşılaşırlar
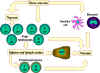 Şekil 7
Şekil 7
Kemik iliği gibi birincil lenfoid dokularından olan naif
lenfositler dalak, lenf nodları gibi ikincil lenfoid dokularına göç
ederler. Dendritik hücreler ve tek çekirdekli fagositlerin (monositler)
de yer aldığı antijen sunan hücreler (ASH) de kemik iliği kök
hücrelerinden türerler. Bu ASHler dokulara girerler, antijeni içine
alırlar ve T hücreleri ve B hücrelerine sunmak üzere lenfoid dokulara
taşırlar. İşlemden geçmiş lenfositler sonra lenfoid dokulardan
taşınırlar ve öncelikli olarak enfeksiyonun ve inflamasyonun olduğu
bölgede birikirler.
|
LENFOSİT
RESİRKÜLASYONU
Herhangi bir antijen reseptörü için az sayıda T ya da B
lenfositleri var olduğu için (1/10,000 - 1/100,000), antijen ve uygun
lenfositlerin başarılı bir şekilde karşılaşma şansları azdır. Buna rağmen,
başarılı karşılaşma ihtimali lenfositlerin ikincil lenfoid organları boyunca
tekrar dolaşımıyla fazlasıyla arttırılır. Kandaki lenfositler lenf nodlarına
girerler ve lenf nodlarının arasından süzülürler (Şekil 6). Eğer lenf
nodlarında bir antijenle karşılaşmazlarsa lenf damarlarından ayrılarak
torasik kanal yoluyla kana geri dönerler. Lenfositlerin saatte %1-2 sinin
tekrar dolaşıma katıldığı tahmin edilmektedir. Eğer lenf nodlarındaki
lenfositler, lenf damarları yoluyla lenf nodlarına taşınmış bir antijenle
karşılaşırlarsa, hücreler aktif hale gelir, bölünür ve plazma hücresi, Th ya
da Tc hücresi olmak üzere diferansiye olurlar. Birkaç gün sonra efektör
hücreler lenf nodlarından lenf damarları yoluyla ayrılırlar ve torasik kanal
yoluyla kana geri dönerler ve sonrasında enfekte olmuş doku bölgesinin
yolunu tutarlar.
Naif (virjin) lenfositler kandan lenf nodlarına yüksek
endoteliyal venüller (HEV) yoluyla girerler. Lenfositlerdeki hedefi
bulabilen reseptörler, hücreleri HEVe yönlendirirler. Lenf nodlarında
dendritik hücreler ve ya makrofajlar tarafında lenf nodlarına taşınan
antijen ile uygun antijen reseptörü taşıyan lenfositler karşılaşırlar.
Aktivasyondan sonra lenfositler hücrelerin lenf nodlarınından ayrılıp
dolaşıma tekrar girmesini sağlayan yeni reseptörler eksprese ederler.
Aktifleşmiş lenfositler üzerinde bulununan reseptörler, enfeksiyon
bölgesinin yakınındaki endotelyal hücrelerin üzerinde ekspres edilen hücre
adhezyon moleküllerini ve enfeksiyon bölgesinde üretilen ve aktive
hücrelerin çekimine yardımcı olan kemokinleri tanırlar (Şekil 7).
|
| |
BAĞIŞIKLIK: SPESİFİK VE
SPESİFİK OLMAYAN ARASINDAKİ FARKLILIKLAR
Spesifik olmayan (doğal, doğuştan,
doğuştan gelen)
- Antijene maruz kalma öncesinde sistem mevcuttur
- Antijenler arasında ayrım yoktur
- Antijene maruz kaldıktan sonra sitokinlerin etkisiyle artıtılabilir
Spesifik (kazanılmış, edinilmiş)
- Antijen tarafından tetiklenir
- Antijen tarafından geliştirilir
- İnce ayrım gösterir
Spesifik bağışıklık sisteminin en ayırt edici özelliği bellek ve
özgül (kendinden olmayanları tanıması) olmasıdır.
- Edinilmiş bağışıklık sistemi mikrop ya da yabancı maddeyle
her karşılaşmada hatırlar, bu yüzden sonraki karşılaşmalar
giderek daha etkili savunma mekanizmalarını tetikler.
- Spesifik immun yanıt özgül olmayan bağışıklığın koruyucu
mekanizmasını kuvvetlendirir, yönlendirir ya da bu mekanizmaları
antijen girişi yerine odaklar ve böylece yabancı antijenlerin
daha iyi ortadan kaldırılmasını sağlar.
|
| Şekil 8 |
BAĞIŞIKLIK
SİSTEMİ HÜCRELERİ
Bağışıklık sistemindeki hücre çeşitlerinin hepsi kemik
iliğinden köken alırlar.
|
 İnsan T-lenfositi (SEMx12,080)
İnsan T-lenfositi (SEMx12,080)
© Dennis Kunkel Microscopy, Inc. İzniyle kullanılmıştır |
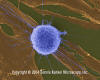 Fibroblast Tümor/Kanser Hücrelerine Saldıran İnsan T-lenfositi
(SEMx4,000)
Fibroblast Tümor/Kanser Hücrelerine Saldıran İnsan T-lenfositi
(SEMx4,000)
© Dennis Kunkel Microscopy, Inc. İzniyle kullanılmıştır
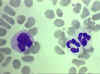 Bir monosit (sol) ve iki nötrofili gösteren periferik yayma
Bir monosit (sol) ve iki nötrofili gösteren periferik yayma
© Bristol Biomedical Image Archive İzniyle
kullanılmıştır
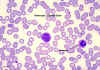 Monosit,
giemsa ile boyanmış periferal periferik yayma Monosit,
giemsa ile boyanmış periferal periferik yayma
© Dr Peter Darben, Queensland University of
Technology clinical parasitology collection İzniyle kullanılmıştır
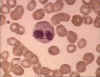
 Eozinofil, giemsa ile boyanmış periferal periferik yayma
Eozinofil, giemsa ile boyanmış periferal periferik yayma
© Dr Peter Darben, Queensland University of Technology
clinical parasitology collection İzniyle kullanılmıştır
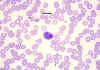
 Küçük lenfositleri gösteren periferik yayma
Küçük lenfositleri gösteren periferik yayma
© Bristol Biomedical Image Archive İzniyle kullanılmıştır
 Büyük Lenfosit, giemsa boyanmış periferal periferik yayma
Büyük Lenfosit, giemsa boyanmış periferal periferik yayma
© Dr Peter Darben,Queensland
University of Technology clinical parasitology collection İzniyle
kullanılmıştır
 Nötrofil- elektron mikrografi.
Çekirdeğe ait iki lobu ve azurofilik granüller işaret edilmiştir.
granules
Nötrofil- elektron mikrografi.
Çekirdeğe ait iki lobu ve azurofilik granüller işaret edilmiştir.
granules
© Dr Louise Odor, University of South Carolina School of
Medicine İzniyle kullanılmıştır
 Nötrofil, giemsa boyanmış perferal periferik yayma
Nötrofil, giemsa boyanmış perferal periferik yayma
© Dr Peter Darben, Queensland University of Technology
clinical parasitology collection İzniyle kullanılmıştır
 T lenfositler (pre-T hücreleri) ve granülosit (nötrofil)
T lenfositler (pre-T hücreleri) ve granülosit (nötrofil)
© Dennis Kunkel Microscopy, Inc. İzniyle kullanılmıştır |
 Periferik yaymada eozinofil
Periferik yaymada eozinofil
© Bristol Biomedical Image Archive İzniyle
kullanılmıştır |
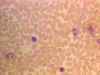
 Küçük lenfosit, giemsa ile boyanmış periferal kan
Küçük lenfosit, giemsa ile boyanmış periferal kan
© Dr Peter Darben, Queensland University of Technology
clinical parasitology collection İzniyle kullanılmıştır |
| |
Hemopoietik kök hücreden türeyen iki ana soy vardır:
T lenfositler (T hücreler)
B lenfositler (B hücreler)
Doğal katil hücreler (NK hücreler)
Monositler, makrofajlar
Langerhans hücreleri, dendritik hücreler
Megakaryositler
Granülositler (eozinofiller, nötrofiller, bazofiller)
|
|

 |
|
Klonal Seleksiyon
Klonal seleksiyon hipotezinin dört temel prensibi: |
|
Her bir lenfosit yegane özgüllüklü tek bir çeşit
reseptör taşıyabilir |
|
Yabancı bir molekül ile bu moleküle yüksek afinite
ile bağlanabilen bir lenfosit reseptörü arasındaki interaksiyon lenfosit
aktivasyonunu başlatır |
|
Aktifleşmiş lenfositten türeyen diferansiye olmuş
efektör hücreler, türedikleri parental hücrenin reseptörleriyle aynı
özgüllüğe sahip reseptörleri taşıyabileceklerdir |
|
Öz molekülleri için reseptör taşıyan lenfositler,
lenfosit hücre gelişiminin erken evresinde yok edilirler ve bu yüzden
olgun lenfositlerin arasında bulunmazlar |
 Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
This page last changed on
Sunday, March 27, 2016
Page maintained by
Richard Hunt
|


 Bakteriyel toksine bağlanan ve nötralize eden antikorlar, bunların
konakçı hücrelerle etkileşimini ve patolojiye neden olmasını engeller.
Bağlanmamış toksinler konak hücre üzerindeki reseptörlerle reaksiyona
girebildiği halde toksin:antikor kompleksi giremez. Antikorlar ayrıca
tüm virüs parçacıklarını ve bakteri hücrelerini onlara bağlanarak ve
etkisiz hale getirerek nötralize ederler. Antijen: antikor compleksi
makrofajlar tarafından sonunda uzaklaştırılır ve ayrıştırılır. Antijeni
kaplayan antikorlar, antijenin fagositler (makrofajlar ve
polimorfonükleer lökositler) tarafından yabancı madde olarak tanınabilir
kılar ve fagositler tarafından sindirilir ve imha edilir; bu olay
opsonizasyon olarak adlandırılır.
Bakteriyel toksine bağlanan ve nötralize eden antikorlar, bunların
konakçı hücrelerle etkileşimini ve patolojiye neden olmasını engeller.
Bağlanmamış toksinler konak hücre üzerindeki reseptörlerle reaksiyona
girebildiği halde toksin:antikor kompleksi giremez. Antikorlar ayrıca
tüm virüs parçacıklarını ve bakteri hücrelerini onlara bağlanarak ve
etkisiz hale getirerek nötralize ederler. Antijen: antikor compleksi
makrofajlar tarafından sonunda uzaklaştırılır ve ayrıştırılır. Antijeni
kaplayan antikorlar, antijenin fagositler (makrofajlar ve
polimorfonükleer lökositler) tarafından yabancı madde olarak tanınabilir
kılar ve fagositler tarafından sindirilir ve imha edilir; bu olay
opsonizasyon olarak adlandırılır.
 Kompleman sistemin bakteri hücresini saran
antikorlar tarafından etkinleştirilmesi. Bağlı antikorlar, sonunda
bakteri üzerinde protein kompleksi oluşturan kompleman sistemin ilk
proteini için bir reseptör oluştururlar. Bu, bazı durumlarda bakteriyi
direk öldürebilir fakat genel olarak fagositozla alınması ve yıkım yolu
tercih edilir. Bu yüzden, antikorlar fagositozla yok etmek için
patojenleri ve onların ürünlerini hedef alırlar.
Kompleman sistemin bakteri hücresini saran
antikorlar tarafından etkinleştirilmesi. Bağlı antikorlar, sonunda
bakteri üzerinde protein kompleksi oluşturan kompleman sistemin ilk
proteini için bir reseptör oluştururlar. Bu, bazı durumlarda bakteriyi
direk öldürebilir fakat genel olarak fagositozla alınması ve yıkım yolu
tercih edilir. Bu yüzden, antikorlar fagositozla yok etmek için
patojenleri ve onların ürünlerini hedef alırlar. Şekil 2
Şekil 2 Şekil 3
Şekil 3 Şekil 4
Şekil 4 Şekil 5
Şekil 5 Şekil 6
Şekil 6 İnsan T-lenfositi (SEMx12,080)
İnsan T-lenfositi (SEMx12,080)  Fibroblast Tümor/Kanser Hücrelerine Saldıran İnsan T-lenfositi
(SEMx4,000)
Fibroblast Tümor/Kanser Hücrelerine Saldıran İnsan T-lenfositi
(SEMx4,000)  Küçük lenfositleri gösteren periferik yayma
Küçük lenfositleri gösteren periferik yayma  Nötrofil- elektron mikrografi.
Çekirdeğe ait iki lobu ve azurofilik granüller işaret edilmiştir.
granules
Nötrofil- elektron mikrografi.
Çekirdeğe ait iki lobu ve azurofilik granüller işaret edilmiştir.
granules  Periferik yaymada eozinofil
Periferik yaymada eozinofil  Küçük lenfosit, giemsa ile boyanmış periferal kan
Küçük lenfosit, giemsa ile boyanmış periferal kan 








