|
ÖĞREN,M HEDEFLERİ
Tümöre karşı immün reaktivitedeki delillerin Malignensiye karşı değişen
hücresel özelliklerin bilinmesi
Tümör ilerlemesini etkileyen konak bileşenlerinin bilinmesi
İmmün sistemden koruyan tümör hücre bileşenlerinin bilinmesi
Rasyonel tümör immünoterapisinin ve tedavi yaklaşımlarının anlaşılması
|
MALİGN TRANSFORMASYON
Normal hücrelerin
proliferasyonu oldukça sıkı düzenlenmektedir. Fakat bu hücreler,
kimyasal karsinojenlere, radyasyona ve bazı virüslerle temasa
geçtiklerinde mutasyona uğrayabilir, hücrenin kontrolsüz büyümesine yol
açan transformasyona uğrayabilir ve yümör veya kanzser gelişebilir.
Bir tümör:
-
Sınırsız büyüme kapasitesi
yoksa benigndir ve konak yaşamaya devam edecektir
-
Tümor sınırsız olarak
büyümeye devam eder ve yayılıyorsa (metastaz) malign olarak kabul
edilir ve sonuçta konak ölcektir. Bu kontrolsüz büyüme, onkogenlerin
(kanser indükleyen genler)yukarı regülasyonu ve/veya tümör süpresör
genlerin (normalde tümör büyümesini hücre ölümünü indükleyerek
inhibe etmektedir) down regülasyonu nedeniyle olabilmektedir.
TÜMÖRLERE KARŞI İMMÜN
REAKSİYONLA İLGİLİ KANITLAR
Tümörlerin immün cevabı ortaya
çıkardıkları ile ilgili birçok kanıt bulunmaktadır. Bunlar:
-
Şiddetli mononükleer
infiltrasyonu olan tümörlerin prognozu olmayanlardan daha iyidir
-
Bazı tümörlerin (melanoma,
nöroblastoma gibi) spontan gerilemesi immünolojik cevabı
düşündürmektedir
-
Primer tümörün
uzaklaştırılması ve tümör yükünün azalması ile bazı tümör
metastazları geriler, bu nedenle immün sistem kalıntı tümörün
öldürülmesi için uyarılmaktadır
-
Hernekadar kemoterapi
büyük miktarda tümör hücresini yok etsede, ilaçların etkisinden
kurtulan az bir miktarda hücre büyüyebilir ve komğı öldürebilir.
Fakat, kemoterapotik ile yok edilemeyen bu az miktardaki hücre immün
sistem ile kuşatılabilir
-
Kaposi sarkomuna duyarlı
AIDS gibi immün yetmezlikli hastalıklarda ve EBV enfeksiyonuna
duyarlı transplant hastalarında artmış bir malignensi insidansı
mevcuttur
-
Tümörlü hastalarda tümöre
spesifik antikorlar ve T lenfositler (sitotoksisitede ve
profileratif cevap testlerinde saptanmış) gözlemlenmiştir
-
Genç ve yaşlı popülasyonda
artmış bir tümör insidansı mevcuttur. Popülasyonun bu kısmında
sıklıkla immün sistemde sorunlar bulunmaktadır
-
Konak çeşitli tümör
antijenlerine karşı özgül olarak immünize edilebilir ve immün cevap
uyarılabilir.
TÜMÖRLERLE İLİŞKİLİ
ANTİJENLER
İmmün sistemin tümöre karşı
reaksiyon gösterebilmesi için tümör antijenlerinin yabancı olarak
tanınması gerekmektedir. Tümor oluşumu sırasında bir çok sayıda gen
ekspresyonunda değişiklikler meydana gelmektedir. Tümör oluşumu yeni
antijenlerin (neoantijenler) ekpresyonuna veya normal hücrelerde var
olan antijenlerde değişikliklere yol açabilir. Bu antijenler arasında
membran creseptörleri, hücre siklüsü ve apoptozis düzenleyicileri veya
sinyal iletim yolaklarında yer alan moleküller yer alabilir.
Tümör antijenlerinin iki ana
tipi bulunmaktadır:
-
Tümör spesifik
transplantasyon antijenleri (TSTA), bunlar tümör hücrelerinde
benzersiz olarak bulunurlar ve normal hücrelerde ekprese edilmezler.
Tümörün rejeksiyonundan sorumludurlar
-
Tümör ilişkili
transpalantasyon antijenleri (TATA), bunlar hem normal hemde tümör
hücreleri tarafından ekprese edilirler.
Hernekadar kimyasal, UV veya
virüslerin indüklediği tümörler neoantijen ekprese etse de, tümörlerin
büyük bir çoğunluğu sıklıkla zayıf immünojeniktir veya non-immünojniktir.
Çoğu durumda, TSTAlar kolaylıkla tanımlanamaz. Bazı antijenler sekrete
edilirken diğerleri membranla ilişkili molekül şeklinde bulunabilirler.
Tümör ilişkili
transplantasyon antijenleri (TATA)
Tümör antijenlerinin çoğu
aynı zamanda normal hücrelerde de bulunur ve tümör ilişkili
transplantasyon antijenleri olarak adlandırılırlar. Normal
hücrelerle kıyaslandığında yüksek düzeyde ekprese
edilebilmektedirler. Alternatif olarak, sadece hücrenin gelişimi
süresince eksprese edilebilirler ve olgun evrede kaybolurlar fakat
tümörlerde tekrardan eksprese olurlar.
Tümör ilişkili
gelişimsel antijenler veya onko-fetal antijenler
Bu antijenler arasında
serumda alfa-fetoprotein (AFP) ve karsino-embriyonik antijen (CEA)
bulunmaktadır. AFP hepatosellular karsinoma da bulunurken CEA konon
kanserinde bulunur. Bunlar tanıda önemlidir. AFP sadece sekrete
protein olarak üretilirken CEA hem hücre membranında hem de sekrete
sıvılarda bulunmaktadır. Sekrete antijenlerin tümör immünitesinde
çok az katkılarının bulunması nedeniyle bu neo-antijenlerin immün
sağkalımdaki rolleri tartışmalıdır.
İnsanlardaki AFPnin
normal aralığı 0-20 ng/mldir. Bu düzey hapatomalı ve non-seminal
testiküler karsinomalı hastalarda oldukça fazla yükselmektedir. Bu
proteindeki 5 kat veya daha fazla artış hepatoma ve testiküler
karsinomanın takibinde kullanılmaktadır. AFP düzeyi bazı malignensi
dışı durumlarda da artabilmektedir, bunların arasında siroz, hepatit
ve diğer karaciğer zedelenmeleri yeralmaktadır.
CEA düzeyleri normal
popülasyonda 2.5 ng/mlye kadar çıkabilmektedir, fakat bazı
kanserlerde anlamlı ölçüde artmaktadır özelliklede kolorektal
kanserlerde. Bunlar da malignensi dışı bazı durumlarda
artabilmektedir (örneğin kronik siroz, pulmoner amfizem ve ağır
sigara kullanımı). Normal düzeyden 4-5 kat fazla olmaları ile
kolorektal tümör takibinde kullanılmaktadır.
|
 Şekil 1
Şekil 1 |
VİRAL TÜMORLERDEKİ
TÜMÖR İLİŞKİLİ TRANSPLANTASYON ANTİJENLERİ
Virücler tümörlere neden olabilmektedir:
DNA virüsleri
-
Papova (papilloma, polyoma) virüsleri: Papilloma
virus servikal kansere neden olur
-
Hepatitis virus: Hepatitis B virüs hepatosellüler
kansere neden olur
-
Adenoviruslerde tümoregenik olabilirler
RNA virüsleri
Bir çok virüs hayvanlarda farklı tiplerde tümörlere neden olmaktadır (örneğin
SV-40 virüs, adenovirüs, Rous sarcoma virüs, Friend erythroleukemic
virüs, Moloney Rauscher ve Gross virusleri). Virüsler bazı insan
kanserlerine neden olurlar veya şüpheli durumdadırlar (HTLV 1-lösemi,
hepatitis B virüs-hepatik karsinoma, papilloma virus-servikal kanser).
Virüsle indüklenmiş tümörler aynı virüsle indüklendiğinde tüm tümörler
tarafında paylaşılan hücre yüzey antijenleri aksprese ederler (virion
antijenlerinden ayrı olarak). Bu antijenler tümörün bulunduğu dokunun
kökenine veya hayvan türüne bakılmaksızın tümür indükleyen virüsler için
karakteristiktir (Şekil 1). Daha fazla bilgi onkojenik virüsler kısmında
bulunmaktadır.
|
 Şekil 2
Şekil 2 |
KİMYASAL OLARAK
İNDÜKLENMİŞ TÜMÖRLERDE TÜMÖR İLİŞKİLİ TRANSPLANTASYON ANTİJENLERİ
Antijenik özelliklerindeki aşırı çeşitlilikden dolayı
kimyasal yolla indüklenmiş tümörler viral indüklenmiş tümrlerden
farklıdır. Böylece aynı hayvanda dahi aynı kimyasalla indüklenmiş
herhangi iki tümör nadiren ortak özgül tümör antijenlerini paylaşırlar (Şekil
2). Kimyasallarla indüklenmiş tümörler üzerindeki bu benzersiz
antijenler, tümör spesifik transplantasyon antijenleri (TSTA) olarak
adlandırılırlar.
SİNGENEİK,
ALLOGENEİK VE KSENOGENEİK TÜMÖRLER
Bir hayvan türünde gelişen bir tümör aynı zamanda erkek
kardeş-kız kardeş çiftleşmesi ile elde edilen akraba aynı türde de
büyüyecektir. Bu hayvanlar singeneik olarak adlandırılan aynı MHC
moleküllerini eksprese etmektedirler. Fakat, çoğu normal hayvan
popülasyonu allogeneiktir ve çeşitli MHC haplotiplerine sahiptir. Bu
nedenle, bir hayvandan akraba olmayan diğerine bir tümör transfer
edildiğinde TSTAlardan ziyade allo-MHCler nedeniyle rejekte edilirler.
Bir hayvandan farklı bir türe ait başka bir hayvana tümör
nakledildiğinde ise hayvanlar ksenogeneik oldukları için tümör hızlıca
reddedilecektir.
|
| |
TÜMÖRLERE KARŞI İMMÜNİTE
Hernekadar insanlardaki anti-tümör reaktivitesi ile ilgili bol delil
bulunsada kansere karşı immünte ile ilgili delillerin çoğu hayvanlarla
yapılan deneysel çalışmalardan elde edilmiştir. Işınlanmış tümör hücresi
verilerek veya aynı canlı tümörü uzaklaştırarak fareler immünize
edilirler. Az miktardaki kansere karşı antikor gelişirken, tümör
rejeksiyonunda hücresel immünite kritik öneme sahiptir. Böylece,
immünite çoğu durumda tümörün gerilediği bir hayvandan naif singeneik
alıcıya T lenfositler ile aktarılabilmektedir. Yardımcı T hücreleri (Th),
tümör antijenlerini, hücre içine alıp işleyen ve MHC sınıh II
molekülleri eşliğinde sunan antijen sunan hücrele vasıtasıyla
tanımaktadır. Bu Th hücreleri aktive edildiklerinde sitokin üretirler.
Böylece Th hücreleri B hücrelerinin antikor üretmesine yardım ederler.
IFN-gama gibi sitokinlerde makrofajları tümörisidal olmaları yönünde
aktive edebilmektedir. Dahası, Th hücreleri tümör spesifik sitotoksik T
hücrelerin çoğalması ve farklılaşmasını uyararak onlara yardım ederler.
Sitotoksik T lenfositler sınıf I MHC eşliğinde tümör hücrelerini
tanıyark tümör hücresinin parçalanmasına aracılık ederler. Azalmış
miktarda MHC sergileyen tümör hücreler doğal öldürücü hücreler (NK) ile
tümör rejeksiyonuna uğratılırlar.
İMMÜN GÖZETİMDEN KAÇIŞ
İmmün gözetimden kaçış teorisine göre, vucutta ortaya çıkan kanser
hücreleri immün sistem tarafından yok edilmektedir. Fakat, zayıf immün
tepki nedeniyle canser hücreleri yıkımdan kaçabilmektedirler. Tümörler
immün tanınmadan birçok mekanizma ile kaçınmaktadırlar. Tümörler
immünojenik olan yeni antijenleri ekprese etmeyebilirler veya T
hücrelerin aktivasyonu için gerekli ko-stimülatör moleküllerin
ekpresyonunu gerçekleştirmeyebilirler. Ek olarak, bazı tümörlerde MHC
antijenin ekpresyonu yok veya eksiktir. İimmün gözetimin
başarısızlığının bir diğer nedeni de bir tümörün erken dönemde gelişmesi,
immün sistemi uyarmaya yetecek miktardan çok az antijen olması (düşük
doz toleransı) veya immün sistemi alt eden malign hücrelerin hızlı
proliferasyonu (yüksek doz toleransı) nedeniyle olabilir. Dahası, bazı
tümörler, immünosüpres moleküller ve regülatör hücreleri özellikle
CD4+CD25+ FoxP3+ T regülatör hücreleri indükleyerek immün sistemden
kaçabilmektedirler. Aynı zamanda bazı tümörler etkileşime giren
antijenleri ayırarak antikorları engellerle ve T hücrelerinin tümör
hücreleri ile reaksiyonunu kısıtlarlar.
|
| |
HASTA YÖNETİMİNDE
TÜMÖR NEO-ANTİJENLERİNİN KULLANIMI
Tümör hücreleri üzerinde neo-antijenlerin bulunması tanı
ve tedavi amaçlı olarak kullanılmaktadır.
İmmünolojik
tanı
Radyoizotop işaretli monoklonal antikorlar görece
olarak küçük tümör odaklarını belirlemede in-vivo olarak
kullanılmaktadır. Antikorlar özellikle lenfatik kökenli difarensiye
olmamış tümörlerin hücre kökenini tanımlamada da invitro olarak
kullanılmaktadırlar. Aynı zamanda, immünohistolojik boyalar
özellikle kemik iliği gibi şüpheli metastatik odakların
doğrulanmasında da kullanılmaktadır.
|
| |
İmmünoterapi
İmmünoterapi kanser tedavisinde yeni kullanılmaya
başlanmıştır. Aktif ve pasif olarak özgül olamayan ve özgül immün
sistemin uyarılması çalışılmakta ve bazı durumlarda anlamlı
başarılar elde edilmektedir.
-
Spesifik aktivasyon aşılar kullanılarak
gerçekleştirilir: örneğin Hepatit B aşısı ve Human Papilloma
virus (HPV) aşısı
-
Özgül olmayan aktivasyon ise Bacillus
Calmette-Guerin (BCG) ve Corynebacterium parvum ile elde
edilmeye çalışılmaktadır.
Bunlar makrofajları tümörisidal olmaları için
aktive etmektedir.
i) Tümör antijenlerine spesifik
antikorlar (örn. Meme kanserinde Her2/Neu kullanımı)
ii) Human T lymphotropic virus (HTLV-1)-indüksiyonlu
yetişkin T hücreli lösemide IL-2Rye karşı oluşmuş
antikorlar
iii) Non-Hodgkin B hücreli lenfomada eksprese edilen
CD20ye karşı antikorlar. Bu antikorlar hücre
yüzeyindeki tümör sntijenlerine bağlanırlar ve tümör
hücresini lizise uğratacak olan kompleman sistemini
aktive ederler. Ek olarak, NK hücresi gibi Fc reseptörü
taşıyan hücreler, makrofajlar ve granülositler tümör
hücresi yüzeyindeki antijen-antikor kompleksine
bağlanabilirler ve antikor bağımlı hücresel
sitotoksisite yoluyla tümör hücresinin öldürülmesine
aracılık edebilirler.
iv) Toksinler, radyoizotoplar ve antikanser ilaçlarla
konjuge edilmiş antikorlar kullanılmaktadır. Bunlar
hücre içine girerek protein sentezini inhibe ederler.
Örneğin anti-CD20 konjuge edilmiş Pseudomonastoksini
veya risin toksini.
Antikorların kullanımında çeşitli
problemlerle karşılaşılmaktadır.
-
Antikorlar, tümör antijenlerinin
sınıf I MHVC antijenleri ile ilişkili olmaları
nedeniyle verimli değildir.
-
Tümörler antijenleri ve
antijen-antikor kompleksini ortaya çıkarmayabilir ve
böylece immün hücreler tümörü yok edemezler.
-
Bazı antikorlar sitotoksik
olabilirler.
-
Antikorlar aralarında NK hücre, B
hücre, makrofaj ve granülositin bulunduğu tümör
hücrelerini bağlamamış fakat Fc reseptör taşıyan
hücrelerede non-spesifik olarak bağlanabilirler.
-
Lymphokine-activated killer (LAK),
lenfokinle aktive edilkmiş öldürücü hücreler ki
bunlar IL-2 ile aktive edilmiş T ve NK hücrelerdir.
-
Tumor-infiltrating lymphocytes (TIL),
tümör infiltre eder lenfositler.
ii) Tümör antijenleri ile etkileşmiş Dentritik hücreler
tümör spesifik T hücre cevabını indükleyebilir.
Genellikle tümör antijenleri bilinmediği için tümör
lizatları kullanılmaktadır.
iii) Sitokinler
-
IL-2: IL-2 ekprese eden T hücreleri/NK
hücrelerini aktive eder. Renal hücreli karsinomada
ve melanomada kullanılmaktadır
-
IFN-alfa: Tümör hücresi üzerindeki
MHC ekspresyonunu indükler ve hairy B hücreli
lösemide kullanılmaktadır
-
IFN-gama: MHC sınıf II ekspresyonunu
indükler, yumurtalık kanserlerinde kulalnılmaktadır
-
TNF-alfa: Tümör hücrelerini
öldürmektedir.
iv) Sitokin geni transfekte edilmiş tümör hücreleri T
hücrelerini aktive etmede veya LAK hücre aracılı anti
tümör immünitesini aktive etmede kullanılabilirler.
|
Tablo 1. Tümörlerin
immünoterapisi |
|
Aktif |
Non-spesifik |
BCG, Propionibacterium acnes, levamizol, sitokin
genleri, vb. |
|
Spesifik |
Öldürülmüş tümör hücreleri veya ekstraktları, rekombinant
antijenler, idiotip, eş uyaran molekül genleri vb. |
|
Pasif |
Non-spesifik |
LAK hücreleri, sitokinler |
|
Spesifik |
Antikorlar tek başına veya ilaçlar, ön-ilaç toksinler veya
radyoizotoplarla eşleşmiş olarak; bispesifik antikorlar; T hücreleri |
|
Kombine |
LAK hücreleri ve bispesifik antikorlar |
|
* BCG: Bacillus
Calmette Geurin aşısı |
|
| |
Çeşitli immün sistemi güçlendiren maddeler (biyolojik cevap modifiye
ediciler) anti-tümör immüniteyi kuvvetlendirmek için kullanılmaktadır.
Bunların arasında bakteriyel ürünler, sentetik kimyasallar ve sitokinler
yer almaktadır (Tablo 2). Bu maddelerin çoğu etkilerini makrofajları ve
NK hücreleri aktive ederek, sitokinleri ortaya çıkararak veya T hücre
fonksiyonlarını kuvvetlendirerek gösterirler.
|
Tablo 2. Non-spesifik aktif
immünoterapi: biyolojik cevap modifiye ediciler |
|
Type of BRM |
Examples |
Major effect |
|
Bakteriyel ürün |
BCG, P. acnes, muramil di-peptid, trehaloz
dimikolat |
Makrofaj ve NK hücrelerin aktivasyonu (sitokinler
vasıtasıyla) |
|
Sentetik moleküller |
Pyran, poli I:C, pirimidinler |
Interferon üretiminin uyarılması |
|
Sitokinler |
Interferon-alfa, -beta, -gama, IL-2, TNF |
Makrofaj ve NK hücrelerin aktivasyonu |
|
| |
Birçok sitokin, immün
sistemin bazı komponentleri üzerine potent ve seçici etkilerinin
olduğunun bulunmasıyla konağın immün fonksiyonunu güçlendirmek için
kullanılmıştır (Tablo 3).
|
Tablo 3. Tümörlerin sitokinle
tedvisi |
|
Sitokin |
Tümör tipi ve sonuç |
Anti-tümör mekanizma(lar) |
|
IFN-alfa, beta |
Kıllı hücreli löseminin remisyonu, bazı karsinomalar
üzerine zayıf etki |
Sınıf I MHC molekül ekspresyonunun artışı, muhtemel
sitostatik antitümör etki |
|
IFN-gama |
Yumurtalığın peritoneal karsinomasının remisyonu: sistemik
olarak etkisiz |
MHC antijenlerinin artışı; makrofaj, T sitotoksik ve NK
hücre aktivasyonu |
|
IL-2 |
Renal karsinoma ve melanomanın remisyonu |
T-hücrel proliferasyonu ve aktivasyonu, NK hücre
aktivasyonu |
|
TNF-alfa |
Malign assitleri azaltabilir |
Makrofaj ve lenfosit aktivasyonu |
|
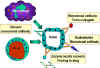 Şekil 3
Şekil 3 |
Monoklonal anti-tümör
antikorlar, direkt etkileri ile veya anti-kanser ilaçlarda, toksinlerde
ve tümöre karşı konak immün sisteminin non-spesifik komponentlerini
hedefleyen araçlar olarak kullanılmaktadır (Şekil 3). Ek olarak, bu
özgül antikorlar, konvansiyonel radyoloji ile tespit edilemeyen
metastatik lezyonların tanısındada kullanılmaktadırlar. |
| |
|
|
|
 Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
This page last changed on
Saturday, April 02, 2016
Page maintained by
Richard Hunt
|

 Şekil 1
Şekil 1 Şekil 2
Şekil 2 Şekil 3
Şekil 3