|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
|
İMMÜNOLOJİ BÖLÜM İKİ
KOMPLEMAN
Gene Mayer, Ph.D
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Çeviri:
Doç. Dr. Erkan Yula
İzmir, Katip Çelebi Üniversitesi, Tıp Fakültesi, Tıbbi Mikrobiyoloji
Anabilim Dalı
|
|
ENGLISH |
|
FRANCAIS |
|
SHQIP |
|
ESPANOL |
|
PORTUGUES |
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|

 |
|
Logo image © Jeffrey
Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
ÖĞRENİM HEDEFLERİ
Kompleman aktivasyonun farklı yollarının anlaşılması
Kompleman aktivasyonunun enzimatik ve non-enzimatik mekanizmaları
Kompleman aktivasyon ürünlerinin biyolojik özellikleri
Kompleman sisteminin konak direnci, enflamasyon ve zedelenmedeki önemi
Kompleman aktivasyonunu ve ürünlerini düzenleyen mekanizmaların anlaşılması
 Jules Bordet
(1870-1961), discoverer of complement National
Library of Medicine
Jules Bordet
(1870-1961), discoverer of complement National
Library of Medicine
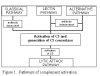 Şekil 1
Şekil 1
Komplena aktivasyon yolları
|
KOMPLEMAN VE FONKSİYONLARI
Geçmişte kompleman terimi (C), bakteriyi parçalayabilen ısıya
duayarlı (serum 56 Cde 30 dk bekletilildiğinde aktivitesi yok/inaktive
olmaktadır) serum bileşenini adlandırmak için kullanılmıştır. Bununla birlikte
komplemanın şimdi konak immün sistemine başka yollarlada katkıda bulunduğu
bilinmektedir. Kompleman, fagositozu güçlendirmek için bakteriyi opsonize
edebilir, polimorfonükleer hücreler (PMN) ve makrofajlarında içinde bulunduğu
çok çeşitli hücreyi toplayıp aktive edebilir, antikor cevabının düzenlenmesine
katılabilir ve immün komplekslerin ve apoptotik hücrelerin temizlenmesine destek
olabilirler. Komplemanın aynı zamanda konağa zararlı etkileride bulunmaktadır;
enflamasyonu ve doku zedelenmesine katkıda bulununabilir ve anaflaksiyi
tetikleyebilir.
Kompleman sistemi, serumda aralarında hepatosit, makrofaj ve
bağırsak epitel hücrelerininde bulunduğu çok çeşitli hücreler tarafından
üretilen 20nin üzerinde proteinden oluşmaktadır (Tablo 1). Bir kısım kompleman
proteini immüngloblulinleri veya hücre membran bileşenlerine bağlanmaktadır.
Diğerleri proenzim tabiatındadır ve aktive edildiklerinde bir veya daha fazla
kompleman proteinlerini oluşturmak üzere parçalanmaktadırlar. Birtakım kompleman
proteinleri parçalandıklarında hücreleri aktive eden, vasküler permiabiliteyi
artıran veya bakteriyi opsonize eden kompleman parçalarını oluşturmaktadır.
|
Tablo 1. Kompleman sistemi
proteinleri
|
|
Klasik Yol |
Lektin Yolu |
Alternatif Yol |
Litik Yol |
|
Aktivasyon Proteinleri:
C1qrs, C2, C3, C4
Kontrol Proteinleri:C1-INH, C4-BP
|
Mannan bağlayan protein (MBP), mannan-ilişkili serin proteaz (MASP, MASP2) |
C3, B & D*
faktörleri, Properdin
(P)
I* ve H faktörleri, decay accelerating factor-bozulma
hızlandırıcı faktör (DAF), Kompleman reseptör 1(CR1),vb. |
C5, C6, C7, C8, C9
Protein S |
|
Altı çizili kompleman bileşenleri aktive edildiklerinde
enzimatik aktivite kazanırlar.
Yıldızla işaretli bileşenlerin doğal formları enzimatik aktiviteye sahiptir.
|
|
| |
KOMPLEMAN AKTİVASYON YOLLARI
Kompleman aktivasyon dört yolla oluşabilmektedir (Şekil 1): klasik yol, lektin
yolu, alternatif yol ve membran atak yolu (litik yol). Klasik ve alternatif
yolların her ikisi de C5 konvertaz enziminin aktivasyonuna yol açarlar ve
membran atak yolunun aktivasyonu için zorunlu olan C5b üretiminini
gerçekleştirirler.
|
|
MOVIE
Complement Activation and Biological Functions
High Resolution
Quicktime
Low Resolution Quicktime
© Scott R. Barnum, University of Alabama, Birmingham, Ala., USA and
The
MicrobeLibrary
|
|
CGAP
More
detailed complement pathways from CGAP/Biocarta |
Klasik Yol (Şekil 2)
C1
aktivasyonu
C1, çoklu alt birimi olan bir proteindir ve üç farklı protein (C1q, C1r
ve C1s) içermektedir, antijen ile etkileşime geçmiş olan IgG ve IgMin
Fc bölgesine bağlanırlar. C1, antijen ile kompleks oluşturmamış bir
antikora bağlanmaz ve bağlanma işlemi kalsiyum ve magnezyum iyonları
gerektirir. (Not: bazı durumlarda C1 agrege olmuş immünglobüline (örneğin
agrege IgG) veya antikor yokluğunda dahi belirli patojenlerin yüzeyine
bağlanabilir). C1in antikora C1q ile bağlanmasıda sıkıca
sabitlenmesinden önce C1q en az iki antikor molekülü arasında çapraz
bağlantı kurmalıdır. C1qnun bağlanması C1rnin aktivasyonuna yol açar
ve bu sırayla C1si aktive eder. Sonuçta aktive edilmiş C1qrsoluşur ve
bu enzim C4ü, C4a veC4b olmak üzere iki parçaya ayırır.
C4 ve
C2 aktivasyonu (C3 konvertaz üretimi)
C4b parçası membrana bağlanır ve C4a parçası ise mikroçevreye serbest
bırakılır. Aktive edilmiş C1qrs aynı zamanda C2yi C2a ve C2b
parçalarına bölmektedir. C2a, C4b ile birlikte olan membrana bağlanır ve
C2b mikroçevreye serbest bırakılır. Sonuçta oluşan C4bC2a kompleksi bir
C3 konvertaz enzimidir ve C3ü, C3a ve C3b fragmanlarına ayıracaktır.
C3
aktivasyonu (C5 konvertaz üretimi)
C3b molekülü, C4b ve C2a ile ilişkili mebrana bağlanır ve C3a
mikroçevreye salınır. Oluşan C4bC2aC3b kompleksi bir C5 konvertaz
enzimidir. C5 konvertazın oluşumu ile klasik yol sonlanmış olmaktadır.
Klasik yolun birçok ürününün,
konak defansına katkılarda bulunan kuvvetli biyolojik aktiviteleri
vardır. Ancak bu ürünlerin bazıları, eğer kontrolsüz bir şekilde
üretilmişse konağa zaralı etkileri de bulunabilmektedir. Tablo 2de
klasik yoldaki komponentlerin biyolojik aktiviteleri özetlenmiştir.
|
Tablo 2. Klasik yol
ürünlerinin biyolojik aktivitieleri |
|
Bileşen |
Biyolojik aktivitie |
| C2b |
Prokinin; Ödeme neden olan kinin
oluşturmak üzere plazmin tarafından bölünmektedir.
|
| C3a |
Anafilotoksin; bazofil ve mast
hücrelerini aktive ederek degranülasyona neden olur ve anaflaksiye
yol açabilen vasküler permiabilete artışına ve düz kaz hücrelerinin
kontraksiyonuna yol açar.
|
| C3b |
Opsonin; kompleman reseptörlerine bağlanarak
fagositozu güçlendirir.
Fagositik hücreleri aktive eder.
|
C4a
|
Anafilotoksin (C3adan daha zayıf
etki)
|
| C4b |
Opsonin; kompleman reseptörlerine
bağlanarak fagositozu güçlendirir. |
Klasik yol düzenlenmemesi durumunda sürekli devam eden bir C2b, C3a ve
C4a üretimi olacaktır. Bu nedenle klasik yolun aktivitesinin kontrol
edildiğii bazı yollar mevcuttur. Tablo 3te bu düzenlenme yolları
özetlenmiştir.
|
Table 3. Klasik yolun
kontrolü |
| Bileşen |
Düzenleme |
| Hepsi |
C1-INH; C1qdan C1r ve C1si
ayırır. |
| C3a |
C3a inaktivatör (C3a-INA;
Karboksipeptidaz B); C3ayı inaktive eder. |
| C3b |
H ve I Faktörleri; Factor H,
Factor I ile C3bnin yıkılmasını kolaylaştırır. |
| C4a |
C3-INA |
| C4b |
C4 bağlayan protein(C4-BP) ve
Faktör I; C4-BP, Factor I ile C4bnin yıkılmasını kolaylaştırır.
C4-BP aynı zamanda C2anın C4b ile ilişkisini korur ve böylece C3
konvertaz oluşumunu engeller. |
Klasik
yolun düzenlenmesinde C1-INHin önemi, bu inhibitörün eksik olduğu
kişilerde gösterilmiştir. C1-INH eksikliği herediter anjioödem gelişimi
ile ilişkilidir.
|
 A
A
Klasik yolda C3 konvertaz üretimi
 B
B
Klasik yolda C5 konvertaz üretimi
 C
C
Klasik yol ile C3ün aktivasyonu
Şekil 2 |
 Şekil 3 Lektin-başlangıçlı yol
Şekil 3 Lektin-başlangıçlı yol |
Lektin Yolu
Lektin yolu (şekil 3) klasik yol ile çok yakından ilişkilidir. Bu yol,
mannoz-bağlayan lektin (MBL)nin mannoz içeren polisakkarit (mannan)
taşıyan bakteriyel yüzeylere bağlanması ile başlatılmaktadır. MBLnin
patojene bağlanması iki serin proteazı olan MASP-1 ve MASP-2nin (MBL-associated
serine proteases) etkileşime girmeşine yol açmaktadır. MASP-1 ve MASP-2
sırasıyla C1r ve C1se benzemektedir, MBL ise C1qya benzemektedir. MBL/MASP-1/MASP-2,
üçlü-moleküler kompleksin oluşumu, MASPların aktivasyonuna ve C4ün C4a
ve C4be olan sonraki kırılmalarına neden olmaktadır. C4b membrana
bağlanırken C4a mikroçevreye serbest bırakılmaktadır. Aktive MASPlar
aynı zamanda C2yi C2a ve C2bye bölmektedir. C2a, C4b ile ilişkili
membrana bağlanır ve C2b mikroçevreye salınır. Oluşan C4bC2a kompleksi
bir C3 konvertazdır ve bu C3ü C3a ve C3bye yıkar. C3b, C4b ile
ilişkili membrana bağlanırken C3a mikro çevreye salınır. Bu sefer oluşan
ürün olan C4bC2aC3b, bir C5 konvertazdır. C5in oluşumu ile lektin yolu
tamamlanmış olur.
Lektin yolunun biyolojik aktivitesi ve düzenleyici protinleri klasik
yol ile aynıdır.
|
 Şekil
4 C3ün spontan aktivasyonu Şekil
4 C3ün spontan aktivasyonu |
Alternatif Yol
Alternatif yol, C3ün aktivasyonu ile başlamaktadır ve normal bir
serumda bulunan B ve D Faktörleri ve Mg++ katyonuna gereksinim
duymaktadır.
C3b ilmik oluşumunun büyütülmesi
(Şekil 4)
Serumda C3i üretmek için C3ün spontan hidrolizi düşük düzeydedir.
Faktör B, C3iye bağlanır ve Faktör Byi Bb ye parçalayacak olan
Faktör D için duyarlı hale gelir. C3iBb kompleksi C3 konvertaz
olarak işlev görür ve C3ü C3a ve C3bye parçalar. C3b birkez
oluştuğunda Faktör B onu bağlar ve Faktör D tarafından parçalanmaya
yatkın hale gelir. Oluşan C3bBb kompleksi de bir C3 konvertazdır ve
daha fazla C3b üretmeye devam edecektir. Eğer bu işlem kontrol
edilmezse serumdaki tüm C3ler tükenecektir. Bu nedenle C3bnin
spontan üretimi sıkı bir şeklide kontrol edilmektedir.
|

 Şekil 5
Şekil 5
DAF ile aktif C3ün düzenlenmesi
 Şekil
6 Cr1 ile aktif C3ün düzenlenmesi Şekil
6 Cr1 ile aktif C3ün düzenlenmesi
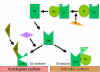 Şekil
7 C3 konvertazın dengelenmesi Şekil
7 C3 konvertazın dengelenmesi
 Şekil 8
Şekil 8
Alternatif yolun stabilize edilmiş C5 konvertazı
|
Amplifikasyon
ilmiğinin kontrolu (Şekil 5 ve 6)
Spontan olarak üretilen C3b otolog konak membranlarına bağlanır, DAF
(decay accelerating factor) ile etkileşime girer ve DAF, Faktör B
ile C3b ilişkisini engellemektedir bu sebeple ek C3 konvertaz
oluşumu engellenir. Ek olarak DAF zaten oluşmuş olan C3
konvertazdaki Bbnin C3bden ayrılmasını hızlandırır doalayısıyla ek
C3b üretimi durur. Bazı hücreler kompleman reseptör 1 (CR1)e
sahiptir. C3bnin CR1e bağlanması Faktör I tarafından C3bnin
enzimatik parçalanmasını kolaylaştırır. Ek olarak C3 konvertazın
(C3bBb) CR1e bağlanması kompleksten Bbyi ayırır. Bu nedenle,
kompleman reseptörüne sahip hücrelerde CR1 aynı zamanda
amplifikasyon ilmiğinin kontrolünde rol oynar. Sonuç olarak Faktör H
hücredeki veya sıvı fazdaki C3bye bağlanabilir ve Faktör I
tarafından C3bnin enzimatik parçalanmasını kolaylaştırır. Böylece
amplifikasyon ilmiği, C3 konvertaz oluşumunun engellenmesi, C3
konvertazın ayrılması veya C3bnin enzimatik yıkımı ile kontrol
edilir. Amplifikasyon ilmiğinin kontrölünün önemi genetik olarak
Faktör H veya I eksikliği olan hastalarda gösterilmiştir. Bu
hastalarda C3 yetmezliği bulunmaktadır ve bazı enfeksiyonlara karşı
artmış duyarlılıkları vardır.
C konvertazın
aktivatör yüzeyler tarafından stabilizasyonu (Şekil 7)
Alternatif yolun uygun bir aktivatörü bağlandığında C3b, C3
konvertaz (C3bBb) üretmek için Faktör D tarafından enzimatik olarak
parçalanan Faktör Byi bağlar. Fakat, C3b Faktör I tarafından
parçalanmaya dirençlidir ve C3 hızlıca degrade olmaz çünkü aktivatör
yüzeyi ile stabilize edilmiştir. Kompleks ilaveten C3bBb bağlayan
properdin ile stabilize edilmiştir. Alternatif yolun aktivatörleri
patojenlerin yüzey bileşenleridir ve Gram negatif bakterinin
lipopolisakkariti ve bazı bakteri ve mantarların hücre duvarını
içerir. Böylece C3b aktivatör bir yüzeye bağlandığında C3 konvertaz
stabil şekilde kalır ve C3ün parçalanmasıyla ek C3a ve C3b üretmeye
devam eder.
C5 konvertaz oluşumu
(Şekil 10)
Aktivatör yüzeydeki stabilize C3 konvertaz tarafından üretilen bazı
C3bler C3bBbC3b kompleksi oluşturmak üzere C3bBb ile ilişkiye girer.
Bu alternatif yolun C5 konvertazıdır. C5 konvertazın oluşumu
alternatif yolun sonudur. Alternatif yol birçok gram negatif (önemli
derecede Neisseria meningitidis ve N. gonorrhoea), bazı Gram pozitif
bakteri ve virüs ve parazitler ile aktive edilebilir ve organizmanın
lizisi ile sonuçlanır. Böylece antikor cevabı oluşmadan önce
komplemanın alternatif yolunun aktivasyonu ile bazı patojenlere
karşı korunma sağlanmış olmaktadır. C3 yetmezliği bu organizmalara
karşı artmış duyarlılıkla sonuçlanmaktadır. Alternatif yol daha
ilkel bir yol gibi görünmekte ve klasik ve lektin yolları muhtamelen
alternatif yoldan gelişmiştir.
|
| |
|
| |
Alternatif yolun enfeksiyona karşı antikor katılımı
olmaksızın non-spesifik bir direnç yolu olduğunu unutmayınız ve böylece
bir çok enfeksiyöz etkene karşı birinci savunma hattı içerisinde yer
almaktadır.
Birçok gram negatif ve bazı gram pozitif bakteriler,
bazı virüsler, parazitler, heterolog kırmızı kan hücreleri, agrege olmuş
immünoglobülinler (özellikle IgA) ve bazı diğer proteinler (örneğin
proteazlar, pıhtılaşma yolu ürünleri) alternatif yolu aktive edebilir.
Bir protein olan kobra venom faktörü (CVF)nün bu yolu aktive etiği
genişçe araştırılmıştır.
|
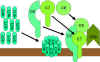 Şekil 9
Şekil 9
Litik yol |
Membran Atak (Litik) Yolağı
(Şekil 9)
Klasik (C4b2a3b), lektin (C4b2a3b) veya alternatif (C3bBb3b) yolun C5
konvertazı C5i C5a ve C5bye parçalar. C5a sıvı fazda kalmaya devam eder ve
C5b hızlıca C6 ve C7 ile ilişkiye girer ve membrana eklenir. Sonra C8
bağlanır ve birçok C9 molekülü üzerine bağlanır. C9 moleküller membranda bir
delik oluşturur ve hücresel içerik sızar ve lizis meydana gelir. Lizis
enzimatik yolla oluşmamakta memebranın fiziksel zedelnmesi sonucu
oluşmaktadır. C5bC6C7C8C9 kompleksi membran atak kompleksi (MAC) olarak
adlandırılmaktadır.
Litik yolda oluşan C5anın birçok potent biyolojik aktivitesi
bulunmaktadır. En potent anaflotoksindir. Ek olarak nötrofilleri için
kemotaktik faktördür ve solunumsal patlamayı uyarır ve makrofajlar
tarafından inflomatuvar sitokin yapımını uyarır. Aktivitesi karboksipeptidaz
B (C3-INA) ile inaktive edilerek kontrol edilir.
Bazı C5b67 kompleksi membrandan ayrılabilir ve sıvı faza geçer. Eğer bu
gerçekleşirse yakındaki hücreye bağlanarak onların da lizisine neden olur.
Olaya katılmayan hücrenin zedelenmeden korunması Protein S (vitronektin) ile
olmaktadır. Protein S çözünür haldeki C5b67yi bağlar ve diğer hücrelere
bağlanmasını önler.
|
 Şekil
10 Şekil
10
C1-INH ile C1rs (C4 konvertaz)in düzenlenmesi |
KOMPLEMAN AKTİVASYONUNUN BİYOLOJİK
AKTİF ÜRÜNLERİ
Komplemanın aktivasyonu direnç, anaflaksi ve enflamasyona katkı sağlayan
birçok biyolojik aktif molekülün üretimine yol açmaktadır.
Kinin üretimi
Klasik kompleman yolunun aktivasyonu ile üretilen C2b bir prokinindir ve
plazmin ile enzimatik olarak deiğişkliğe uğrayarak biyolojik olarak aktif
hale geçer. Aşırı C2b üretimi C1 inhibitör (C1-INH) ile C2nin aktivasyonu
kısıtlanarak sağlanır. C1 inhibitör aynı zamanda serpin olarak da bilinir ve
C1qrs kompleksinden C1rsin yerini değiştirir. (Şekil 10). C1-INHde genetik
bir yetmezlik aşırı C2b üretimi ile sonuçlanır ve herediter anjionörotik
ödeme neden olur. Bu durum C1-INH üretimini kolaylaştıran Danozol ile tedavi
edilebilir veya ε-amino kaproik asit ile plazmin aktivitesi azaltılabilir.
|
|
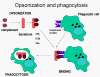 Şekil 11
Şekil 11
Kompleman proteinleri mikroorganizmanın yüzeyine bağlanır ve kompleman
reseptörleri vasıtasıyla fagositozu kolaylaştırır.
 Şekil 12
Şekil 12
C5anın biyolojik etkileri
|
Anaflotoksinler C4a,
C3a ve C5a (sırası ile artan aktiviteleri ile) hepsi anaflotoksindir ve
bazofil/mast hücre degradasyonuna ve düz kas kasılmalarına neden olurlar. Bu
peptitlerin istenilmeyen etkileri karboksipepdidaz B B (C3a-INA) ile kontrol
edilir.
Kemotaktik Faktörler
C5a ve MAC (C5b67) her ikiside kemotaktiktir. C5a aynı zamanda nötrofil,
bazofil ve makrofajların potent bir aktivatörüdür ve vasküler endotelyal
hücrelerdeki adhezyon moleküllerinin uyarılmasına neden olurlar (Şekil 12).
Opsoninler Mikroorganizma
yüzeyindeki C3b ve C4b fagositik hücrenin üzerindeki kompleman reseptörüne
(CR1) bağlanır ve fagositozu kolaylaştırır (Şekil 11).
Diğer biyolojik aktif ürünler
C3ün yıkım ürünleri (iC3b, C3d ve C3e) aynı zamanda farklı hücrelerin
farklı reseptörlerine bağlanırlar ve fonksiyonlarını ayarlarlar.
Özetle, kompleman sistemi hem özgül hemde doğal direncin bir parçasıdır ve
birçok biyolojik ve patofiztolojik etkilere yol açan ürünlerdir (Tablo 4).
Birçok kompleman kompenentinin genetik eksikliği olduğu bilinmektedir, fakat C3
eksikliği en ciddi ve ölümcül olanıdır. Kompleman eksiklikleri aynı zamanda
immün kompleks hastalıklarında (örneğin SLE) ve akut ve kronik bakteiyel, viral
ve parazitik enfeksiyonlarda da meydana gelebilir.
|
|
|
|
|
|
|
|
|
Tablo 4. Kompleman
aktivasyoun ürünlerinin etkileri ve kontrol faktörleri
|
| Parça |
Aktivite |
Etki |
Kontrol Faktörü(s) |
| C2a |
Prokinin, sıvı birikimi |
Ödem |
C1-INH |
| C3a |
Bazofil ve mast hücre
degranülasyonu; vasküler geçirgenlik artışı, düz kas kasılması |
Anaflaksi |
C3a-INA |
| C3b |
Opsonin, fagosit aktivasyonu |
Fagositoz |
Faktör H ve I |
| C4a |
Bazofil ve mast hücre
degranülasyonu; vasküler geçirgenlik artışı, düz kas kasılması |
Anaflaksi
(len az potent)
|
C3a-INA |
| C4b |
Opsonin |
Fagositoz |
C4-BP ve Faktör I |
| C5a |
Bazofil ve mast hücre
degranülasyonu; vasküler geçirgenlik artışı, düz kas kasılması |
Anaflaksi
(en çok potent) |
C3a-INA |
| Kemotaksis, solunumsal
patlamanın uyarılması, fagosit aktivasyonu, inflamatuvar
sitokinlerin uyarılması |
Enflamasyon |
| C5bC6C7 |
Kemotaksis |
Enflamasyon |
Protein S
(vitronektin) |
| Diğer membranlara bağlanma |
Doku hasarı |
|
|
Öğrenilenler
Kompleman sisteminin proteinleri
C3 aktivasyonunda faklı yolların benzerleikleri ve
darklıllıkları
Özgül ve doğal immünitede farklı yolların önemi
Özgül ve doğal bağışıklığın güçlendirilmesinde farklı
kompleman aktivasyon ürünlerinin rolleri
|
|
Tablo 5. Komplman
yetmezlikleri ve hastalıkları |
| Yol/Bileşen |
Hastalık |
Mekanizma |
| Klasik yol |
|
| C1INH |
Herediter anjiyoödem |
C2b (prokinin)nin aşırı
üretimi |
| C1, C2, C4 |
SLE yatkınlık |
İmmün komplekslerin
opsonizasyonu soluble kalmalarını kolaylaştırır, eksikliği
dokuda presipitasyonlarında artışs ve enflamasyona neden olur. |
| Lektin yolu |
|
| MBL |
İnfant ve immünosüpreselerde
bakteriyel enfeksiyonlara duyarlılık |
Lektin yolunu başlatmada
yetersizlik |
| Alternatif yol |
|
| Faktör B veya D |
Piyojenik bakteriyel
enfeksiyonlara duyarlılık |
Etkin bakteri opsonizasyon
eksikliği |
| C3 |
Bakteriyel enfeksiyonlara
duyarlılık |
Opsonizasyon eksikliği ve
membran atak yolunun kullanma yetersizliği |
| C5, C6, C7 C8, ve C9 |
Gram negatif bakteriyel
enfeksiyonlara duyarlılık |
Gram negatif bakterinin dış
membranına saldııda yetersizlik |
| Properdin (Xe bağlı) |
Meningokokal menejite
duyarlılık |
Bakteri opsoznizasyon
eksikliği |
| Faktör H veya I |
C3 ekskliği ve bakteriyel
enfeksiyonlara duyarlılık |
C3ün alternatif yol ile
kontrolsüz aktivasyonu C3ün tükenmesi ile sonuçlanır |
|
|

 |
 Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
This page last changed on
Monday, March 21, 2016
Page maintained by
Richard Hunt
|

 A
A Şekil 3 Lektin-başlangıçlı yol
Şekil 3 Lektin-başlangıçlı yol
 Şekil 5
Şekil 5 Şekil
10
Şekil
10 





