|
x |
x |
|
 |
 |
|
INFECTIOUS
DISEASE |
BAKTERIYOLOJİ |
İMMÜNOLOJİ |
MYCOLOGY |
PARASITOLOGY |
VIROLOGY |
|
|
İMMUNOLOJİ BÖLÜM YEDİ
İMMUNOGLOBÜLİN- ANTİJEN-ANTİKOR REAKSİYONLARI
VE SEÇİLMİŞ TESTLER
Gene Mayer, Ph.D
Emertius Professor of Pathology, Microbiology and Immunology
University of South Carolina
Çeviri:
Doç. Dr. Erkan Yula
İzmir, Katip Çelebi Üniversitesi Tıp Fakültesi Mikrobiyoloji Anabilim
Dalı
|
|
TURKISH |
|
FRANCAIS |
|
PORTUGUES |
|
SHQIP |
|
Let us know what you think
FEEDBACK |
|
SEARCH |
|
|
|

 |
|
Logo image
© Jeffrey Nelson, Rush University, Chicago, Illinois and
The MicrobeLibrary |
|
|
|
|
|
ÖĞRENİM HEDEFLERİ
Antijen antikor reaksiyonlarını tanımlamak
Afinite ve aviditeyi kıyaslamak
Antikor özgüllüğünün ve çapraz reaksiyonun temelini tariflemek
Antijen/antikor reaksiyonları için sık kullanılan testlerin
prensiplerini anlatmak
 Şekil 1
Şekil 1 |
ANTİJEN-ANTİKOR
REAKSİYONLARININ DOĞASI
Anahtar-kilit
kavramı
Bir antikorun birleşim bölgesi molekülün Fab kısmında
yer almaktadır ve hafif ve ağır zincirlerin hipervariable (aşırı dğişken)
bölgelerinden imal edilmiştir. Antijen-antikor etkileşimlerinin X-Ray
kristallografisi ile antijenik determinantın antikorun birleşim
bölgesindeki yarığa yerleştiği gösterilmiştir (Şekil 1). Böylece
antijen-antikor reaksiyonlarında birinin anahtar (örneğin antijen)
diğerininde ona uyum sağlayan bir kilit (örneğin antikor) olduğu kavramı
kabul edilmektedir.
Non-kovalent
Bağlar
Antijeni antikor birleşim bölgesi ile birlikte tutan
bağlar non-kovalent bağ tabiatınadır. Bu bağlar hidrojen bağları,
elektrostatik bağlar, van der waals güçleri ve hidrofobik bağlardır.
Antijen antikor arasındaki çoklu bağlar antijenin antikora sıkıca
bağlanmasını temin eder.
Reversibilite
Antije-antikor reaksiyonlarının non-kovalant bağlar ile
olması nedeniyle olay geri döşür (reversible) tabiattadır.
|
|
ANAHTAR KELİMELER
Afinite
Avidite
Özgünlük
çapraz reaktivite
aglutinasyon
hemaglutinasyon
aglutinin
titre
prozon
Pasif hemaglütinasyon
Direkt Coombs testi
Indirekt Coombs testi
hemaglutinasyon İnhibisyon
Denklik noktası
Antikor fazlalığı
antijen fazlalığı
radyal immunodifüzyon
İmmunoelektroforez
ters akımı immünoelektroforez
Radioimmunoassay
ELISA
Rekabetçi RIA / ELISA
Nonkompetitif RIA / ELISA
immünofloresan
Flow sitometri
kompleman fiksasyon
 Şekil
2
Şekil
2
 Şekil
3
Şekil
3
 Şekil
4
Şekil
4
 Şekil
5
Şekil
5 |
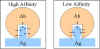
AFİNİTE VE AVİDİTE
Afinite
Antikor afinitesi, bir tek antijenik determinant ile
antikor üzerindeki bir tek birleşim bölgesi arasındaki reaksiyonun
kuvvetidir. Şekil 2de gösterildiği gibi, antijenik determinant ile
antikor birleşim bölgesi arasındaki çekim ve itim kuvvetlerinin
toplamıdır.
Afinite şekil 3de gösterildiği gibi antijen antikor
reaksiyonunu tanımlayan denge sabitidir. Çoğu antikor kendi antijenleri
için yüksek aifiniteye sahiptir.
Avidite
Avidite, multivalan antikorların ve birçok antijenik
determinantlı antijenin toplam bağlanma gücünün miktarıdır. Avidite hem
antikorun valansından hem de antijenin valansından etkilenmektedir.
Avidite ayrı ayrı aifinietenin toplamından daha büyüktür (Şekil 4).
Tekrar edecek olursak, afinite tekbir antijenik
determinantla tek bir antikor birleşim bölgesi arasındaki bağlanma gücü
iken avidite multivalan antijen ve antikorun toplam bağlanma gücüdür.
ÖZGÜLLÜK VE ÇAPRAZ
REAKTİVİTE
Özgüllük
Özgüllük, herbir antikorun
birleşim bölgesinin sadece bir antijenik determinant ile reaksiyona
girebilmesini ifade etmektedir veya antikor molekülü topluluğunun sadece
bir antijen ile reaksiyona girebilmesidir. Genellikle, anijen-antikor
reaksiyonlarında yüksek derecede bir özgüllük vardır. Antikorlar
şunlardaki farklılıkları ayırt edebilirler:
-
Bir antijenin primer
yapısı
-
Antijenin izomerik
formları
-
Antijenin ikincil ve
üçüncül yapıları
Çapraz reaktivite
Çapraz reaktivite, her bir
antikorun bağlanma bölgesinin birden fazla antijenik determinantla
reaksiyona girebilmesi veya antikor molekül toplululğunun birden fazla
antijenle etkileşime girebilmesidir. Şekil 5de çapraz reaktivitenin
nasıl ortaya çıktığı görülmektedir. Çapraz reaktivite, ortak bir epitopu
paylaşan antijen nedeniyle veya üzerinde yapısal olarak epitopa benzeyen
yapılar bulunması nedeniyle olabilmektedir (multisipesifite).
ANTİJEN-ANTİKOR REAKSİYONU
TESTLERİ
Antijen-antikor
reaksiyonlarını ölçümünü etkileyen faktörler
Antijen-antikor reaksiyonun
gerçekleştiğini bilmemizi sağlayan tek yol direkt veye indirekt olarak
anitjen ve antikor arasında oluşsn kompleksin tespit edilmesi ile olur.
Antijen-antikor reaksiyonlarının tespit edilmesi birçok faktöre bağlıdır.
Afinite
Antijen için yüksek afiniteli bir antikor ile daha stabil etkileşim
gerçekleşecektir. Böylece, antijen veya antikorun tespit
edilebilmesi güçlenmiş olacaktır.
Avidite
Multivalan antijenlerle ve multivalant antikor arasındaki
reaksiyonlar daha stabildir ve böylece tespit edilmeleri daha
kolaydır.
|
 Şekil
6
Şekil
6 |
Antijen antibody oranı
Antijen antikor arasındaki oran antijen-antikor kompleksinin
saptanmasını etkilemektedir çünkü oluşan kompleksin büyüklüğü
antijen ve antikorun konsantrasyonu ile ilişkilidir. Bu durum şekil
6da resmedilmiştir.
Antijenin fiziki şekli
Antijenin fiziki durumu, antikor ile reaksiyonunun nasıl
saptanacağını etkilemektedir. Eğer antijen bir partikül halde ise,
genellikle, antijenin antikor tarafından aglutinasyonu araştırılır.
Eğer antijen soluble halde ise, genellikle çözünmez haldeki büyük
antijen-antikor komplekslerinin oluşumu ile oluşan presipitasyon
araştırılır.
|
 Şekil 7
Şekil 7 |
Aglutinasyon Testleri
Aglutinasyon/Hemaglutinasyon
Antijen partiküler halde ise, antikor-antijen reaksiyonu antijenin
aglutinasyonu (kümelenme) ile saptanabilmektedir. Genel bir terim olan
aglutinin, partiküler antijenleri aglutine eden antikorları tanımlamak
için kullanılmaktadır. Eğer antijen bir eritrosit ise, hemaglutinasyon
terimi kullanılır. Tüm antikorlar teorik olarak partiküler antijenleri
aglutine edebilirler fakat IgM yüksek valansı nedeniyle, özellkikle iyi
bir aglutinindir ve bazen iyi bir aglutinasyon varsa antikorun IgM
sınıfından olabileceği sonucu çıkarılabilir.
Kalitatif aglutinasyon testi
Aglutinasyon testleri, bir antijen veya antikorun varlığını
belirleme amaçlı testler olarak kullanılabilmektedir. Antikor
partiküler antijenle karıştırılır ve oluşan aglutinasyonla test
sonucu pozitif olarak değerlendirilir (Şekil 7).
Örneğin, bir hastanın eritrositleri kşinin kan grubu
belirlemek için bir antikor ile karıştırılabilir. İkinci bir
örnekse, hastanın serumu kan grubu bilinen bir eritrosit ile
karıştırılarak hasta serumunda o kan grubuna karşı antikor
varlığı test edilebilir.
|
 Şekil 8
Şekil 8 |
Kantitatif aglutinasyon testi
Aglutinasyon testi anyı zamanda partiküler antijene karşı antikor
düzeyini ölçmede kullanılabilir. Bu testte, antikor taraması
yapılacak örneğin seri diüsyonu yapılır ve sonra sabit sayıda
kırmızı kan hücresi veya bakteri veya benzer partiküler yapıda bir
antijen eklenir. Sonrasında aglutinasyon veren maksimum dilüsyon
saptanır. Maksimum dilüsyon titre olarak adlandırılan gözle
görülebilen aglutinasyondur. Sonuçlar, görülebir aglutinasyonun
olduğu maksimum dilüsyon bildirilerek raporlanır. Şekil 8de
kantitatif hemaglutinasyon testi gösterilmiştir.
Prozon etkisi Bazen antikor konsantrasyonu çok
yüksek olduğunda (örneğin düşük dilüsyonlarda),aglutinasyon
gerçekleşmez ve sonrasında aynı örnek dilüe edildiğinde ise
aglutinasyon gerçekleşir (Şekil 8, hasta 6). Antikorun yğksek
konsantrasyonundaki aglutinasyon yokluğu prozon etkisi olarak
adlandırılır. Prozondaki aglutinasyon eksikliği aşırı miktardaki
antikorun çok küçük kompleksiler oluşturması ve bunlarında
gözlemlenebilir şekilde olmaması nedeniyle olmaktadır.
|
| |
Aglutinasyon testi uygulamaları
- Kan grubunun veya serumdaki gan grup antikorlarının
saptanması
- Bakteriyel enfeksiyonların tanısı
Örneğin, Bilinen bir bakteriye karşı antikor titresinin
artması o türe ait bir enfeksiyona işaret eder. Genellikle
titrede dört kat artış olması anlamlı bir artış olarak
değerlendirilir.
Pratik durum
Hernekadar uygulaması kolay olan bir test olsada semi
kantitatif bir yöntemdir.
|
 Şekil
9
Şekil
9 |
Pasif hemaglutinasyon
Aglutinasyon testi sadece partiküler antijenlerle çalışır. Fakat,
eritrositleri çözünür antijenlerle (örneğin viral antijen, bir
polisakkarit veya hapten) kaplamak mümkündür ve kaplı eritrositler
antikorlar için aglutinasyon testinde kullanılabilirler (Şekil 9).
Bu pasif hemaglutinasyon olarak adlandırılır. Test aynı aglutinasyon
testi gibi uygulanır. Uygulamalar içerisinde soluble antijenlere
karşı antikor ve viral antijenlere karşı antikor testi yer
almaktadır.
|
 Şekil
10
Şekil
10 |
Coomb's Testi (Antiglobulin Test)
Direkt Coomb's Testi
Antikorların eritrositlere bağlanması her zaman aglutinasyon ile
sonuçlanmaz. Bu durum, antijen/antikor oranının aşırı olmasından
veya kırmızı kan hücrelerinin üzerindeki elektrik yükünün hücrelerin
etkin çapraz bağ kurmalarına karşı koruması nedeniyle olabilir.
Bağlanan fakat eritrositlerin aglutinbasyonuna neden olmayan bu
antikorlar inkomplet antikor olarak adlandırılır. Bu durum
antikorların yapısının farklı olduğu anlamına gelmemektedir. Tersine,
sadece bir işlevsel tanımlamadır. Kırmızı kan hücrelerinin
üzerindeki non-aglutinan antikor varlığını tespit etmek için ortama
eritrositleri kaplayan antikora karşı ikinci bir immünglobülin (antikor)
eklenir. Bu anti-immünglobülin artık kırmızı kan hücreleri arasında
çapraz bağlar kurabilir ve aglutinasyona yol açabilir. Şekil 10Da
betimlenen bu olay Direk Coombs testi olarak bilin mektedir.
|
 Şekil
11
Şekil
11 |
İndirekt Coomb's Testi
Serum örneğinin özellikle kırmızı kan hücrelerine karşı
antikor içerip içermediğini öğrenilmesi gerektiği durumlarda
ve potent non-aglutinan antikorların da örnekte tespit
edilmesinden emin olunması gerektiğinde indirek coombs testi
uygulanır (Şekil 11). Bu testde, kırmızı kan hücreleri iler
birlikte serum örneği inkübe edilir, bağlanmayan antikorları
uzaklaştırmak için yıkanır ve sonrasında ikinci bir anti-immünoglobülün
eklenerek çapraz bağların oluşması sağlanır.
Uygulamalar
Anti-rhesus factor (Rh) antikorlarının tespitini
kapsamaktadır. Rh faktörüne karşı oluşan antikorlar
genellikle kırmızı kan hücrelerini aglutine etmemektedir.
Böylece, Rh- anneden doğan, anti-Rh antikoru taşıyan Rh+
çocukların kırmızı hücreleri bu antikorla kaplı olabilirler.
Bunu kontrol etmek için direkt coombs testi uygulanır.
Annenin serumda anti-Rh antikorlarını belirlemek için ise
indirekt coombs testi uygulanır.
|
 Şekil
12
Şekil
12 |
Hemaglutinasyon inhibisyon
Aglutinasyon testi soluble antijenlerin ölçümünü yapabilmek için
modifiye edilebilir. Bu test hemaglutinasyon inhibisyon olarak
adlandırılmıştır. Bu şekilde adlandırılmasının nedeni, bu testte soluble
antijenin antijen kaplı kırmızı kan hücrelerinin aglutinasyonu inhibe
etme kapasitesi ölçülmektedir. Bu testte, sabitlenmiş miktardaki şüpheli
antijene karşı antikor sabitlenmiş miktardaki antijenle kaplı kırmızı
kan hücresi ile karıştırılır (pasif hemaglutinasyona bakınız). Aynı
zamanda antijen varlığı için farklı miktarlarda örnek de analiz
edilebilir. Eğer örnek antijen içeriyorsa, soluble antijen, eritrositi
kaplayan antijen ile antikorlara bağlanmak için yarışacaktır, o sebeple
kırmızı kan hücrelerinin aglutinasyonunu inhibe edecektir (Şekil 12).
Örneğin seri dilüsyonu ile, örnekteki antijenin miktarı
titresi ile belirlenebilir. Bu test genellikle soluble antijenlerin
miktar tayini için kullanılmaktadır ve aglutinasyon testi gibi pratik
durumlara sahiptir.
|
 Şekil 13
Şekil 13 |
Presipitasyon testleri
Radiyal immünodifüzyon (Mancini)
Radyal immünodifüzyonda antikor agar jel hazırlanırken eklenir
ve antijenin farklı dilüsyonları agarda açılan kuyucuklara
yerleştirilir. Antijen gelin içine doğru difüze olurken antikor
ile reaksiyona girer ve eşdeğer noktasında halka şeklinde
presipitasyon oluşur (Şekil 13).
Halkanın çapı, antikor miktarı sabit olduğu için antijen
konsantrasyonu ile orantılıdır. Böylece, standart bir antijenin
farklı konsantrasyonu çalışılarak standart bir eğri
oluşturulabilir ve bilinmeyen örnekteki antijen miktarı tayin
edilebilir. Bu yönüyle test, kantitatif bir testtir. Eğer testte
birden fazla halka ortaya çıkarsa, birden fazla antijen/antikor
reaksiyonu olmuştur. Bu antijen veya antikor karışımı nedeniyle
olabilir. Test, klinik laboratuvarda hasta örneklerinde
immünglobülin seviyelerini belirlemek için yaygın olarak
kullanılmaktadır.
|
 Şekil
14
Şekil
14 |
İmmünoelektroforez
İmmünoelektroforezde, agara açılmış kuyucuğa antijenlerin kompleks bir
karışımı yerleştirilir ve antijenler eletroforeze tabi tutulur, bu
sayede antijenler yüklerine göre ayrılırlar. Elekroforez sonrası, jelde
çukur kesiler ve antikor eklenir. Antikorlar jel içine doğru difüze
olurken, antijen-antikor reaksiyonu gerçekleştiğinde eşdeğer bölgede
presipitin çizgileri oluşur (Şekil 14).
Bu test karışık antijen komplekslerinin kalitatif
analizinde kullanılmaktadır, bununla birlikte kabaca miktar tayinide (çizginin
kalınlığı ile) yapılabilmektedir. Bu test hasta serumunun bileşenlerinin
analizinde yaygın olarak kullanılmaktadır. Serum bir kuyucuğa
yerleştirilir ve serum antikorları ise başka yere yerleştirilir. Normal
serum ile kıyaslanarak serum komponentlerinin bir veya birden fazlasında
eksiklik veya abazı serum bileşenlerinde aşırı fazlalılık (çizginin
kalınlığı) tespit edilebilir. Test aynı zamanda izole serum
proteinlerinin saflığını değerlendirmede de kullanılabilir.
|
 Şekil
15
Şekil
15 |
Karşıakım elektroforezi
Bu testte, antijen ve antikor agarın uzağındaki kuyucuklara
yerleştirilir ve antijen ve antikor birbirlerine doğru elektroforeze
edilir ve karşılaştıkları bölgede presipitasyon çizgisi oluşur (Şekil
15). Test yalnızca antijen ve antikorun farklı yükte oldukları
durumlarda çalışır. Test aslında kalitatiftir fakat bandın kalınlığı ile
miktar belirleme kısmen yapılabilir. En büyük avantajı ise testin
hızıdır.
|
 Şekil
16
Şekil
16
 Şekil
17
Şekil
17 |
Radioimmunoassay (RIA)/Enzyme
Linked Immunosorbent Assay (ELISA)
Radioimmunoassays (RIA) immün komplekslerin radyoaktivitelerinin
ölçümüne dayalı bir yöntemdir. Belirli testlerde işaretli madde antijen
veya antikor olabilmektedir. Enzyme Linked Immunosorbent Assays (ELISA)
testi ise immün komplekslerle işaretli enzimatik reaksiyonun ölçümüne
dayalı bir testtir. Bu testte enzim antijen veya antikor ile
bağlanılabilir.
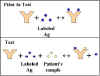
Antijen tespitinde yarışmalı RIA/ELISA
Antijen ölçümünde RIA ve ELISAnın yöntem ve prensipleri şekil 16da
gösterilmektedir. Bilinen miktardaki işaretsiz antijen kullanılarak
standard eğri elde edilebilir ve bu eğri kullanılarak bilinmeyen
örnekteki antijen miktarı hesaplanabilir. Burdaki kilit nokta, test
immün kompleksi kalan bileşenlerden ayırımıdır. Bu çok farklı
yollarla gerçekleştirilebilir ve testin temeli ile
isimlendirilmişlerdir:
Amonyum sülfatla presipitasyon
Amonyum sülfat (%33-50 son konsantrasyonda) immünglobülinleri
presipite edecektir fakat çoğu antijene etki etmemektedir. Bu
nedenle, immün kompleks ile serbest antijen ayırımında bu test
kullanılabilir. Bu yöntem Farr tekniği olarak adlandırılmıştır.
Anti-immunoglobulin antikor
İlk antikora yönelik ikinci bir antikor eklenmesi immün
komplekslerin presipitasyonu ile neticelenecektir ve böylece
serbest antijenden komplekslerin ayırımı yapılabilecektir.
Antikorun sabitlenmesi
Antikor, plastik boncukların veya plastik pleytlerin üzerinde
sabitlenebilir ve böylece immünkompleksler boncuğun veya pleytin
yıkanması ile kolayca diğer bileşenlerden uzaklaştırılabilir (Şekil
17). Günümüzde bu yöntem en çok kullanılan yöntemdir ve katı faz
RIA veya ELISA olarak adlandırılmaktadır. Klinik
laboratuvarlarda yarışmalı RIA ve ELISA serum preotinlerinin,
hormon ve ilaç mertabolitlerinin belirlenmesinde yaygın olarak
kullanılmaktadır.
|
|
TUTORIAL
ELIZA ASSAY
HHMI
Requires Flash |
 Şekil
18
Şekil
18
 Şekil
19
Şekil
19 |
Antijen veya
Antikor tespitinde yarışmasız RIA/ELISA
Yarışmasız RIA/ELISA yöntemleride antijen ve antikor ölçmede
kullanılmaktadır. Şekil 18de boncuklar antijenle kaplanmıştır ve
bilinmeyen örnekteki antikoru saptamak için kullanılmaktadır.
İşeretli ikinci antikorun miktarı bilinmeyen örnekteki antikor
miktarı ile ilişkilidir. Bu test yaygın olarak bilinen bir antijen
kullanılarak özel bir antijenle ilişkili IgE sınıfı antikorları
ölçmede kullanılmaktadır ve anti-IgE antikorları işaretli reagen
olarak kullanılmaktadır. Bu test RAST (radioallergosorbent test)
olarak adlandırılmaktadır. Şekil 19da boncuk anitikorla
kaplanmıştır ve bilinmeyen antijenin ölçümü için kullanılacaktır.
İşaretli ikinci antikorun miktarı antijene bağlanan ilk antikorla
orantılıdır.
|
 Şekil
20
Şekil
20 |
Hücresel Antijen
Testleri
İmmünofloresans
İmmünofloresans, antikorun floresan bir molekülle (fluorescein veya
rhodamine veya diğer fluorescent boyalar) işaretli olduğu vebir
hücre veya dokudaki antijenin işaretli antikorla reaksiyona girerek
floresans vermesine dayalı bir tekniktir.
Direkt immünofloresans
Direkt mmünofloresansda, antijene spesifik antikor direkt olarak
flourokrom ile işaretlenmiştir (Şekil 20)
|
 Şekil
21
Şekil
21 |
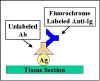
İndirekt immünofloresans
İndirekt immünofloresans, antijen spesifik antikor
işaretlenmemiştir ve ilk antikora yönlendirilmiş ikinci bir
anti-immünoglobülin antikor flourokrom ile işaretlenmiştir (Şekil
21). İndirekt immünofloresans, sinyal çoğaltması nedeniyle
direkt yöntemden daha hassastır.
|
 Şekil
22
Şekil
22 |
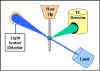
Flow Sitometri (Akımölçer)
Flow sitometri, belirli bir antijeni taşıyan hücreleri tanımlamak ve
saymak için yaygın olarak kullanılan bir yöntemdir. Süspansiyondaki
hücreler floresans veren bir madde ile direkt veya indriekt olarak
işaretlenmiştir. Sonrasında hücreler flow sitometri cihazında analiz
edilmektedir.
Şekil 22 flow sitometrinin prensibini özetlemektedir.
Flow sitometri cihazında hürceler ince kapillerlerden akmaktadır ve
lazer ışık kaynağı ile muamele edilirler. Hücreler geçerken üzerlerine
gelen lazer ışığı etrafa saçmaktadırlar ve cihaz tarafından bu ölçülerek
miktar ve hücre büyüklüğü hakkında bilgi edinilenilmektedir.
|
 Şekil
23
Şekil
23 |
Şekil 23de flow sitometriden elde edilen veri tipi
görülmektedir. Bir parametreli histogramda, artan floresans
miktarı (örneğin yeşil florosans) x ekseninde çizilmekte ve
floresans veren hücrelerin sayısı ise y ekseninde
gösterilnmektedir. Floresan hücre fraksiyonu eğrinin altında
kalan alanın tümleştirilmesi ile belirlenebilmektedir. İki
parametreli histogramda, x ekseni bir parametre (örneğin kırmızı
floresans), y ekseni ikinci parametredir (örneğin yeşil
florosans). Hücrelerin sayısı kontur ile ve rengin yoğunluğu ile
görterilmiştir.
|
 Şekil
24
Şekil
24
 PowerPoint animation Şekil 24
PowerPoint animation Şekil 24 |
Kompleman
fiksasyonu
Antijen/antikor kompleksleri komplemanı bağlayabilme
kabiliyetleri ile ölçülebilmektedirler çünkü antijen/antikor kompleksi
eğer kompleman var ise tükenecektir ve serbest antijen veya antikor
varlığında ise tükenmeyecektir. Antijen/antikor kompleksi için test,
komplemanın tüketimine bağlıdır ve antijen/antikor reaksiyonlarının
miktarını belirlemede kullanılmaktadır. Bu test sadece kompleman fiske
eden antikorlarla (IgG ve IgM en iyisidir) çalışmaktadır.
Kompleman fiksasyon testinin çalışma prensibi şekil
24de görülmektedir. Antijen test edilecek (antikor aranan) serumla
karıştırılır ve antijen/antikor kompleksinin oluşması sağlanır. Antijen
eklenmemiş kontrol tüpü de hazırlanır. Tüpde antijen/antikor kompleksi
yok ise kompleman fikse edilmeyecektir. Fakat, eğer antijen/antikor
kompleksi var ise komplemanı fikse edecek ve tüpdeki kompleman miktarını
düşürecektir. Sonra tüplere, daha önceden anti-eritrosit antikorları ile
kaplanmış standart miktarda eritrosit süspansiyonu eklenir. Tüm
komplemanı kullanmaya yetecek kadar antikor kaplı kırmızı kan
hücrelerinin miktarı daha önceden belirlenmiştir. Eğer tüm kompleman
hala var ise (örneğin antijen/antikor kompleksi oluşmamışsa) tüm kırmızı
kan hücreleri parçalanacaktır. Eğer antijen/antikor kompleksi oluşmuşsa
komplemanın bir kısmını tüketecekler ve böylece antikor kaplı kırmızı
kan hücreleri parçalanmayacaktır. Basitçe tüpteki kırmızı kan
hücrelerinin parçalanması ile ortama salınan hemoglabin miktarı
ölçülerek indirekt olarak antijen/antikor kompleksi miktarı
belirlenebilecektir. Kompleman fiksasyon testleri, bir test örneğindeki
antikorları belirlemek için yaygın olarsak kullanılmıştır ve antijen
ölçümü için modifiye edilebilirler.
|
| |
 Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz Mikrobiyoloji ve İmmünoloji On-line, İMMÜNOLOJİ Bölümüne Dönünüz
|
|


|
This page last changed on
Sunday, March 27, 2016
Page maintained by
Richard Hunt
|

 Şekil
6
Şekil
6 Şekil 8
Şekil 8 Şekil
12
Şekil
12 Şekil 13
Şekil 13 Şekil
16
Şekil
16
 Şekil
20
Şekil
20 Şekil
21
Şekil
21 Şekil
22
Şekil
22 Şekil
24
Şekil
24




