 |
|||||||||||||||||||||||||||||||
| BAKTERIYOLOJİ | İMMÜNOLOJİ | MYCOLOGY | PARASITOLOGY | VİROLOJİ | |||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
| Español | |||||||||||||||||||||||||||||||
|
Let us know what you think FEEDBACK |
|||||||||||||||||||||||||||||||
| SEARCH | |||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
BU BÖLÜM ÇEŞİTLİ KISIMLARINDA
SONRAKİ BÖLÜME GİTMEK İÇİN YUKARIDAKİ NEXT >> düğmesini kullanın |
|||||||||||||||||||||||||||||||
|
Azidotimidin (AZT) 1987 yılında monoterapi olarak kullanıma girmiştir. AZTnin hastaların yaşam süresine katkısı çok az olmuştur. Günümüzde kullanılan yüksek derecede etkili antiretroviral tedavi (HAART) olarak adlandırılan üçlü kombinasyon tedavilerinin keşfine kadar son yirmi yıl içerisinde Anti-HİV ilaçlar konusunda büyük gelişmeler elde edilmiştir. HAART, HİV ile enfekte hastalarda görülen semptomları baskılayıp, yaşam sürelerini uzatsa da; beraberinde büyük yan etkileri de getirmiştir. Ayrıca, bu ilaçlar vücudun bazı bölümlerine zayıf oranda geçmektedirler (örneğin; beyin), toksiktirler ve dirençli mutantların seçilmesine neden olabilirler. Vücudun farklı bölgelerinde farklı dirençli mutantlar ortaya çıkabilir. Bu ilaçlar HİV replikasyonunu hedef aldıkları için, ön entegrasyon kompleksleri üzerine ve latent enfekte T lenfositlerine entegre olan provirüsler üzerine etkileri yoktur. Sonuç olarak, anti HİV ilaçlar HİV enfeksiyonunu daha kolay kontrol edilebilir bir hastalık yapmış olmasına rağmen, henüz kür sağlanamamıştır ve tedavi konusunda yeni yaklaşımlara oldukça ihtiyaç vardır. HIV YAŞAM DÖNGÜSÜNDE MÜDAHALE EDİLEBİLECEK AŞAMALAR Viral enfeksiyonlar ile mücadelede kemoterapötik ajanların geliştirilmesi için çalışılırken, virüsün yaşam döngüsünün konak hücreyi öldürmeden kesilebilmesi önemlidir. Virüsler birçok sentez reaksiyonu için konak hücrenin metabolik süreçlerini kullandığından bunu başarmak zordur. Özgüllük elde edebilmek için, virüse özgü süreçler tanımlanmalıdır. Eğer ajan konak hücrelerine toksik ise, sadece virüs ile enfekte olan hücrelerin öldürülüyor olması gerekmektedir. HİV birçok hücresel süreci kullanırken, kendisine özgü olan hayati işlevleri de vardır ve bunlar ilaç tasarımında başarı ile kullanılmıştır. HİV replikasyon döngüsünün bazı aşamaları kemoterapötik ilaçlar için hedef olabilir. Replikasyon döngüsündeki aşamalar aşağıda özetlenmiştir:
İtalik olarak yazılan aşamalar
virüse özgü olduklarından ilaçlar için uygun hedeflerdir. |
|||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
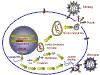 HIV yaşam döngüsünün kemoterapötik müdahale için uygun yerleri
HIV yaşam döngüsünün kemoterapötik müdahale için uygun yerleri |
Son yıllara kadar ancak birkaç ilaç için HİVe karşı toksik olmayan konsantrasyonlarda yeterli etki elde edilerek ileri araştırmalar için izin alınabilmiştir. Etkin ajanlar T4 lenfositler, nöral hücreler, makrofajlar, epitelyal hücreler gibi hücrelerdeki virüse etki edebilmeli ve hastalarda virüsü ortadan kaldırabilmelidir. Çoğu ajanın virüsid etkiden ziyade virüstatik etkisi bulunmaktadır. Ancak virüsün en azından bazı bireylerde nihai eradikasyonunu sağlayabilecek yeni yaklaşımlara dair umutlar mevcuttur. Bununla birlikte, HİV ile enfekte dinlenen bellek T hücrelerinin yavaş temizlenmesi yüzünden bu eradikasyonun hiçbir zaman sağlanamayacağına dair büyük şüpheler de bulunmaktadır. Şu anda virüsü ortadan kaldırmak için
kullanılan kemoterapötik yaklaşım HAART veya üçlü ilaç tedavisidir:
|
||||||||||||||||||||||||||||||
|
VİRAL GENOM TRANSKRİPSİYON İNHİBİTÖRLERİ Tek sarmallı RNA genomu, retrovirüslere özgü olan revers transkriptaz enzimi ile çift sarmallı DNAya transkripte edilir. Revers transkripsiyon; ökaryotik hücrelerin normal fonksiyonu olmadığı gibi anti HİV ilaçlar için önemli bir hedeftir ve ilk anti HİV ilaç olan azidotimidin (AZT) bunun bir örneğidir.
|
|||||||||||||||||||||||||||||||
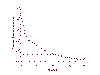
Bir üçlü ilaç rejimi (HAART) ile tedavi edilen hastalarda HIV partiküllerinin sayısında düşüş. Klinik olarak enfekte hastalar HAART ile tedavi edildi. Plazma viremisi iki aşamada düşer: 2 hafta içinde,% 99 azalmıştır. Bu daha yavaş bir düşüş izler; 8. haftada ise, HIV viral titreleri tahlil tespit sınırlarının altında düşmüştür |
.
|
||||||||||||||||||||||||||||||
 AZT
AZTFrom NIH-NIAID |
|
||||||||||||||||||||||||||||||
 From NIH-NIAID
From NIH-NIAID |
|
||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
 From NIH-NIAID
From NIH-NIAID |
|
||||||||||||||||||||||||||||||
 From NIH-NIAID
From NIH-NIAID |
Neden revers transkriptaz inhibitörleri tam olarak işe yaramaz? Nükleozid revers transkriptaz
inhibitörlerinin hiçbiri günümüzde monoterapi olarak kullanılmamaktadır. HAART
rejiminin bir parçası olarak kombinasyon tedavilerinde kullanılmaktadırlar.
Başlangıçta viral yükü % 50-90 oranında azaltırlar, ancak uzun dönemde yeterli
ilaç seviyesinin devamını sağlamak zordur. Altı ay ile bir yıl içinde bu
ilaçlara karşı direnç gelişir ve bu durum uzun bir süre önce enfekte olan
hastalarda daha hızlı bir şekilde gerçekleşir. Bunun nedeni virüsün daha çeşitli
formlarına sahip olmalarıdır. Revers transkriptaz enziminde meydana gelen
mutasyonlar direncin gelişmesine yol açar. Bu mutasyonların nedeni virüsün
oldukça hızlı prolifere olması ve konak hücre polimeraz II enzimi ile
proofreading aktivitesinin yapılmamasıdır. |
||||||||||||||||||||||||||||||
|
Tenofovir uyuşturucu bağımlılarında HİV enfeksiyonunu önler Uyuşturucu
bağımlıların ortak iğne kullanması sonucu bulaşan HİV enfeksiyonu ABDdeki
olguların yaklaşık % 8ini, tüm dünyadaki olguların yaklaşık % 10unu
oluşturmaktadır. Doğu Avrupada olduğu gibi diğer birçok ülkede de uyuşturucu
bağımlılarında görülen yeni enfeksiyonların oranı yükselmektedir. Taylandda
2400 uyuşturucu bağımlısı ile yapılan bir çalışmada, tenofovir ile profilaksi
uygulamasının enfeksiyonu % 49 oranında azalttığı gösterilmiştir. Tenofoviri
düzenli olarak kullanan uyuşturucu bağımlılarında (Kan tenofovir düzeyinin
tespiti ile belirlenmişlerdir.) ise enfeksiyon oranı % 74 azalmıştır. |
|||||||||||||||||||||||||||||||
|
Non Nükleozid Revers Transkriptaz İnhibitörleri Non nükleozid revers transkriptaz inhibitörleri, enzimin aktif bölgesi dışındaki bir bölgesine bağlanırlar. Bu yüzden de non kompetitif inhibitörlerdir. HİV tedavisinde AZT ve diğer nükleozid analogları ile karşılaşılan sorunlar, revers transkriptaz enzimini inhibe eden başka yaklaşımlara yönelmeye yol açmıştır. Kombinasyon tedavilerinde alternatif ilaçlar faydalı olabilir, çünkü revers transkriptaz enziminin fonksiyonunu kaybetmeden taşıyabileceği mutasyonların bir sınırı vardır. Açıktır ki, non kompetitif non nükleozid analoglara karşı dirence yol açan mutasyonlar, kompetitif nükleozid analoglarına karşı dirence yol açan mutasyonlardan farklı bir bölgede oluşacaktır. Dirençli virüs suşları, diğer non nükleozid revers transkriptaz inhibitörlerine karşı çapraz dirençli olmalarına rağmen, nükleozid inhibitörlere karşı dirençli olmayacaklardır. Beklendiği gibi, bu ilaçlar revers transkriptaz enzimini hedef aldıkları için, hücre kültürlerinde sadece birkaç pasajdan sonra bile dirençli mutantlar hızla ortaya çıkar. Bu nedenle monoterapide dar kullanım alanına sahiptirler. Bu ilaçlar elimizdeki en güçlü ve en seçici inhibitörlerdir. Nanomolar konsantrasyonlarda etki etmektedirler. Nükleozid analoglarının aksine, hücre kültürleri ile yapılan testlerde minimal toksik etkiye sahip oldukları gösterilmiştir (Antiviral aktiviteleri, sitotoksik etkilerinin görüldüğü konsantrasyonlardan 10.000 ile 100.000 kat daha düşük konsantrasyonlarda görülmektedir.). Ayrıca AZT gibi nükleozid analogları ile sinerjistik etkilerinin oldukları gösterilmiştir. İnsanlarda kullanıldıklarında bazı toksik etkilere yol açmaktadırlar. Bu ilaçlar nükleozid analoglarına
karşı dirençli HİV enfeksiyonunda etkindirler. Yüksek terapötik indekse ve iyi
biyoyararlanıma sahip oldukları için anti viral konsantrasyonları kolaylıkla
elde edilebilir.
|
|||||||||||||||||||||||||||||||
 From NIH-NIAID
From NIH-NIAID |
|
||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
 From NIH-NIAID
From NIH-NIAID |
|
||||||||||||||||||||||||||||||
 From NIH-NIAID
From NIH-NIAID |
|
||||||||||||||||||||||||||||||
|
Nükleozid Analogları ile Yapılan Kombinasyon Tedavileri AZT ve benzeri analogların kullanıma girmesinden sonra, bu ajanlar anti HİV ajanlar olarak yeterli olamadıkları için yeni tedavi yolları aranmıştır. Bunun nedeni bu ajanların yan etkileri ve aşağıda belirtilen özellikleridir:
AZTnin sağkalım üzerine etkisi yoktur. Nükleozid inhibitörlerinin kombinasyonları daha etkilidir. Başlangıç değerine göre plazma HİV RNA düzeylerinde yaklaşık % 10 oranında azalma sağlarlar ve bunu 2 yıla kadar sürdürebilirler. Bu durum hastalığın ilerlemesini geciktirir, ancak önlemez.
|
|||||||||||||||||||||||||||||||
|
|
PROTEAZ INHIBITORLERİ Proteaz inhibitörlerinin keşfedilmesi ile birlikte, hastalığın ilerlemesinin engellenerek bu hastalığın kontrol edilebilir bir hastalık olacağı yönünde umutlar oluşmuştur. Viral yük, bu hastalığın ilerlemesinde anahtar rol oynar. Bu yüzden hastalığın kombinasyon tedavileri ile kontrol edilebileceği düşünülmektedir. Birçok aspartil proteaz inhibitörü
geliştirilmiştir. Ancak sadece birkaç tanesi onay almıştır. Hepsi substrat
analoğudur. Viral proteaz enziminin aktif bölgesine bağlanan taklitçi
peptidlerdir. Bir diğer ilaç grubu da dimerik aspartil proteazlardır. Proteaz
inhibitörleri tek başlarına kullanıldıklarında viral yükü başlangıç değerinin
1/30 ile 1/100üne kadar düşürebilirler. Ancak suboptimal dozlarda
kullanıldıklarında, birkaç hafta veya birkaç ay içinde viral baskılanma ortadan
kaybolur. Proteaz geninde çoklu mutasyonlar oluşarak ilaç direncinin gelişmesine
yol açar. Ancak viral baskılanma devam eden hastalarda mutasyon oluşmaz. Çünkü
mutasyonların oluşabilmesi için ilaç baskısı altındayken replikasyonun devam
ediyor olması gerekmektedir. |
||||||||||||||||||||||||||||||
 From NIH-NIAID
From NIH-NIAID |
|
||||||||||||||||||||||||||||||
 From NIH-NIAID
From NIH-NIAID |
|
||||||||||||||||||||||||||||||
 From NIH-NIAID
From NIH-NIAID |
|
||||||||||||||||||||||||||||||
|
|
YÜKSEK ETKİLİ ANTI-RETROVIRAL TEDAVİ (HAART) HAART üçlü ilaç tedavisinden oluşmaktadır. Genellikle iki nükleozid revers transkriptaz inhibitörü bir non nükleozid revers transkrip inhibitörü veya proteaz inhibitörü ile kombine edilir. Örneğin; iki nükleozid revers transkriptaz inhibitörü olarak lamivudin (3TC) ve zidovudin (AZT) ile proteaz inhibitörü olarak indinavirin kombine edilmesi gibi). Bir başka örnek olarak; tenofovir ve emtrisitabin ile non nükleozid inhibitör olan efavirenz kombine edilebilir. HAART, hastalığı henüz ilerlememiş ve klinik olarak
stabil olan hastalarda HİV RNA düzeylerini uzun süre baskılamıştır ve bu
hastalarda 10 yıl boyunca T4 hücre kaybı olmamıştır (Bu durum proviral formları
barındıran viral partiküllerinin ortama salınması ile oluşan reenfeksiyon
varlığında görülmemektedir). Latent, kalıcı olarak enfekte olan CD4 hücrelerinin
vücutta uzun süre kaldıkları bilinmektedir. Bu hücreler virüsün proviral
formlarını barındırırlar. Antijen ile reaktive olduklarında viral partikül
sentezini başlatabilirler. Eskiden, hasta kötüleştiğinde tedaviye bir ilaç eklemek gibi bir yaklaşım mevcuttu. Ancak bu durum dirençli virüslerin seleksiyonuna yol açacaktır ve kombinasyon tedavisinin faydalarını ortadan kaldıracaktır. Eğer eradikasyon mümkün hale gelirse, agresif erken tedavi tercih edilebilir. Bu tedavi rejimi ile kanda viral yük
tespit edilemeyecek seviyelere inse de genital sekresyonlarda hala virüs
bulunmaktadır. Bu yüzden bu kişiler hala bulaştırıcı kabul edilirler. Son
zamanlarda, proteaz inhibitörü direnci olan virüs barındıran kişiler tarafından
enfekte olan hastalar görülmektedir. Bu durum, HAART rejimi altındaki hastaların
partnerleri ile korunmasız cinsel ilişkiye girdiklerini göstermektedir.
|
||||||||||||||||||||||||||||||
 Bazı Batı Avrupa ülkelerinde AIDS mortalite
üzerine HAART'ın devam eden etkisi: 1998-2002. Kaynak: Avrupa HIV / AIDS
sürveyans (2002). Yıl sonu raporu. AIDS Epidemiyolojik İzleme Avrupa Merkezi
tarafından derlenen veriler.
Bazı Batı Avrupa ülkelerinde AIDS mortalite
üzerine HAART'ın devam eden etkisi: 1998-2002. Kaynak: Avrupa HIV / AIDS
sürveyans (2002). Yıl sonu raporu. AIDS Epidemiyolojik İzleme Avrupa Merkezi
tarafından derlenen veriler. |
İlaçlar günde üç kez olmak üzere her gün alınmalıdır. Virüs hastadan eradike edilmediği için tedavi ömür boyu devam eder. Farklı kullanım koşulları (aç veya tok gibi) nedeniyle bu ilaçlar ayrı ayrı alındıklarında bazı hastalarda kafa karışıklığı oluşabilmektedir. Atripla, HAART rejimine uygun olarak üç ilacın kombine edildiği, günde bir kez alınma kolaylığını sağlayan bir ilaçtır. İki nükleozid revers transkriptaz inhibitörü (Tenofovir ve emtrisitabin) ve non nükleozid revers transkriptaz inhibitörü (Efavirenz) içerir. AZT içermemektedir. Günümüzde proteaz inhibitörlerinin
yıllık yaklaşık 7000$ maliyeti vardır. Zidovudin + lamivudin + proteaz
inhibitörü tedavi rejiminin ise yıllık 12000$ maliyeti vardır. AİDS hastasının
tedavi maliyetleri ile karşılaştırıldığında, HAART maliyet etkindir. Ancak ne
yazık ki dünya çapındaki AİDS epidemisine bir çare olamamaktadırlar. 2001
yılında Hindistandaki bir ilaç şirketi olan Cipla, ABDye yıllık kişi başı 350$
maliyeti olan bir HAART rejimi sunmuştur.
|
||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
HAART kullanılarak elde edilen muhteşem sonuçlarla
birlikte bu ilaçların yan etkileri de bulunmaktadır. Örneğin, proteaz
inhibitörleri kullanan hastaların % 40-60ında lipodistrofi görülür. Anormal yağ
dağılımı ile karakterize olan bu durumda subkutan yağ dokusunun kaybı, karın
çevresinde genişleme, servikodorsal bölgede yağ yastığı (buffalo hörgücü),
göğüslerde büyüme, iç organların etrafında yağ dokusu birikimi görülür. Vücutta
şekil bozukluğu gelişir. Ayrıca bazı proteaz inhibitörleri hemolitik anemi ve
kanamalara neden olabilir.
|
|||||||||||||||||||||||||||||||
|
DİĞER ANTI-HIV İLAÇLARI HAART, hastalarda viral yükü
baskılamada çok etkin olsa da, yüksek maliyeti olması ve tüm hastalarda etkili
olmaması nedeniyle yeni tedavi arayışları devam etmiştir. Ayrıca HAART
rejimlerine karşı dirençli olan virüs suşları ortaya çıkmıştır. Hücre yüzeyindeki HİV reseptörlerini
hedef almak mantıklı olacaktır. Çünkü bu aşama enfeksiyonun ilk basamağı ve aynı
zamanda hız sınırlayıcı basamağıdır. Hücre içine girişin ilk aşaması adezyondur.
Muhtemelen heparan sülfat proteoglikan gibi yüklü bir molekül ile meydana
gelmektedir. Ancak bağlanma mekanizmalarının hücre tipine göre değiştiği
unutulmamalıdır. Bu alanda çok az ilerleme kaydedilebilmiştir. |
|||||||||||||||||||||||||||||||

Cyanovirin-N |
Virüsün hücre içine girişini engelleyen ilaçlar Virüsün hücre içine girişi, CD4 antijen, reseptör ve kemokin ko-reseptörleri ile olmaktadır. HİV gp120 ile bunlardan herhangi birinin etkileşiminin engellenmesi enfeksiyonun engellenmesini sağlayabilir. Gp120 ya da bu reseptörlere bağlanan antikor/antikor türevlerinin kullanımı yararlı olabilir. Ancak bu ajanların hiçbiri oral yolla alınamamaktadır. Benzer şekilde, gp120ye sahte olarak bağlanan reseptör/reseptör türevleri de CD4 antijenin veya ko-reseptörlerinin hücre yüzeyine bağlanmasını engelleyebilir.
|
||||||||||||||||||||||||||||||
 AMD3100 From NIAID
AMD3100 From NIAID |
Gp120 proteininin koreseptörler ile etkileşimini engelleyen ilaçlar Bazı kemokinlerin enfeksiyonu önlediği keşfedildiğinde koreseptörler tedavi alanında hedef haline gelmiştir. CCR5 HİV için bir koreseptördür ve CCR5 eksikliği olan kişiler HİV enfeksiyonuna karşı dirençlidir. CCR5 eksikliği olan kişiler normal ve sağlıklı kişilerdir. Bu durum CCR5in hedef alınarak immün sistemde ciddi yan etkilere yol açmadan enfeksiyonun önlenebileceğini düşündürmüştür. RANTES, CCR5e bağlanan bir kemokindir. Bir RANTES analoğunun reseptörden herhangi bir sinyal iletilmeden HİV enfeksiyonunu engellediği gösterilmiştir. CCR5 koreseptör antagonistleri sinsityum oluşturan virüs türlerinin seçilerek çoğalmasına neden olurlar. Bu türler CXCR4 koreseptörlerini kullanabildikleri için RANTES analoglarına karşı dirençlidirler. Ayrıca, kemokin türevleri peptid ya da protein yapıda oldukları için oral yolla alınamazlar ve kısa yarı ömürleri vardır. Koreseptörlere karşı monoklonal antikorlar daha etkilidir ancak onlar da oral olarak alınamazlar.
|
||||||||||||||||||||||||||||||
 T20 From NIAID
T20 From NIAID |
Gp41 ile etkileşime girerek bağlanmayı engelleyen ilaçlar
|
||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
Nükleokapsidin soyulmasını engelleyen ilaçlar Soyulma süreci tam olarak
anlaşılamamıştır. Ancak siklofilin A isimli bir hücre proteini ile ilişkili
olduğu düşünülmektedir. Viral kapsidde bulunan bu proteinin varlığı prodüktif
bir enfeksiyon için gereklidir. Bununla birlikte, in vitro çalışmalarda mutant
virüslerin siklofilin A proteinini içermediği gösterilmiştir. |
|||||||||||||||||||||||||||||||
Isentress (Raltegravir) |
İntegraz aktivitesini engelleyen ilaçlar Yeni viral partiküllerin yapımı için viral DNAnın konak hücre kromozumuna entegre olması gerekir. Spesifik bir antiviral ajan için bu aşama ideal bir hedeftir. Çünkü insanlarda homolog bir enzimi yoktur. Bu integrasyonu sağlayan integraz enzimi bloke eden yeni sınıf antiretroviral ilaçlar geliştirilmiştir.
|
||||||||||||||||||||||||||||||
|
Posttranslasyonel değişiklikleri bloke eden ilaçlar Matriks proteinleri açilasyona, yüzey glikoproteinleri glikozilasyona uğrar. Bu aşamalar da ilaç tedavisi için potansiyel hedeflerdir.
|
|||||||||||||||||||||||||||||||
|
Nükleik asit bazlı rejimler
|
|||||||||||||||||||||||||||||||
|
Tiyol bazlı rejimler
N-asetil sistein ve prosistein hücre içinde GSHın
yükseltgenmesine neden olurlar ve latent enfekte hücrelerde HİVi inaktive
ederler. 1,2-dithiole-3-thione, aynı şekilde GSH yükseltgenmesine yol açar
ve revers transkriptaz enzimini geri dönüşümsüz olarak inhibe eder. |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||


