![]()

Dr Richard Hunt
VIROLOGÍA – CAPÍTULO SIETE
PARTE SIETE
EL VIRUS DE LA INMUNODEFICIENCIA HUMANA Y EL SIDA
Componentes y Ciclo de Vida del VIH
Traducido por :
Sarah M. Castillo - Jorge, Clinica Corominas
Santiago, Rep. Dominicana
VIDEOCONFERENCIA
EN INGLÉS
ENLACES A OTRAS SECCIONES DE VIH Y SIDA AL FINAL DE ESTAPAGINA
HAGA CLICK EN LOS RECUADROS GRISES PARA VENTANAS RAPIDAS CON MÁS INFORMACIÓN
HAGA CLICK EN LOS RECUADROS AMARILLOS PARA SER REDIRECCIONADO A OTROS CAPÍTULOS

Micrografía electrónica del VIH (pulse para agrandar) - Núcleos coniformes seccionados en varias orientaciones. ARN genómico viral localizado en la parte electrodensa del núcleo. CDC/Dr. Edwin P. Ewing, Jr. epe1@cdc.gov

Diagrama de las localización de las proteínas en el VIH
Diagrama recortado del VIH.
Del Dr. Milan V.Nermut del Instituto Nacional para los Estándares y el
Control Biológico. Herts, U.K. Gráficos computarizados por A.Davies
Figura 14 – Estructura del VIH
Figura 14a El gen gag
ESTRUCTURA
COMPONENTES DEL VIH
El VIH es un retrovirus con una estructura similar a la de otros retrovirus (vea capítulo seis, virus oncogénicos).
ESTRUCTURAS DE SUPERFICIE
Membrana Viral
La membrana deriva del huésped como resultado de la yemación a través de la
superficie celular (figura 15). Algunas proteínas del huésped se incorporan a la
membrana viral. Esta envoltura lipídica hace que el virus sea susceptible a
solventes orgánicos.
Glicoproteína de
superficie
La Gp160 es codificada por el gen env (envoltura). La Gp160 es dividida
luego de la traducción por enzimas del huésped en el Cuerpo de Golgi para formas
las Gp120 (SU) y Gp41 (TM). La Gp 41 está embebida en la membrana, la Gp120 no
pero está fija a la Gp41 mediante enlaces no covalentes (figura 14). Es
fácilmente descamada de la partícula viral. Nota: las Gp120 y Gp41 están hechas
de un único polipéptido. Hay un gran número de cadenas de azúcares en la gp120
(lo cual supone un problema para la creación de vacunas). La Gp120 es la
proteína que interactúa con un receptor en la célula a ser infectada. La Gp41 es
el fusógeno que es expuesto luego de que la Gp120 se ha fijado a la célula.
ESTRUCTURAS INTERNAS
Proteínas
estructurales internas
Estas
están todas codificadas por el gen gag (antígeno grupo-específico)
(figura 14a). La proteína de matriz P17 (MA) cubre la superficie interna de la
membrana viral a la cual se adhiere por ácido mirístico con enlaces covalentes.
Otras proteínas están asociadas a la nucleocápside. El antígeno grupo-específico
está hecho de como poli proteína y es segmentada durante o después de la
yemación del virus por una proteasa codificada por el mismo mediante el gen
pol.
Otras proteínas
internas
Estas
están codificadas por el gen pol (polimerasa). Son enzimas que participan
en la integración y replicación:
- Transcriptasa inversa – copia el genoma de ARN en una doble cadena de ADN
- Integrasa - integra el ADN de cadena doble en el cromosoma de la célula huésped
- Proteasa – separa las poli proteínas codificadas por los genes pol y gag
Para más información sobre la estructura de los retrovirus y su replicación, refiérase al capítulo seis, virus oncogénicos
GenomaAl igual que en otros retrovirus, el genoma es un ARN diploide de sentido positivo (vea la sección 9)

Figura
15
VIH yemando de una célula infectada
CDC
 Figura 15a
Figura 15a
Estadios del VIH en yemación.
A. Las proteínas internas se ensamblan en la membrana celular y se ven
como una capa electrodensa en la superficie interna.
B. El virus yema con las proteínas internas en una forma de herradura o
de rosquilla.
C. Las proteínas internas son separadas y condensadas para formar una
masa interna coniforme (la nucleocápside). La flecha señala un virus que
todavía está fijo a una célula huésped. En este estadio ya ha ocurrido
la condensación.
D. Esta imagen muestra el cono seccionado en diferentes planos
HISTORIA VITAL DEL VIH
Células que son infectadas por el VIH
El VIH lisa específicamente las células T4, causando una profunda inmuno-supresión. Otras células tienden a albergar y replicar el virus sin ninguna lisis o, en el caso de las células dendríticas, pueden concentrar el virus en la superficie celular sin replicación del mismo. Los principales tipos de células infectadas por el VIH se muestran en la figura 15c.
Células colaboradoras T4 CD4+
El VIH conlleva a la enfermedad como resultado de una depletación de las células colaboradoras T4 CD4+ y la consiguiente inhabilidad para combatir infecciones oportunistas. Las células T4, y esto no es de sorprender, son el tipo celular más infectado por el virus. Las células colaboradoras T4 CD4+ infectadas se vuelven diana de las células asesinas CD8+ VIH-específicas pero también son eliminadas por otras causas (vea la parte 10). Durante la fase temprana de la infección aguda, se pierde la mayor parte de las células T4 CD4+ de las mucosas, mientras que durante la infección crónica que puede durar años, las células T4 CD4+ generalmente proliferan y mueren como resultado de la activación inmune y otros factores.
Las células infectadas que son detectables en el paciente en fase crónica de la infección son generalmente células T4 de memoria mientras que las células T inactivadas (Th0) exhiben la infección con una frecuencia mucho menor. El paciente infectado por el VIH tiene una tasa mayor de lo normal de proliferación de células T4 como resultado de la estimulación inmunológica general y estas células son las dianas del VIH (que sólo infecta células T CD4+ activadas). Por tanto, el VIH induce una oferta constante de sus células diana conllevando mayores rondas de replicación y de destrucción inmunológica. El hecho de que el VIH tenga a las células T4 VIH-activadas implica la disminución de células T4, repletando así la parte del sistema inmune que pudiera controlar la replicación viral.
Como se menciona en otras secciones (parte 8), luego de la activación por un antígeno específico, las células T4 o se muere o se convierte en células de memoria no proliferativas que son rápidamente movilizadas si hay una re-exposición al antígeno. Este reservorio latente de células T4 infectadas puede permanece muchos años, aún en la presencia de los fármacos anti-VIH actuales (HAART- terapia anti-retroviral altamente activa)) que parece suprimir completamente la replicación del VIH. Esto sucede porque cuando una célula T4 infectada se revierte a un estado de reposo, de memoria, ya no replica el virus (o sea que ya no sintetiza proteínas virales ni genoma ARN genómico) pero la célula aún alberga una copia de ADN del VIH (el pro virus) integrada en sus cromosomas. Así que cuando las células son reactivadas mediante el antígeno, la replicación viral se reanuda.
Células asesinas naturales (NK)
Estas también son células T CD4+ e interactúa con células dendríticas. Además del antígeno CD4, expresan el co-receptor CCR5 y por tanto son infectadas por aquellas cepas del VIH que requieran de CCR5 para entrar a una célula.
Células asesinas CD8+
Estas células expresan bajos niveles del antígeno CD4 cuando son activadas y parece infectarse en grupos de pequeña cantidad por el VIH en las fases más tardías de la enfermedad. Las células CD8 inactivadas no expresan el antígeno CD4 y parece que no se infectan (aunque sí expresa co-receptores).
Macrófagos
Los monocitos/macrófagos expresan el antígeno CD4 (aunque en menor medida que las células T4) y también son infectados por el VIH. Pueden proveer un importante reservorio para el virus dentro del huésped y pueden ser especialmente importantes en los pacientes tratados con la terapia HAART. Los macrófagos también se unen a la gp120 del VIH mediante el sindecan, un proteoglicano con heparán sulfato y mediante el antígeno CD91 que interactúa con las proteínas de choque térmico (heat shock proteins) que el virus adquirió de la célula en la que se replicó. Los virus absortos por macrófagos pueden transmitirse a otras células incluyendo a las células T4.
Células de sistema nervioso
El VIH infecta a oligodendrocitos, astrocitos, neuronas, células gliales y macrófagos cerebrales. Las formas macrófago – trópicas se encuentran en el líquido cerebroespinal (cefalorraquídeo). El VIH causa enfermedad del sistema nervioso central lo cual puede resultar de la pequeña proteína, Tat, que es codificada por el virus y que actúa como una transactivador general del proceso de transcripción. Esta proteína se une a células nerviosas mediante el antígeno CD91 y es incorporada. Como resultado, se altera el metabolismo celular (por ejemplo la señalización del óxido nítrico). Se cree que el VIH también compromete la integridad de la barrera hemato-retiniana.
El VIH en el cerebro y en el líquido cefalorraquídeo puede ser particularmente resistente a la quimioterapia dada la incapacidad de los fármacos antiretrovirales de penetrar la barrera hematoencefálica.
Células dendríticas
Las células dendríticas foliculares (CDFs) son importantes en la biología del VIH. Estas sin células presentadoras de antígenos que procesan antígenos y presentan péptidos a las células T. No son rápidamente infectadas por el VIH, aunque pueden ser productivamente infectadas porque tienen pocos receptores de VIH (antígeno CD4 y los co-receptores CCR5 y CXCR4 – vea más adelante). Importantemente, estas células atrapan al VIH en sus superficies dado que tienen una lectina de superficie (denominada molécula no-integrina 3-fijadora de adhesión intercelular específica o DC-SIGN) que se fija al componente carbohidrato de la gp120 del VIH. La fijación de la DC-SIGN no permite la fusión de la membrana viral con la CDF (lo cual necesita del antígeno CD4) y por eso la infección no se da por esta ruta; no obstante, esta proteína también participa en la asociación de las CDFs con linfocitos y se acumula en los sitios de interacción CDF-linfocitos. Por tanto, el virus unido se concentra justo en el sitio de interacción de la CDF con la célula CD4+ (figura 15 b). Más aún, los receptores y co-receptores del VIH en la célula T4 también parecen acumularse allí.
Cuando el VIH entra al cuerpo por mediante las mucosas (epitelio de la vagina, pene o recto), es adherido a CDFs que migran a los nódulos linfáticos; en donde presentan el VIH a células T4, que luego se infectan.
|
Más sobre la DC-SIGN, células dendríticas y presentación del VIH a células T4 |
 Figura 15b
Figura 15bLa interacción de una célula dendrítica (derecha) con un linfocito (izquierda). El VIH unido a la superficie de la célula dendrítica se acumula en el sitio de interacción entre ambas células (flecha), facilitando así la infección del linfocito. En las células T4, los receptores del VIH se concentran también ahí
Steve Haley - William Bowers - Richard Hunt
 Figura 15c
Figura 15c
Células infectadas por el VIH
 Figura 15d
Figura 15d
Entrada del VIH mediante las mucosas y tránsito vía las células dendríticas
hacia los nódulos linfáticos
La necesidad de la expresión del antígeno CD4 para la entrada del VIH a las células humanas. Las células HeLa no poseen el antígeno CD4 y no se infectan. Las células HeLa transfectadas con el gen CD4 sí se infectan
Figura 16El antígeno CD4 es el receptor del VIH
La temprana observación en la historia del VIH y del SIDA de la aparente especificidad de la infección de células CD4+, junto con la observación de que las células T4 se disminuyen durante la enfermedad (de hecho, el curso de la enfermedad es pautado mediante los niveles de células T CD4+), sugirió que el antígeno CD4 puede ser el receptor del virus. Esto se demostró al transfectar el gen del antígeno CD4 a células humanas CD4- (tales como las células HeLa del carcinoma cervical) y demostrando que éstas adquirían la propiedad de ser infectadas por el VIH (figura 16). El antígeno CD4 es el principal receptor de tanto del VIH-1 y el VIH-2 en las células T4 y en otras células que pueden ser infectadas por el VIH.
Un co-receptor para la infección del VIH
El experimento en el que el antígeno CD4 fue transfectado a células que luego adquirían la habilidad de ser infectadas por el VIH sólo funciona cuando la célula transfectada es humana. Si se realiza el mismo experimento con células 3T3 de ratas, el virus puede unirse a la superficie celular con los antígeno CD4, pero la infección no sobreviene. Por tanto, es necesario algo más aparte del antígeno CD4.
También se descubrió que algunas cepas del VIH (aquellas adaptadas a vivir en células T transformadas) podían infectar y replicarse en células T activadas pero no en monocitos ni macrófagos. En cambio, aquellas adaptadas a vivir en macrófagos no podían infectar ni replicarse en células T transformadas. Aún así, tanto los macrófagos como las células T4 portan el antígeno CD4. Las diferencias e el tropismo de las cepas virales mapeadas a la región V3 de la gp120 sugirieron que otras moléculas aparte del antígeno CD4 tenían algún papel importante en la infección y que este papel era específico a las células CD4+.
Los receptores de quimiocinas parecen ser la clave para la entrada a la célula – una familia de proteínas en la superficie de células del sistema inmune
Las quimiocinas son pequeñas proteínas secretadas que son quimiotácticas para células del sistema inmune como los leucocitos que se mueven a favor del gradiente de quimiocinas secretadas por otras células; entonces, el control de la posición temporal y espacial de los leucocitos durante una respuesta inmune. Las quimiocinas se dividen en dos grupos de acuerdo al motivo dicisteína que conservan. Estos son los grupos C-C y C-X-C. Se unen a la superficie celular mediante moléculas receptoras que son proteínas integrales de membrana que atraviesan siete veces la membrana (receptores serpentinos transmembranales). Los receptores se nombran según el tipo de citosina al que se unen (CCR- o CXCR-).
- CCR5. Varios laboratorios identificaron un co-receptor esencial para aquellas cepas del VIH involucradas en las fases críticas tempranas de la infección (estas son las cepas macrófago-trópicas). Todos estos estudios encontraron que el CCR5 acompañaba al CD4 cuando se permitía la entrada a los macrófagos.
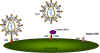
Receptores de quimiocina que se involucran, junto al antígeno CD4, en la infección por el VIH (izquierda). La quimiocina puede bloquear la fijación del virus a sus receptores (medio). Las mutaciones en el receptor de la quimiocina puede llevar a resistencia a la infección por el VIH (derecha)
Figura 17A

Fijación del VIH a una célula CD4+. El dominio externo de la gp120 se une al
antígeno CD4. Esto lleva a un cambio conformacional en la gp120 y así se
expone un sitio de unión de un co-receptor. Esta región de la gp120 se une
al receptor de quimiocina. Esta unión provoca otro cambio conformacional de
modo que las regiones de la proteína gp41 del VIH interactúe para formar un
dominio de fusión que permita que las membranas viral y celular se unan.
Como resultado el núcleo viral entra al citoplasma.
Figura 17B
El descubrimiento de esta molécula como una co-receptor derivó de estudios previos que mostraron que tres quimiocinas secretadas por los linfocitos T CD8+ (llamadas RANTES, MIP-1a y MIP-1b), involucradas en las respuestas inflamatorias, eran potentes supresores de la infección del VIH, y especialmente del VIH macrófago-trópico. Por supuesto, esto sugería que la supresión de la infección podría ser causa de las quimiocinas unidas a la superficie celular y bloqueaban el receptor que el VIH necesitaba para penetrar la célula. Y las sospechas se volvieron sobre el CCR5 que ya era conocido como un receptor que se unía a las tres quimiocinas antes mencionadas (figura 17a).
- CXCR4 (también llamado fusina). Este también es un co-receptor para el VIH en células CD4+ que de otro modo no pudieran ser infectadas por el VIH. El CXCR4 es un receptor acoplado a una proteína G cuyo ligando es un factor estimulante de células B –se llama fusina porque promueve la infección/fusión de las células CD4+. La cantidad de fusina en una superficie celular puede explicar las diferencias en el tropismo y la fusina parece ser más activa en las células T que en los macrófagos. Note que el gen de la fusina se asemeja al gen del receptor IL-8 (también un receptor de quimiocinas)
- Se ha encontrado otro co-receptor (CCR2)
Complejos de partes del CD4 y de la Gp120 también se unen al CCR5 en células CD4-. Esto explica porqué el CD4 soluble en efecto aumenta la infectividad del VIH y no lo bloquea. Parece que la Gp120 se une al CD4 y sufre un cambio conformacional que aumenta su afinidad por el receptor de quimiocinas. La unión al receptor de quimiocina causa otro cambio conformacional en la proteína de fusión gp41 del VIH que permite la fusión o fijación de la membrana viral con la membrana de la célula a ser infectada. De hecho, realmente es el receptor de quimiocina el que es el receptor principal del VIH y el papel del CD4 es concentrar el virus en la superficie celular y facilitar su interacción con el receptor de quimiocina (figura 17b). Sin embargo, a diferencia de los ejemplos de entrada del VIH a células CD4-independientes, no hay (hasta ahora) ningún ejemplo de entrada independiente de los receptores de quimiocinas.
Estos co-receptores pueden explicar el cambio fenotípico durante la infección (vea más adelante). Los cambios en la secuencia de aminoácidos de la Gp120 se dan durante la progresión de la enfermedad. Es probable que el VIH use el CCR5 en etapas tempranas de la enfermedad y luego cambia al CXCR4, quizás para evitar la actividad supresora de las quimiocinas. Esto también explica la forma de transición de un fenotipo inductor de sincitio a uno no inductor de sincitio. Nota: CXCR4 y CCR5 pertenecen a una larga familia de receptores y la diseminación del VIH a los diferentes subtipos de células T puede reflejar los sutiles cambios de los rizos variables de la Gp120 permitiendo la infección de nuevas células CD4+ con diferentes receptores. Esto también puede ser una de las razones de porqué tan pocas células CD4+ parecen ser infectadas en un momento determinado.
| CCR5 y VIH en África | CCR5 y las infecciones con el virus del Oeste del Nilo |
Algunas células CD4-negativas pueden ser infectadas por el VIH
Originalmente se creyó que sólo las células portadoras del antígeno CD4 podían ser infectadas por el VIH. Aunque no se ha demostrado la presencia del CD4 en algunas células infectables, se creía que estaba presente en pocas cantidades y el ARNm del antígeno CD4 podía detectarse en la mayoría de las células susceptibles a esta infección. La especificidad hacia las células CD4 positivas refleja a unión específica de la Gp120 al CD4. Hoy en día, sin embargo, se conoce que algunas células no CD4, tales como aquellas en el cerebro e intestino, pueden ser infectadas mediante un receptor de galactocerebrósido. Otras células pueden infectarse de otra manera; por ejemplo, en macrófagos (vea más adelante) un Fc o un receptor de complemento puede ser usado. En estos casos, el VIH debe de estar unido a anticuerpos anti-VIH que interactúan con receptores de la superficie celular. Por tanto, cualquier cosa que pueda producir una regulación a-la-alta de los receptores Fc en los macrófagos podrá aumentar la infección.
Entrada a la célula: fusión pH-independiente con la membrana plasmática
No se necesita de ningún cambio conformacional pH-dependiente en la membrana viral para la fusión con la membrana de la célula a ser infectada. Por tanto, no se requiere de ninguna entrada a los lisosomas.
Recuerde las secciones sobre los herpes virus que este tipo de fusión se asocia con la formación de sincitios por la fusión de células infectadas. La formación de sincitios también es algo característico de la infección del VIH (figura 18). Esto tiene un profundo significado en la diseminación celular de la infección sin la implicación del virus libre. Esto significa que el virus puede difundirse de célula a célula de forma que los anticuerpos circulantes del sistema inmune no tienen ningún efecto (inconveniente para la vacuna). No sólo tendría una vacuna que ser capaz de destruir el virus, sino también debería de ser capaz de destruir células infectadas. La Gp41 es el fusógeno. Los sincitios se ven con más frecuencia en el cerebro.
Transcriptasa inversa e integración
Esto es similar a otros retrovirus. El VIH usa la transcriptasa inversa importada durante la infección como parte del virus. La nucleocápside entra al citoplasma y ocurre la transcripción inversa dentro de la nucleocápside. En células T4 inactivas en reposo, el pro virus (forma del ADN) permanece en el citoplasma, posiblemente dada la carencia del ATP necesario para la importación dependiente de energía del complejo de pre-integración al núcleo. La mayoría de los virus que se replican en el núcleo pueden hacerlo sólo en células en división pero la división celular no es esencial para la replicación del VIH. Eso es porque dos proteínas virales (la Vpr y una de las proteínas GAG) tienen señales de localización nuclear y por tanto no es necesario el rompimiento de la membrana nuclear con la mitosis, lo que permite al ADN viral penetrar a los cromosomas.
Integración
Luego de la pérdida de la envoltura y la entrada al núcleo, podemos encontrar tanto la forma linear como la forma circular del ADN viral. El ADN viral linear de cadena doble se inserta a los cromosomas de la célula huésped usando la proteína viral integrasa (traducida del gen pol). Luego de la integración, el ARN viral se transcribe mediante una ARN polimerasa II.
ANIMACIONES
Diapositivas en formato del PowerPoint de la entrada del VIH (aquí)
Vídeo clip de Shockwave de ;a entrada del VIH
(aquí)
Requiere del plug-in Shockwave/Flash
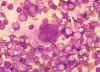
Célula multinucleada (sincitio) en preparaciones de cortes de nódulos linfáticos de un paciente con una infección por el VIH-1. La fusión celular con la creación de grandes células multinucleadas es un efecto citopático característico del virus, pero no diagnóstico, de una infección por el VIH-1. Tinción Giemsa. Frotis de linfadenopatía. CDC/Dr. Edwin P. Ewing, Jr. epe1@cdc.gov
Figura 18
 Ensamblaje del virus ocurre en la superficie de la membrana celular
Ensamblaje del virus ocurre en la superficie de la membrana celular
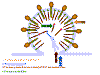
El virus yema y la proteasa se libera de la poli proteína POL

Más segmentación proteolítica ocurre y el virus se madura
Formación de las
poli proteínas y su “clivaje” o segmentación
El ensamblaje de los nuevos virus tiene lugar en la membrana de la célula huésped (figura 19). Hay tres tipos de proteínas que constituyen el virión. Estas son el complejo de proteínas de membrana (Gp120 y Gp41 – originalmente derivadas de la Gp160) más dos precursores de proteínas internas, la poli proteína Gag y la poli proteína Gag/Pol (esta última es resultado de una cambio en el marco de lectura que permite al ribosoma continuar la traducción del gen Gag en el gen Pol)
Estas proteínas se agregan a la membrana celular y la membrana se estrecha (figura 19 y 20). El precursor interno más grande (Gag-Pol) tira de dos hebras del ARN positivo hacia el virión naciente y la proteasa (parte de la proteína Gag-Pol) se libera a sí misma. La proteasa completa la segmentación del Gag-Pol para liberar otras enzimas (transcriptasa inversa, integrasa y otras proteasas). La proteasa también segmenta el resto del Gag-Pol y del Gag en proteínas estructurales. p24, p7 y p6 forman el núcleo en forma de bala mientras que la p24 permanece debajo de la membrana
Nota: Las proteínas de fusión Gag y Gag/Pol se sintetizan en una proporción 20:1. Luego de que el virus ha yemado de la célula, la proteasa se libera a sí misma y libera el resto de las proteínas en Gag o Gag/Pol, liberando varias proteínas estructurales y a la transcriptasa inversa. Esta proteasa específica es viral puesto que las proteínas virales no son funcionales a menos que se les separe. Esta especificidad hace de la proteasa una buena candidata para la inhibición por parte de los fármacos anti-VIH (vea apéndice 3 y quimioterapia). Gag/Pol y Gag se unen a la membrana viral mediante un ácido graso con enlaces covalentes. La segmentación deja a la p17 unida a la membrana
La Gp160 se traduce de una ARNm único empalmado en asociación con el retículo endoplásmico y es una proteína integral de membrana que sólo atraviesa la membrana una vez. En el retículo endoplásmico, es glicosilada antes de ser transferida al aparato de Golgi en donde se continúa la glicosilación y la segmentación por una enzima del huésped de gp120 a gp41. Se moviliza a la membrana celular mediante la vía exocítica. Contrario a las proteínas Gag y Gag-Pol, la gp160 no es segmentada por la proteasa viral.
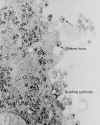
Micrografía de transmisión de electrones del VIH-1, yemando y en estado libre CDC
Figura 20
OTRAS SECCIONES SOBRE EL VIH
PARTE I VIRUS DE LA INMUNODEFICIENCIA HUMANA Y EL SIDA
PARTE II VIH Y SIDA, LA ENFERMEDAD
PARTE III CURSO CLÍNICO DE LA ENFERMEDAD
PARTE IV PROGRESIÓN Y COFACTORES
PARTE VI SUBTIPOS Y CO-RECEPTORES
PARTE VII COMPONENTES Y CICLO DE VIDA DEL VIH
PARTE X PERDIDA DE CÉLULAS CD4
PARTE XI OTRAS CÉLULAS INFECTADAS POR EL VIH Y POLIMORFISMOS POBLACIONALES
APÉNDICE II ¿ES EL VIH CAUSA DE SIDA?
APÉNDICE III QUIMIOTERAPIA ANTI-VIH